Слайд 2
Основные понятия
При растворении солей в воде происходит не
только диссоциация на ионы и гидратация этих ионов, но
и взаимодействие молекул воды с ионами, приводящее к разложению молекул воды на Н+ и ОН– с присоединением одного из них к иону соли и освобождением другого.
При этом изменяется рН раствора.
Слайд 3
Процесс обменного разложения воды ионами соли называется –
гидролиз.
Слайд 4
Гидролиз происходит лишь в тех случаях, когда ионы,
образующиеся в результате электролитической диссоциации соли – катион или
анион или оба вместе – способны образовывать с ионами воды слабодиссоциирующие соединения.
Слайд 5
Гидролизу подвергаются:
Катион слабого основания
Al3+; Fe3+; Bi3+ и
др.
Анион слабой кислоты
CO32-; SO32–; NO2–; CN–; S2– и др.
Слайд 6
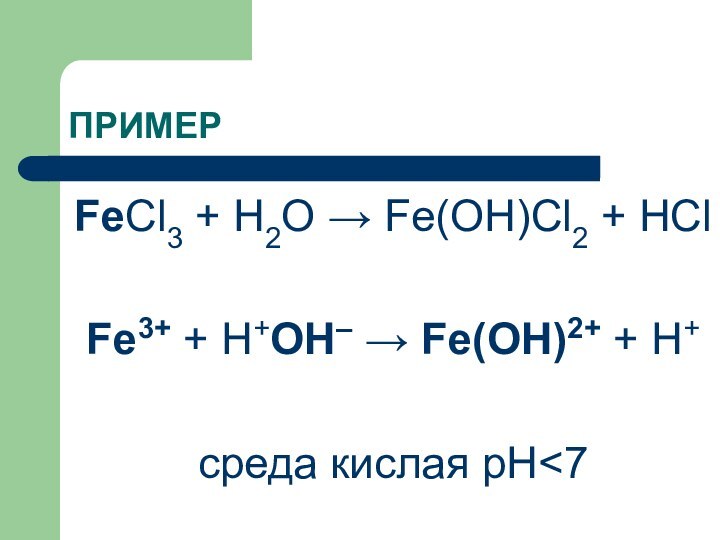
ПРИМЕР
FeCl3 + H2O → Fe(OH)Cl2 + HCl
Fe3+ +
Н+ОН– → Fe(OH)2+ + H+
среда кислая рН
Слайд 7
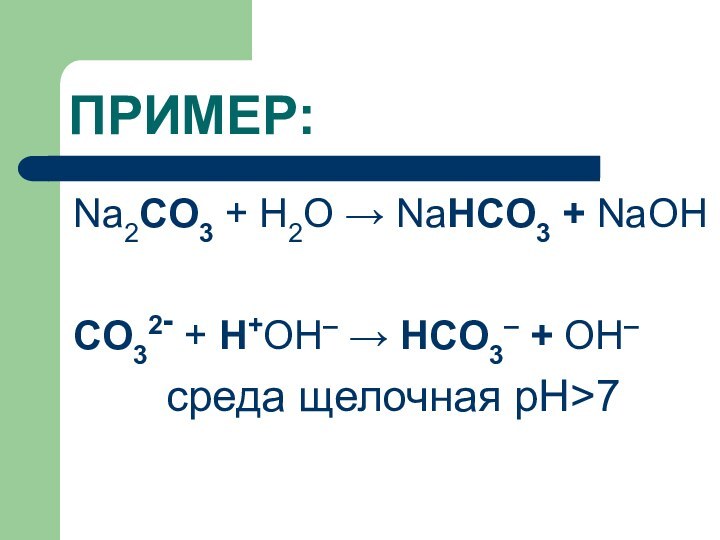
ПРИМЕР:
Na2CO3 + H2O → NaHCO3 + NaОН
CO32- +
Н+ОН– → HCO3– + ОН–
среда щелочная рН>7
Слайд 8
Гидролизу НЕ подвергаются:
Катион сильного основания
Na+; Ca2+; K+
и др.
Анион сильной кислоты
Cl–; SO42–; NO3–; и др.
Слайд 9
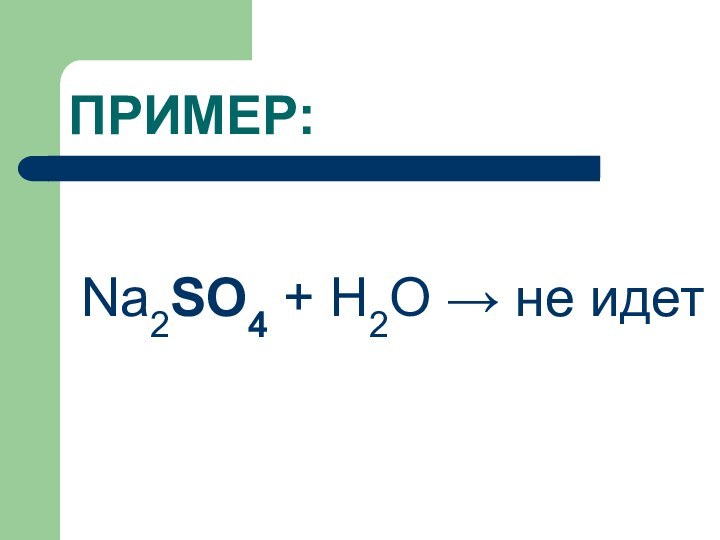
ПРИМЕР:
Na2SO4 + H2O → не идет
Слайд 10
Закономерности гидролиза разбавленных растворов солей:
Протекает:
Гидролиз соли слабого основания
и сильной кислоты
Гидролиз соли слабой кислоты и сильного основания
Гидролиз
соли слабой кислоты и слабого основания
Не протекает:
Гидролиз соли сильного основания и сильной кислоты
Слайд 11
Гидролиз соли слабого основания и сильной кислоты
Проходит по
катиону, при этом может образоваться слабое основание или основная
соль. рН раствора уменьшится.
AlCl3 + H2O → Al(OH)Cl2 + HCl
Al3+ + Н+ОН– → Al(OH)2+ + H+
Cl- + H2O → не идет
среда кислая рН<7
Слайд 12
Гидролиз соли слабой кислоты и сильного основания
Проходит по
аниону, при этом может образоваться слабая кислота или кислая
соль. рН раствора увеличится.
NaSO3 + H2O → NaHSO3 + NaОН
SO32– + Н+ОН– → HSO3– + ОН–
среда щелочная рН>7
Слайд 13
Гидролиз соли слабой кислоты и слабого основания
Обычно проходит
нацело с образованием слабой кислоты и слабого основания;
рН раствора
при этом незначительно отличается от 7 и определяется относительной силой кислоты и основания:
Al2(SO3)3 + 6H2O → 2Al(OH)3 ↓ + 3H2SO3
H2SO3 → H2O + SO2↑
Слайд 14
Реакция в этом случае идет до конца, так
как при гидролизе катиона образуется Н+:
Al3+ + Н+ОН– →
Al(OH)2+ + H+
при гидролизе аниона − ОН– :
SO32– + Н+ОН– → HSO3– + ОН–
далее происходит образование из них Н2О (с выделением энергии), что и смещает равновесие гидролиза вправо.
Слайд 15
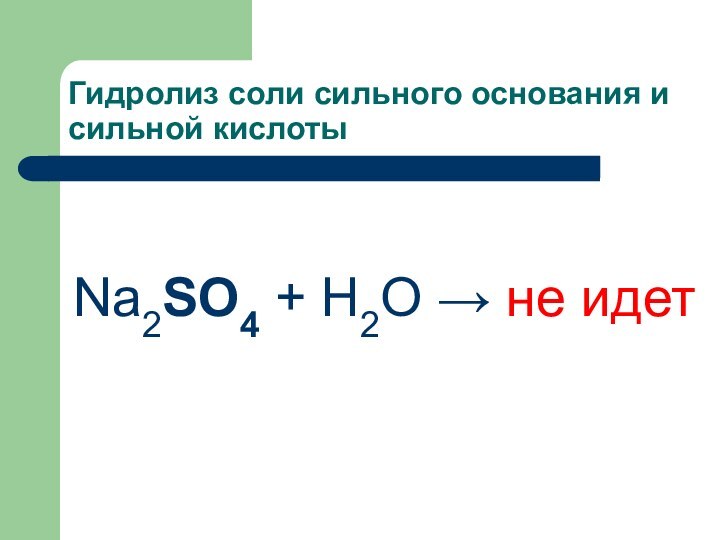
Гидролиз соли сильного основания и сильной кислоты
Na2SO4 +
H2O → не идет
Слайд 16
ПРЕДОТВРАЩЕНИЕ ГИДРОЛИЗА
Во многих случаях необходимо предотвратить гидролиз.
Эта
задача решается как обычная задача смещения равновесия: необходимо добавлять
в раствор:
- сильную кислоту (при гидролизе по катиону)
- щелочь (гидролиз по аниону).
Слайд 17
Количественные характеристики гидролиза
Степень гидролиза αг (доля гидролизованных
единиц)
Константа гидролиза - Кг.
Слайд 18
Константа гидролиза
Константу гидролиза можно выразить через:
КW- ионное
произведение воды
Кд - константа диссоциации
слабой кислоты (Кд.к)
основания
(Кд.осн)
Слайд 20
Пример: Гидролиз аниона
А− + Н2О→НА + ОН−
Слайд 21
Пример: Гидролиз катиона
M+ + Н2О→MOH + Н+
Слайд 22
Гидролиз соли слабого основания и слабой кислоты
Слайд 23
Степень гидролиза
Между Кг и αг существует такая же
связь, как между Кд и αд :
Слайд 24
ПРИМЕР:
При смешивании растворов Al2(SO4)3 и Na2CO3 выпадает осадок
и выделяется газ. Составьте ионное и молекулярное уравнения происходящих
процессов.
Слайд 25
ПРИМЕР:
Добавлением каких из приведенных веществ можно уменьшить гидролиз
соли Na2CO3
а) НСl,
б) NaOH
в) Na2S
Слайд 26
ПРИМЕР:
Определить αг, Кг и рН
0,01 Н раствора
Na(CH3COO), если константа диссоциации уксусной кислоты равна 1,8⋅10−5 .
Слайд 27
ПРИМЕР:
Указать, не производя вычислений, какая из двух солей
− Na2SO3 или Na2CO3 сильнее гидролизуется?














![Примеры гидролиза Кw = [H+].[OH–] = 10–14](/img/tmb/12/1163494/e07d5289e46e30dcb707fe4b38314bf6-720x.jpg)








