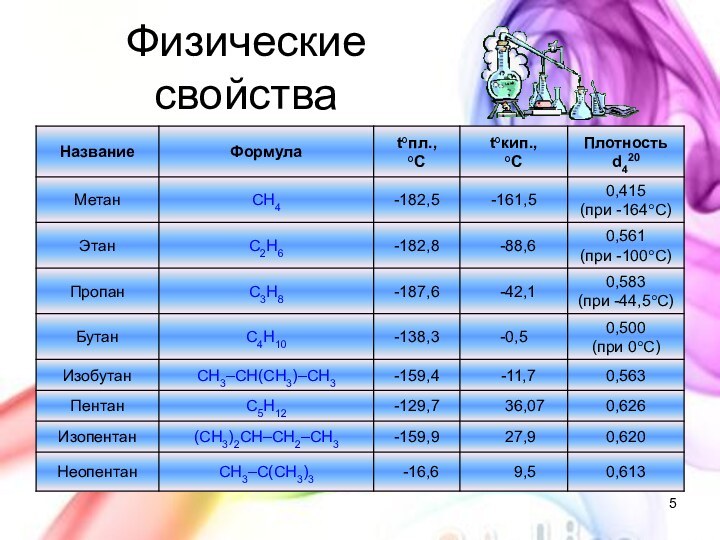
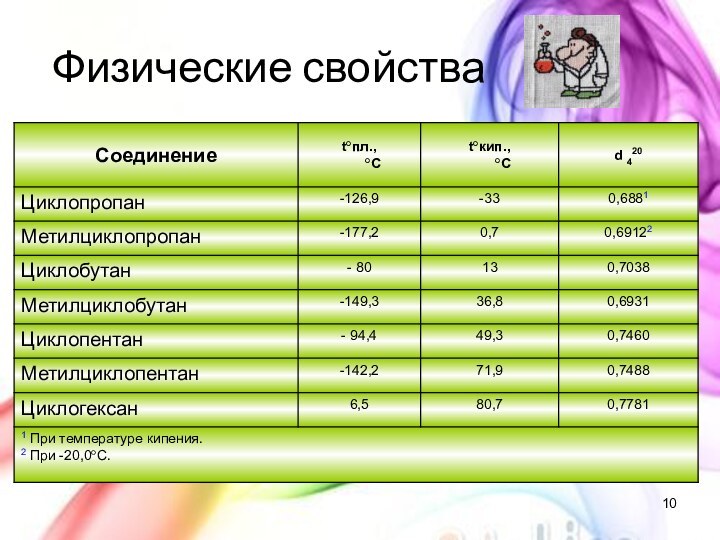
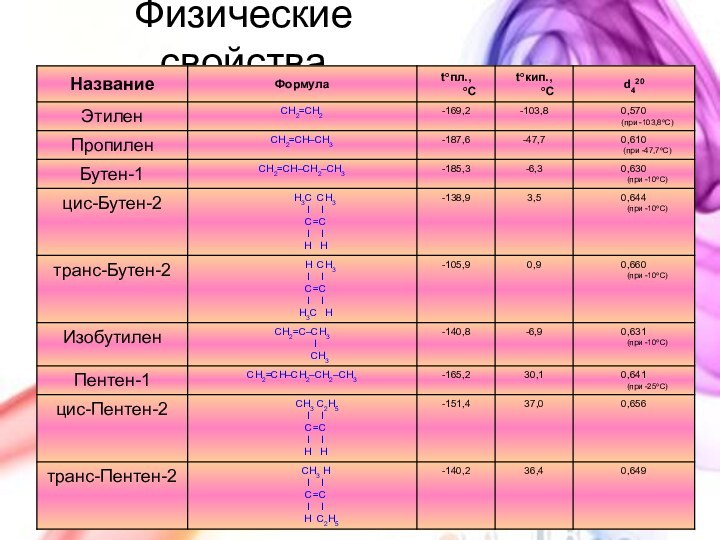
с открытой цепью, в которых атомы углерода соединены друг
с другом простыми (одинарными) связями, а остальные свободные их валентности насыщены атомами водорода. В обычных условиях алканы мало реакционноспособны, откуда возникло их название "парафины" – от лат. parrum affinis – малоактивный.Общая формула
CnH2n+2
Предельные