- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Производство аммиака
Содержание
- 2. Цели работы:Изучить процесс производства аммиакаИзучить условия протекания реакцииИзучить пользу и вред производства
- 3. Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный
- 4. Сырье для производства аммиака.1) Азот – N₂
- 5. Аммиак один из важнейших продуктов химической промышленности,
- 6. Себестоимость производства аммиака в России одна из
- 7. Для наглядности, рассмотрим пример модернизации для снижения
- 8. В настоящее время в России и странах
- 9. Таблица.1Условия протекания реакции Синтез аммиака из
- 10. В настоящее время синтез аммиака
- 11. В период разработки промышленного
- 12. На долю России приходится около 9 % мирового
- 13. Аммиакопровод России Аммиакопрово́д — трубопровод, предназначенный для перекачки аммиака, то
- 14. Магистральный аммиакопровод «Тольятти-Горловка-Одесса» – это технологический комплекс,
- 15. Трасса аммиакопровода «Тольятти-Одесса» идет с северо-востока на юго-запад
- 16. Аммиак ядовит. ПДК = 20 мг/м3. Жидкий
- 17. Отравление аммиаком вызывает сильное возбуждение, вплоть до
- 18. Но даже несмотря на то, что производство
- 19. Использование аммиака
- 20. Медики используют водные растворы аммиака
- 21. Скачать презентацию
- 22. Похожие презентации
Цели работы:Изучить процесс производства аммиакаИзучить условия протекания реакцииИзучить пользу и вред производства


















Слайд 2
Цели работы:
Изучить процесс производства аммиака
Изучить условия протекания реакции
Изучить
пользу и вред производства
Слайд 3 Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ
с резким характерным запахом (запах нашатырного спирта), почти вдвое легче
воздуха, очень ядовит. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.М (NH3) = 17 г/моль
Нашатырный спирт – 10%-ный раствор аммиака
Слайд 4
Сырье для производства аммиака.
1) Азот – N₂ (из
воздуха)
2) Водород - H₂ (из природных горючих газов, богатых
метаном - CH₄; или из газов, получающихся при химической переработке каменного угля и нефти)3)Катализатор – порошкообразное железо с примесью оксидов алюминия и калия.
Слайд 5 Аммиак один из важнейших продуктов химической промышленности, как
в странах СНГ так и во всём мире. Ежегодное
мировое производство аммиака достигает 150 млн. тонн. Россия входит в десятку лидеров по производству аммиака.Слайд 6 Себестоимость производства аммиака в России одна из самых
низких на мировых просторах производителей. Всё это потому, что
Россия может сама обеспечить себя сырьем. Однако, технологии производства прошловековые, соответственно ресурсопотребление и энергопотребление выше чем на новых предприятиях Аргентины, Австралии, Венесуэле. Это лишь говорит о том, что модернизация необходима, не смотря на качели на мировом рынке, вероятен рост цен на исходное сырье и следственно рост цен на производство аммиака.Слайд 7 Для наглядности, рассмотрим пример модернизации для снижения сырьевых
ресурсов. В среднем в России на производство одной тонны
аммиака расходуется свыше тысячи кубометров сырья, примерно 1200м³. После модернизации ожидается 800-900м³Слайд 8 В настоящее время в России и странах СНГ
работает 22 агрегата аммиака мощностью 450000 тонн в год.
Слайд 9
Таблица.1
Условия протекания реакции
Синтез аммиака из водорода
N2 и водорода H2 – реакция обратимая, экзотермическая, протекает
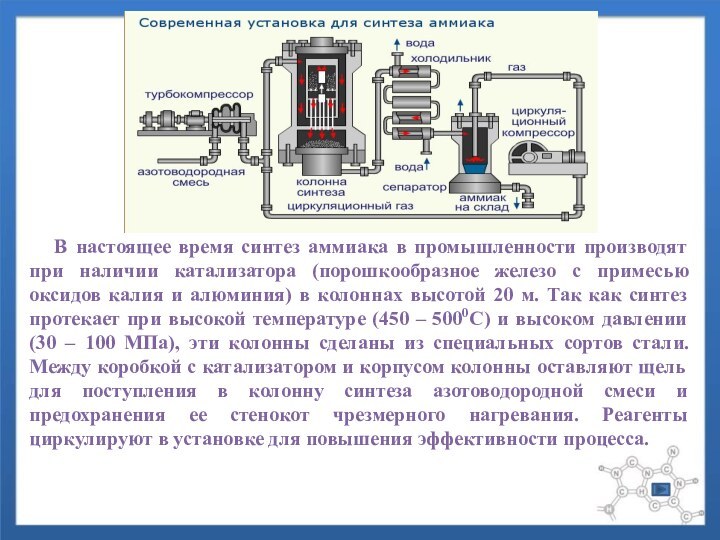
с уменьшением объёма. Поиски условий синтеза в течение почти всего XIX века носили только экспериментальный характер.Слайд 10 В настоящее время синтез аммиака в
промышленности производят при наличии катализатора (порошкообразное железо с примесью
оксидов калия и алюминия) в колоннах высотой 20 м. Так как синтез протекает при высокой температуре (450 – 5000С) и высоком давлении (30 – 100 МПа), эти колонны сделаны из специальных сортов стали. Между коробкой с катализатором и корпусом колонны оставляют щель для поступления в колонну синтеза азотоводородной смеси и предохранения ее стенокот чрезмерного нагревания. Реагенты циркулируют в установке для повышения эффективности процесса.Слайд 11 В период разработки промышленного способа
синтеза аммиака проводились многочисленные исследования в поисках активных катализаторов.
Были испытаны тысячи веществ по принципу «испробовать все вероятное, а также невероятное». Результат оказался удивительным: катализатором оказалось железо, каталитические свойства которого были известны уже сто лет до для реакции разложения аммиака. Точнее не чистое железо, а «активированное», т.е. с примесями оксидов алюминия и калия.Поиск катализатора
Слайд 12 На долю России приходится около 9 % мирового выпуска
аммиака. Россия — один из крупнейших мировых экспортеров аммиака.
На экспорт поставляется около 25 % от общего объёма производства аммиака, что составляет около 16 % мирового экспорта.
Слайд 13
Аммиакопровод России
Аммиакопрово́д — трубопровод, предназначенный для перекачки аммиака, то есть сложное
инженерное сооружение. В данном вопросе можно рассмотреть такой уникальный,
по своей длине и мощностях аммиакопровод «Тольятти-Горловка-Одесса», уникальный хотя бы потому, что разделен между двумя государствами Россией и Украиной практически пополам.Слайд 14 Магистральный аммиакопровод «Тольятти-Горловка-Одесса» – это технологический комплекс, который
функционирует как единая транспортная система и выполняет транзитные, международные,
межрегиональные поставки жидкого аммиака.Слайд 15 Трасса аммиакопровода «Тольятти-Одесса» идет с северо-востока на юго-запад по
территории Самарской, Саратовской, Тамбовской, Воронежской, Белгородской, Луганской, Харьковской, Запорожской,
Днепропетровской, Николаевской, Херсонской и Одесской областей.Слайд 16 Аммиак ядовит. ПДК = 20 мг/м3. Жидкий аммиак
вызывает сильные ожоги. При содержании в воздухе 0,5% по
объему аммиак сильно раздражает слизистые оболочки. При остром отравлении поражаются глаза и дыхательные пути. При хроническом отравлении — расстройство пищеварения, катар верхних дыхательных путей, ослабление слуха.Физиологическое действие аммиака на организм человека
Слайд 17 Отравление аммиаком вызывает сильное возбуждение, вплоть до буйного
бреда, а последствия могут быть весьма тяжелыми – до снижения
интеллекта и изменения личности. Очевидно, аммиак способен поражать жизненно важные центры, так что при работе с ним надо тщательно соблюдать меры предосторожности.Вред производства аммиака
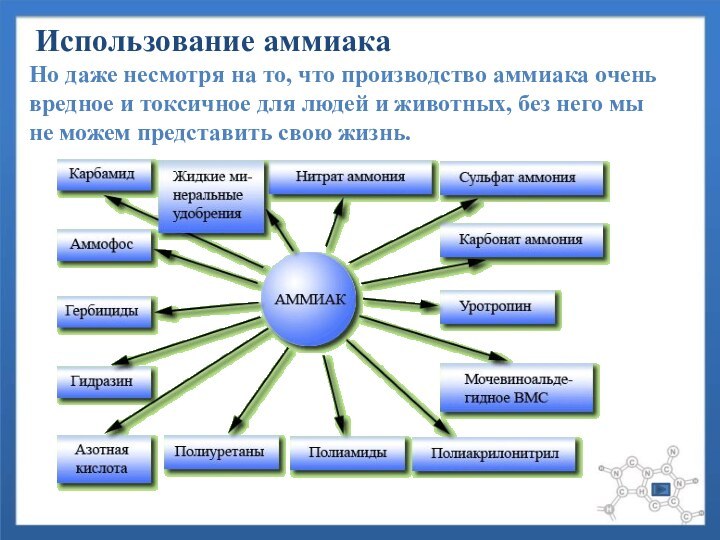
Слайд 18 Но даже несмотря на то, что производство аммиака
очень вредное и токсичное для людей и животных, без
него мы не можем представить свою жизнь.Использование аммиака
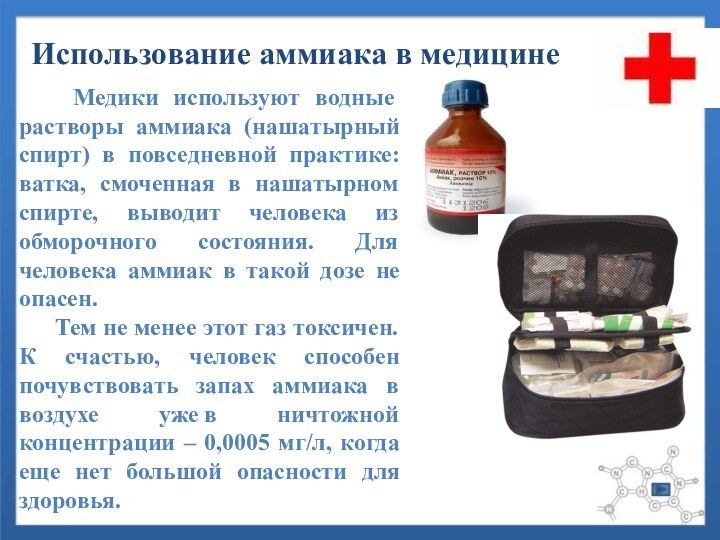
Слайд 20 Медики используют водные растворы аммиака (нашатырный
спирт) в повседневной практике: ватка, смоченная в нашатырном спирте,
выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.Тем не менее этот газ токсичен. К счастью, человек способен почувствовать запах аммиака в воздухе уже в ничтожной концентрации – 0,0005 мг/л, когда еще нет большой опасности для здоровья.
Использование аммиака в медицине





























