- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему к уроку Виды химической связи
Содержание
- 2. Под химической связью понимаются электрические силы притяжения,
- 3. Причина образования химической связи — стремление атомов
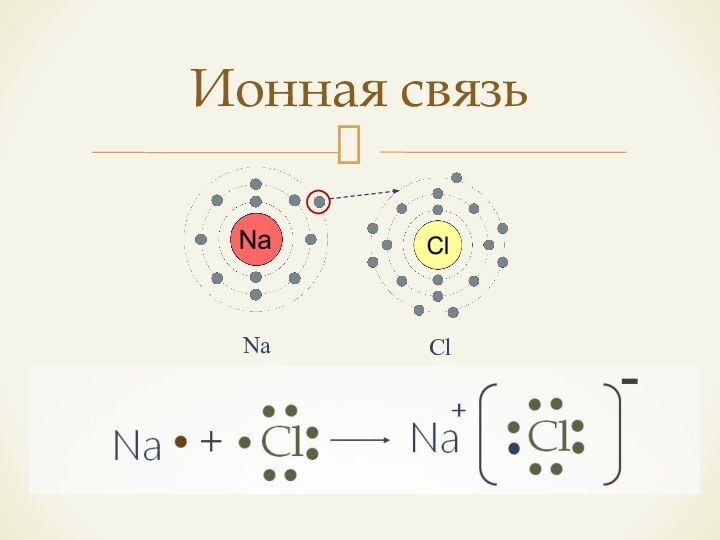
- 4. Ионная связьNaCl
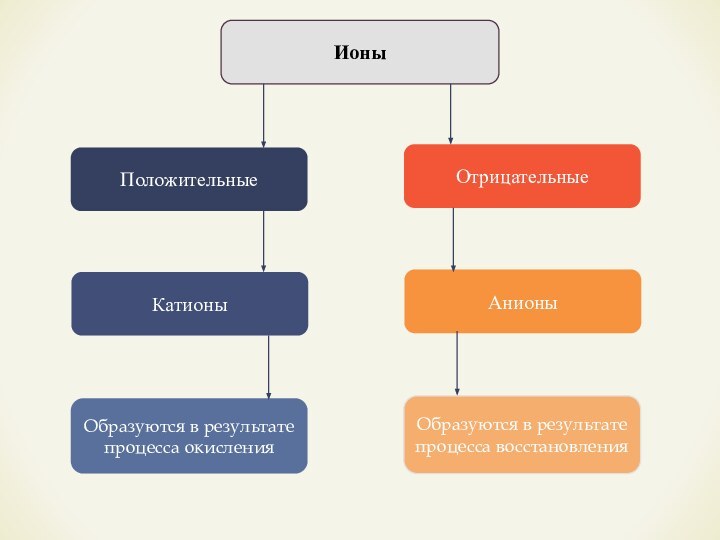
- 5. ИоныПоложительныеОтрицательныеКатионыОбразуются в результате процесса окисленияАнионыОбразуются в результате процесса восстановления
- 6. Как правило, ионная связь возникает между атомами типичных металлов и типичных неметаллов.
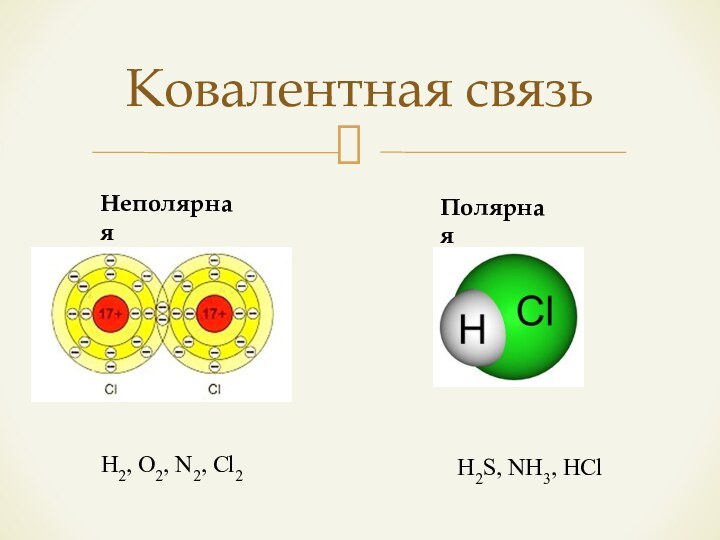
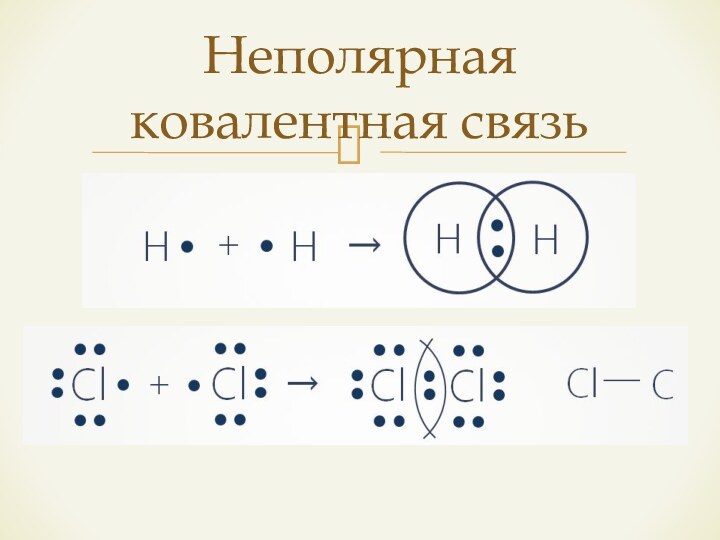
- 7. Ковалентная связьНеполярнаяПолярная H2, O2, N2, Cl2 H2S, NH3, HCl
- 8. Неполярная ковалентная связь
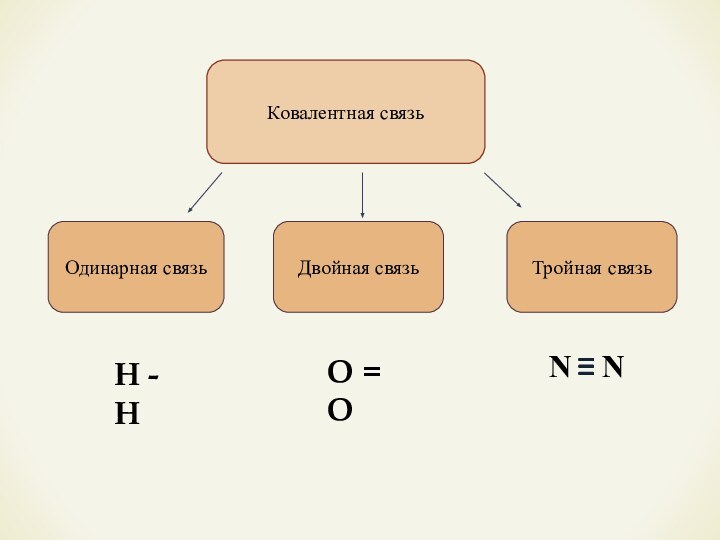
- 9. Ковалентная связьОдинарная связьДвойная связьТройная связьО = ОН - Н
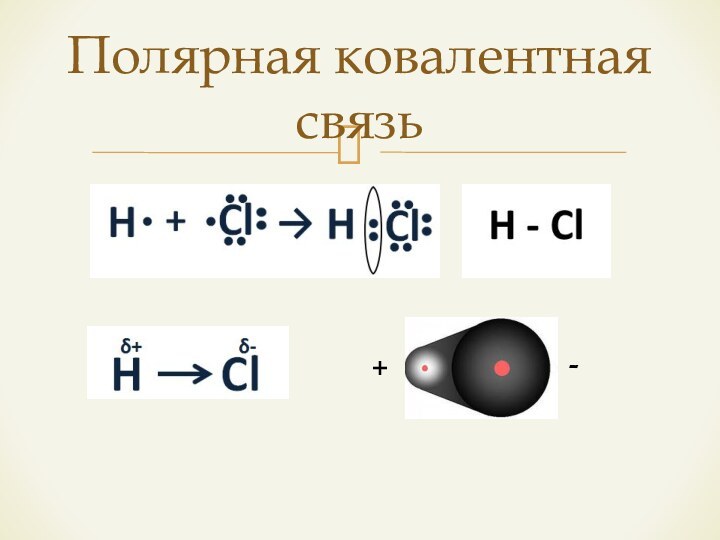
- 10. Полярная ковалентная связь+-
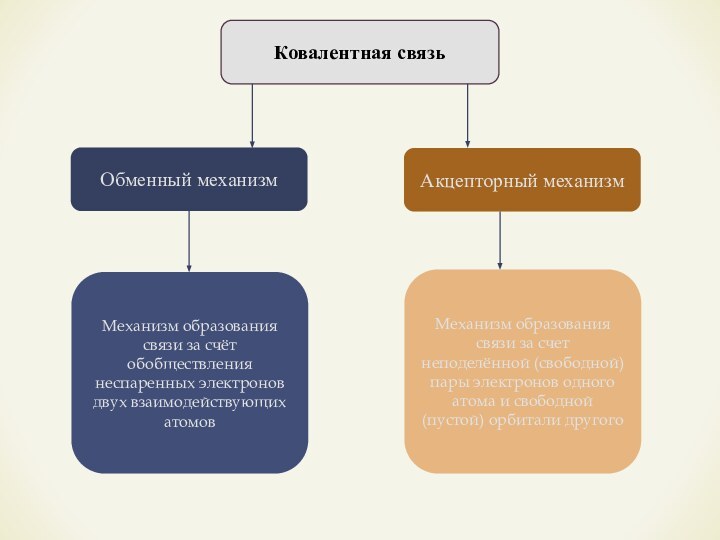
- 11. Ковалентная связьОбменный механизмАкцепторный механизмМеханизм образования связи за
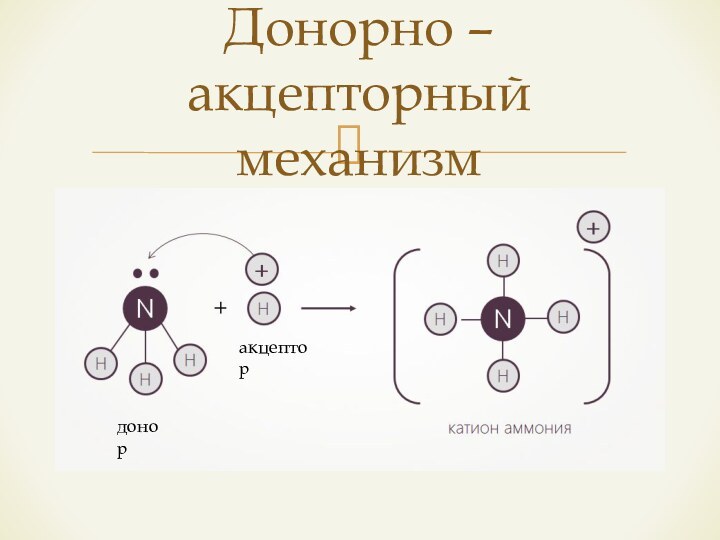
- 12. Донорно – акцепторный механизмдоноракцептор
- 13. Металлическая связьМеталлическая связь — химическая связь между
- 14. Сходство металлической связи с ионной проявляется в
- 15. Межмолекулярная водородная связь – это связь между
- 16. Скачать презентацию
- 17. Похожие презентации
Под химической связью понимаются электрические силы притяжения, удерживающие частицы друг около друга. Частицами могут быть атомы, ионы, молекулы.

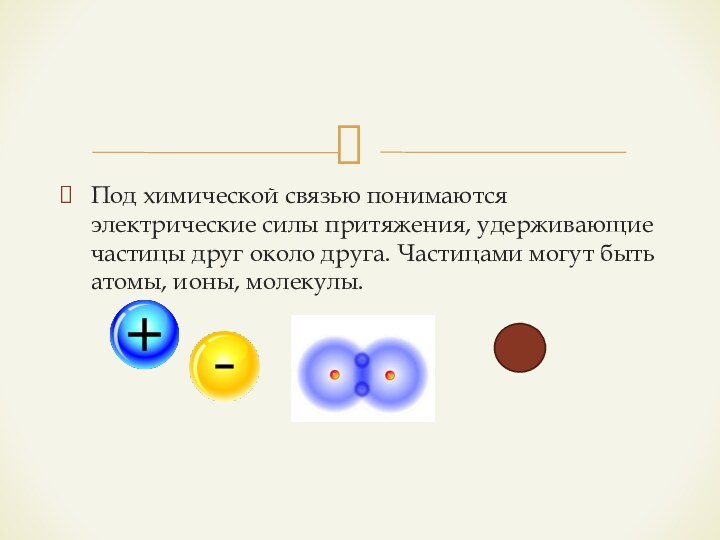


Слайд 3 Причина образования химической связи — стремление атомов посредством
взаимодействия с другими атомами достичь более устойчивого состояния.
Электроотрицательность (ЭО)
– способность притягивать электроны.Если атомы обладают одинаковой ЭО, возникает ковалентная неполярная связь;
Если атомы обладают ЭО разной, но не резко отличаются, разность в ЭО < 1,7 – возникает ковалентная полярная связь;
Если атомы обладают ЭО разной, резко отличаются, разность в ЭО > 1,7 – возникает ионная связь.
Слайд 5
Ионы
Положительные
Отрицательные
Катионы
Образуются в результате процесса окисления
Анионы
Образуются в результате процесса
восстановления
Слайд 11
Ковалентная связь
Обменный механизм
Акцепторный механизм
Механизм образования связи за счёт
обобществления неспаренных электронов двух взаимодействующих атомов
Механизм образования связи за
счет неподелённой (свободной) пары электронов одного атома и свободной (пустой) орбитали другого
Слайд 13
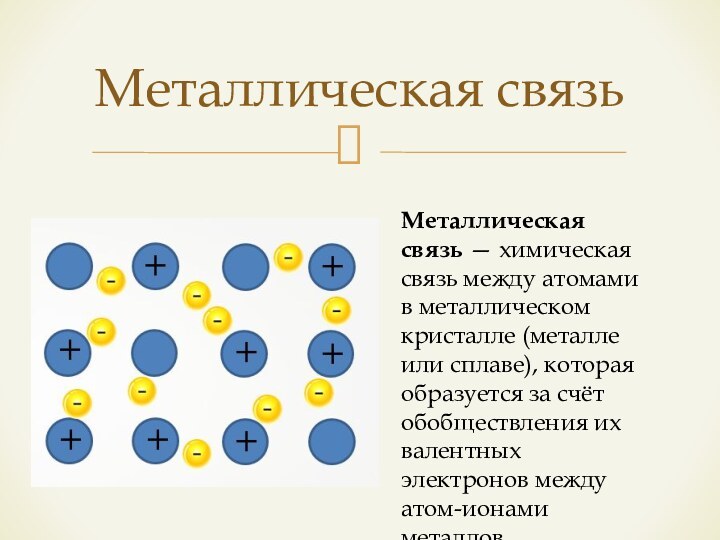
Металлическая связь
Металлическая связь — химическая связь между атомами
в металлическом кристалле (металле или сплаве), которая образуется за
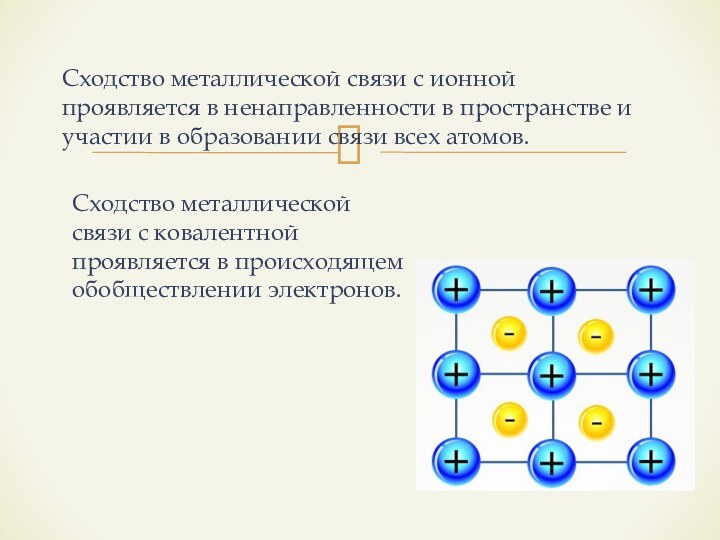
счёт обобществления их валентных электронов между атом-ионами металлов.Слайд 14 Сходство металлической связи с ионной проявляется в ненаправленности
в пространстве и участии в образовании связи всех атомов.
Сходство
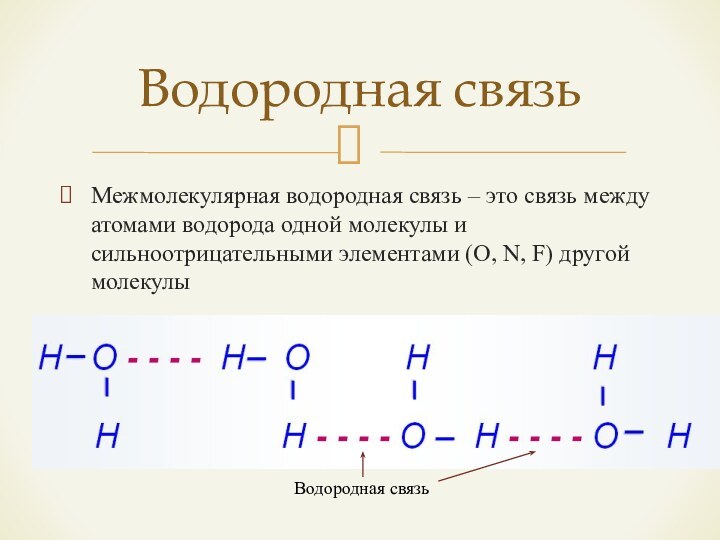
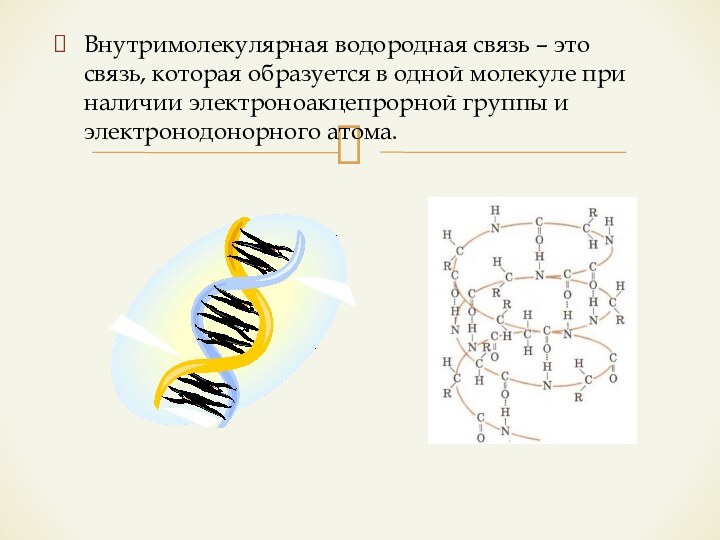
металлической связи с ковалентной проявляется в происходящем обобществлении электронов.Слайд 15 Межмолекулярная водородная связь – это связь между атомами
водорода одной молекулы и сильноотрицательными элементами (O, N, F)
другой молекулыВодородная связь
Водородная связь





























