- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему к занятию по химии. Тема: Электролитическая диссоциация
Содержание
- 2. ЦелиОбобщить и систематизировать имеющиеся у обучающихся знания
- 3. Истина, друзья, проста: Щелочь, соль и
- 4. Экспериментопустим электроды в стакан с твердым хлоридом
- 5. Вспомните определение понятия «электрический ток» и предположите, почему в ходе эксперимента мы получили именно такие результаты?Эксперимент
- 6. Древнеримский оратор Цицерон считал, что правильно построенная речь содержит ответы на семь вопросов:Почему?Что?Когда?Где?Как?Чем?Зачем?
- 7. Электролитическая диссоциацияпроцесс распада вещества на ионы при
- 8. Классическая теория электролитической диссоциацииШведский химик С.Аррениус в
- 9. Значение теории электролитической диссоциациипоистине велико и не
- 10. Процесс электролитической диссоциацииМолекулы воды представляют собой диполи,
- 11. Процесс электролитической диссоциацииКак правило легче диссоциируют вещества
- 13. Степень электролитической диссоциации - степень электролитической диссоциации
- 14. Подумайте?Чему способствует процесс электролитической диссоциации в растворе?Какие вещества можно отнести к электролитам? Каковы их особенности?
- 15. Электролитвещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах
- 16. Сильные электролитыэто соединения, которые в водных растворах
- 17. Слабые электролитыв незначительной степени распадаются на ионыих
- 18. Интересные фактыРусские химики И.А. Каблуков и В.А.
- 19. Вопросы и задания на закреплениеОт чего зависит
- 20. Скачать презентацию
- 21. Похожие презентации
ЦелиОбобщить и систематизировать имеющиеся у обучающихся знания об электролитической диссоциацииПродолжить формирование учебно-познавательной, информационной и коммуникативной компетенцийСпособствовать развитию умений анализировать, обобщать, систематизировать, выбирать главное, делать выводы


















Слайд 2
Цели
Обобщить и систематизировать имеющиеся у обучающихся знания об
электролитической диссоциации
умений анализировать, обобщать, систематизировать, выбирать главное, делать выводыСлайд 3 Истина, друзья, проста: Щелочь, соль и кислота Пропускают
ток всегда, Если их раствор – вода. Почему же
кислород, Спирт, глюкоза и азот, Растворенные в воде, Не пропустят ток нигде? Потому что вещества – Неживые существа, И зависят свойства их, Сложных и совсем простых, От строения частиц, Микромира без границ. А раствор, где ток бурлит, Назван был электролит.
Слайд 4
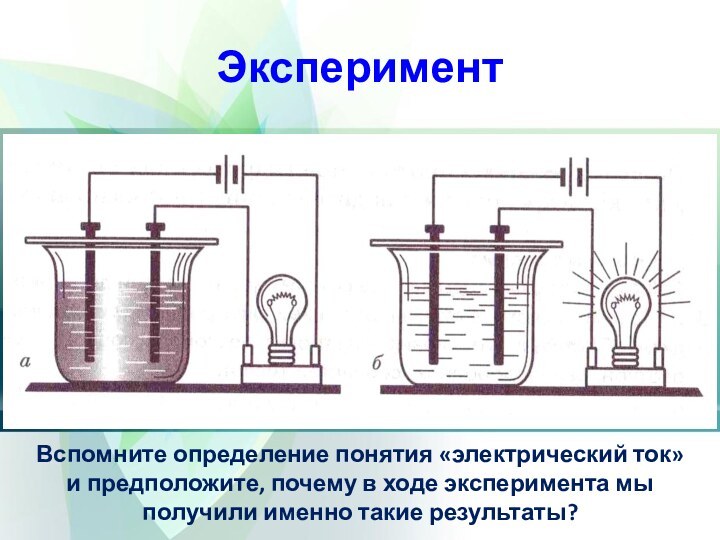
Эксперимент
опустим электроды в стакан с твердым хлоридом натрия
и в стакан с сахаром. Лампочка не загорается.
опустим
электроды в стакан с дистиллированной водой, лампочка тоже не загорается.опустим электроды в водные растворы хлорида натрия и сахара, лампочка загорается только тогда, когда электроды находились в стакане с раствором хлорида натрия
Слайд 5 Вспомните определение понятия «электрический ток» и предположите, почему
в ходе эксперимента мы получили именно такие результаты?
Эксперимент
Слайд 6 Древнеримский оратор Цицерон считал, что правильно построенная речь
содержит ответы на семь вопросов:
Почему?
Что?
Когда?
Где?
Как?
Чем?
Зачем?
Слайд 7
Электролитическая диссоциация
процесс распада вещества на ионы при его
растворении или расплавлении
CaCl2 = Ca2+ + 2Cl-
HNO3 = H+
+ NO3-Что?
Слайд 8
Классическая теория электролитической диссоциации
Шведский химик С.Аррениус в 1887
году предположил, что вещества-электролиты в водном растворе «дробятся» не
до молекул, а до более мелких частиц – ионовКогда? Где?
Слайд 9
Значение теории электролитической диссоциации
поистине велико и не ограничивается
только рамками химии
эта теория была широко и плодотворно применена
для объяснения многочисленных физических и химических явлений в растворах, расплавах и даже твердых телахпод ее влияние получила признание и сильную поддержку ранее высказанная Гельмгльцем идея об атомистической природе электричества
тем самым атомно-молекулярные и электрические представления слились в одно целое, что открыло путь к изучению механизма превращения химической энергии в электрическую
Зачем?
Слайд 10
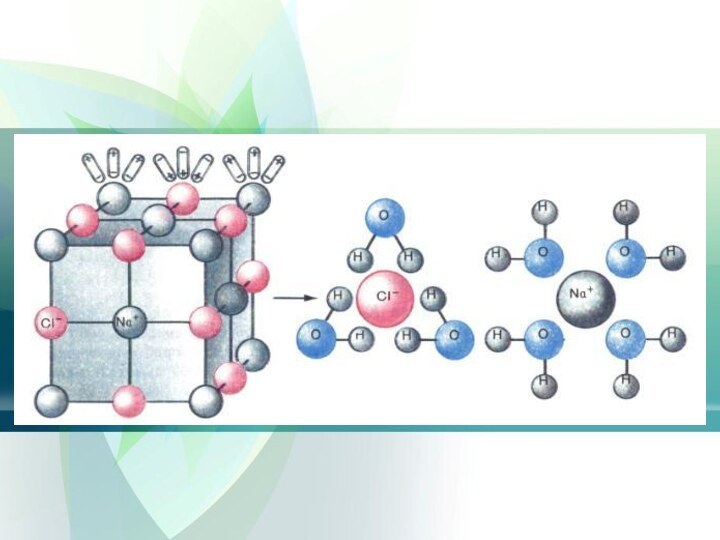
Процесс электролитической диссоциации
Молекулы воды представляют собой диполи, имеют
два полюса «+» и «-»
Атомы водорода расположены под углом
104,5Чем?
Слайд 11
Процесс электролитической диссоциации
Как правило легче диссоциируют вещества с
ионной связью, а значит с ионной кристаллической решеткой.
При
их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролитаМежду ионами электролита и диполями воды возникает взаимное притяжение
В результате связь между ионами ослабевает и происходит переход ионов из кристалла в раствор
Как? Почему?
Слайд 13
Степень электролитической диссоциации
- степень электролитической диссоциации –
отношение числа молей электролита, распавшегося на ионы (nд), к
общему числу молей электролита (n) в растворе: = nд / n
Степень диссоциации указывают в долях единицы или в процентах
Физический смысл этой величины в том, что она показывает долю электролита, распавшегося на ионы.
Слайд 14
Подумайте?
Чему способствует процесс электролитической диссоциации в растворе?
Какие вещества
можно отнести к электролитам? Каковы их особенности?
Слайд 15
Электролит
вещество, которое проводит электрический ток вследствие диссоциации на
ионы, что происходит в растворах и расплавах
Слайд 16
Сильные электролиты
это соединения, которые в водных растворах практически
полностью диссоциируют на ионы
их степень электролитической диссоциации () стремится
к единице или 100%сильными электролитами являются практически все соли, неорганический кислоты (HCl, HBr, HI, HNO3, H2SO4 ), щелочи
Слайд 17
Слабые электролиты
в незначительной степени распадаются на ионы
их степень
электролитической диссоциации стремится к нулю
к ним относятся органические кислоты,
некоторые неорганические кислоты (H2S, H2CO3, HCN, HNO2, HClO), гидрат аммиака NH3 * H2O, вода
Слайд 18
Интересные факты
Русские химики И.А. Каблуков и В.А. Кистяковский,
доказали, что при растворении электролита происходит взаимодействие растворённого вещества
с водой, что приводит к образованию гидратов, которые затем распадаются на ионыЗа заслуги в развитии теории электролитической диссоциации Сванте Аррениус был удостоен Нобелевской премии
Слайд 19
Вопросы и задания на закрепление
От чего зависит степень
электролитической диссоциации?
Напишите уравнения диссоциации веществ: HI, H2S, Ca(NO3)2, HClO,
HNO2В 1 л воды растворили 171 г сульфата алюминия. Какое количество вещества ионов каждого типа будет содержать этот раствор? Какова степень электролитической диссоциации веществ данного типа?
При одинаковой концентрации растворов степень диссоциации серной кислоты равна 60%, а уксусной – 1,4%. Что вы можете сказать о силе этих кислот?





























