Слайд 2
1. В молекуле Cl2 тип связи:
а) ковалентная полярная; б)
ковалентная неполярная; в) ионная
2. В молекуле Н2О тип связи:
а) ковалентная
полярная; б) ковалентная неполярная; в) ионная
3. В молекуле NaF тип связи:
а) ковалентная полярная; б) ковалентная неполярная; в) ионная
Слайд 3
4. В образовании ионной связи принимают участие:
а) атомы
одного и того же неметалла; б) металл и неметалл;
в) атомы разных неметаллов.
5. В образовании ковалентной полярной связи принимают участие:
а) атомы одного и того же неметалла; б) металл и неметалл; в) атомы разных неметаллов.
Слайд 4
6. В образовании ковалентной неполярной связи принимают участие:
а) атомы
одного и того же неметалла; б) металл и неметалл;
в) атомы разных неметаллов.
7. В веществах металлах возникает связь: а) ионная, б) ковалентная неполярная, в) металлическая
Состояние вещества
Твердое Жидкое Газообразное
Состояние вещества
Твердое Жидкое Газообразное
Стекло (дополнить) (дополнить)
Железо
Соль
Твердое
вещество
Аморфное Кристаллическое
нет определенной tпл определенная tпл
пластилин соль
мука сахар
пластмасса графит
Слайд 9
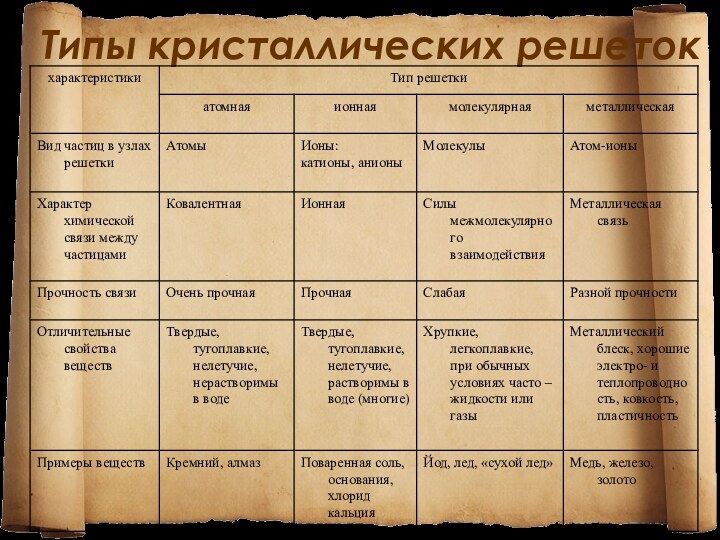
Кристаллические решётки - это упорядоченное
расположение частиц (атомов, молекул, ионов) в строго определённых точках
пространства.
Узлы решётки - точки размещения частиц.
Слайд 11
Физминутка
Зайцы бегали в лесу, (бег на месте)
Повстречали там
лису (повилять «хвостиком»)
Прыг-скок, прыг-скок, (прыжки на месте)
Убежали под кусток.
(присесть)
Слайд 12
ИОННЫЕ
Ионные кристаллические решётки - кристаллические решетки, в узлах
которых находятся ионы. Таким типом решёток обладают вещества с
ионной связью.
Ионные кристаллические решётки характерны для солей, некоторых гидроксидов и оксидов металлов.
Связи между ионами в кристалле очень прочные и устойчивые. Физические свойства веществ с ионной решёткой: высокая твёрдость, тугоплавкость, прочность, нелетучесть.
Слайд 13
Атомные
Атомные решётки - кристаллические решётки, содержащие в узлах
отдельные атомы, которые соединены очень прочными ковалентными связями.
Выше
показана кристаллическая решётка алмаза. Вещества с атомной решёткой: бор, кремний, германий, кварц, алмаз. Их свойства: высокие температуры плавления, повышенная твёрдость.
Слайд 14
Молекулярные
Молекулярные решётки - кристаллические решётки, в узлах которых
располагаются молекулы. Химические связи в них ковалентные (полярные и
неполярные). Связи в молекулах прочные, но между молекулами - не прочные.
Выше представлена кристаллическая решётка I2. Физические свойства веществ: малая твёрдость, плавятся при низкой температуре, летучие, при обычных условиях газы или жидкости.
Слайд 15
Металлические
Металлические кристаллические решётки - решётки, в узлах которых
находятся атомы и ионы металла. Физические свойства металлов: пластичность,
ковкость, металлический блеск, высокая электро- и теплопроводность
Слайд 17
ЗПС (Закон постоянства состава
Жозеф Луи Пруст. 1808 г.
родился 26 сентября 1754 г. в небольшом городке Анжере
в семье аптекаря
1775 г. он был назначен на должность управляющего аптекой больницы Сальпетриер
1777 г. Пруст получил приглашение на кафедру химии и металлургии недавно основанной Королевской семинарии в Вергаре (Испания)
1785 г. король Испании Карл III пригласил Пруста на должность профессора химии Артиллерийской школы в Сеговии
В дальнейшем Пруст руководил кафедрами химии в университете Саламанки (1789), а затем Мадрида (1791–1808).
Слайд 18
Закон постоянства состава
Ж.Л.Пруст, 1808 г.:
«Молекулярные химические соединения
независимо от способа их получения имеют постоянный состав и
свойства»