Слайд 2
Приветствие
«Здравствуйте ребята! Рада вас видеть!»
Урок сегодня мы
начинаем не совсем традиционно. Тему вы назовете сами.
Вопрос №1:
вы знаете, что существуют химические элементы?
Вопрос №2: и конечно слышали о классификации элементов?
Вопрос №3: о каком неметалле мы поговорим сегодня?
Подумайте над утверждениями и давайте отгадаем загадку.
Слайд 4
Итак, внимание!!!
Утверждения.
1.Хоть многие вещества превращает в яд,
В химии
она достойна всяческих наград.
2.При нагревании жжет слизистую оболочку
по круче острой горчицы.
Отгадайте загадку.
Этот скромный элемент
Образует вещество,
Твердое, хрупкое
Цвета желтого оно.
Слайд 6
Немало сера знаменита,
И в древности ее Гомер воспел,
С
ней много тысяч лет прожито,
И человек в ней пользу
разглядел
Слайд 7
Рассматриваемые вопросы:
1.Историческая справка.
2.Положение элемента в периодической системе
3.Нахождение серы
в природе, её биологическая роль.
4.Физические свойства, аллотропные видоизменения химического
элемента серы.
5.Химические свойства простого вещества.
6.Применение серы.
7.Круговорот элемента в природе.
8. Экологические аспекты соединений серы.
Слайд 8
Историческая справка
Cера встречается в природе в свободном (самородном)состоянии,
поэтому она была известна человеку уже в глубокой древности.
Сера привлекала внимание характерной окраской, голубым цветом пламени и специфическим запахом, возникающим при горении (запах сернистого газа).
Слайд 9
Историческая справка
В 11 в. алхимики
полагали, что металлы, в том числе золото и серебро,
состоят из находящихся в различных соотношениях серы и ртути.
Поэтому сера играла важную роль в попытках алхимиков найти «философский камень» и превратить недрагоценные металлы в драгоценные.
В 16 в. Парацельс считал серу наряду с ртутью и «солью» одним из основных «начал» природы, «душою» всех тел.
Слайд 10
Историческая справка
Считалось, что горящая сера отгоняет нечистую силу.
В Библии говорится об использовании серы для очищения грешников.
В Древнем Риме с помощью сернистого газа отбеливали ткани.
Издавна использовалась сера в медицине — ее пламенем окуривали больных, ее включали в состав различных мазей для лечения кожных заболеваний.
Применение горящей серы для дезинфекции упоминается Гомером.
Слайд 11
Историческая справка
Практическое значение серы резко возросло после того,
как изобрели черный порох (в состав которого обязательно входит
сера).
Византийцы в 673 году, защищая Константинополь, сожгли флот неприятеля с помощью так называемого греческого огня — смеси селитры, серы, смолы и других веществ — пламя которого не гасилось водой.
В средние века в Европе применялся черный порох, по составу близкий к смеси греческого огня.
Слайд 12
Внимание. Опорный конспект
Ребята! Запишем в тетради.
Опорный конспект по
теме: «Сера»
1.Историческая справка.
Сера известна с древнейших времен.
Слайд 13
Положение элемента в периодической системе
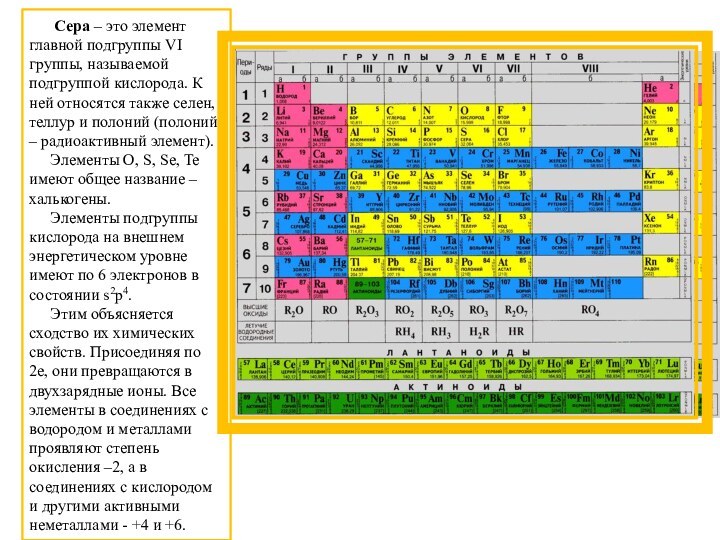
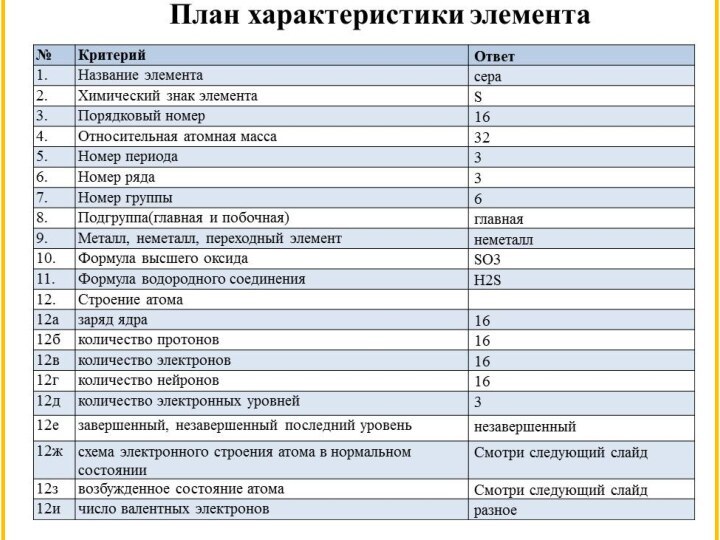
Сера – это элемент
главной подгруппы VI группы, называемой подгруппой кислорода. К ней
относятся также селен, теллур и полоний (полоний – радиоактивный элемент).
Элементы O, S, Se, Te имеют общее название – халькогены.
Элементы подгруппы кислорода на внешнем энергетическом уровне имеют по 6 электронов в состоянии s2p4.
Слайд 14
Положение элемента в периодической системе
Этим объясняется сходство их
химических свойств. Присоединяя по 2е, они превращаются в двухзарядные
ионы. Все элементы в соединениях с водородом и металлами проявляют степень окисления –2, а в соединениях с кислородом и другими активными неметаллами +4 и +6.
Слайд 15
Сера – это элемент главной подгруппы VI
группы, называемой подгруппой кислорода. К ней относятся также селен,
теллур и полоний (полоний – радиоактивный элемент).
Элементы O, S, Se, Te имеют общее название – халькогены.
Элементы подгруппы кислорода на внешнем энергетическом уровне имеют по 6 электронов в состоянии s2p4.
Этим объясняется сходство их химических свойств. Присоединяя по 2е, они превращаются в двухзарядные ионы. Все элементы в соединениях с водородом и металлами проявляют степень окисления –2, а в соединениях с кислородом и другими активными неметаллами - +4 и +6.
Слайд 19
Внимание. Опорный конспект
1.Историческая справка.
Сера известна с древнейших
времен.
2.Положение элемента в периодической системе.
Сера – это
элемент главной подгруппы VI группы
Слайд 20
Нахождение серы в природе.
Сера самородная (S)
Цинковая обманка
(сфалерит ZnS)
Киноварь
(HgS)
Свинцовый блеск
(галенит PbS)
Серный колчедан
(пирит FеS2)
Слайд 21
Нахождение серы в природе
Сера широко распространена в
природе. Она составляет 0,05% массы земной коры. В свободном
состоянии (самородная сера) в больших количествах встречается в Италии (остров Сицилия) и США. В России месторождения самородной серы имеются в Самарской области, в республиках Средней Азии, в Крыму и других районах.
Слайд 22
Нахождение серы в природе
Месторождения этого желтого горючего вещества
разрабатывались греками и римлянами, особенно в Сицилии, которая вплоть
до конца девятнадцатого века славилась в основном серой.
Самородная сера встречается не так уж часто. Чаще она присутствует в виде соединений с другими элементами.
Слайд 23
Нахождение серы в природе
Важнейшими ее природными соединениями являются:
1) сульфиды металлов: FeS2 -железный колчедан (пирит); ZnS –
цинковая обманка; PbS – свинцовый блеск; HgS – киноварь 2) соли серной кислоты (кристаллогидраты): CaSO4•H2O – гипс; Na2SO4•10H2O – глауберова соль; MgSO4 •7H2O – горькая соль.
Слайд 24
Задание
Составь схему нахождения серы в природе.
Слайд 26
Внимание. Опорный конспект
1.Историческая справка.
Сера известна с древнейших
времен.
2. Положение элемента в периодической системе.
Сера –
это элемент главной подгруппы VI группы
3.Нахождение серы в природе.
Самородная сера встречается не так уж часто. Чаще она присутствует в виде соединений с другими элементами.
Слайд 27
Биологическая роль серы
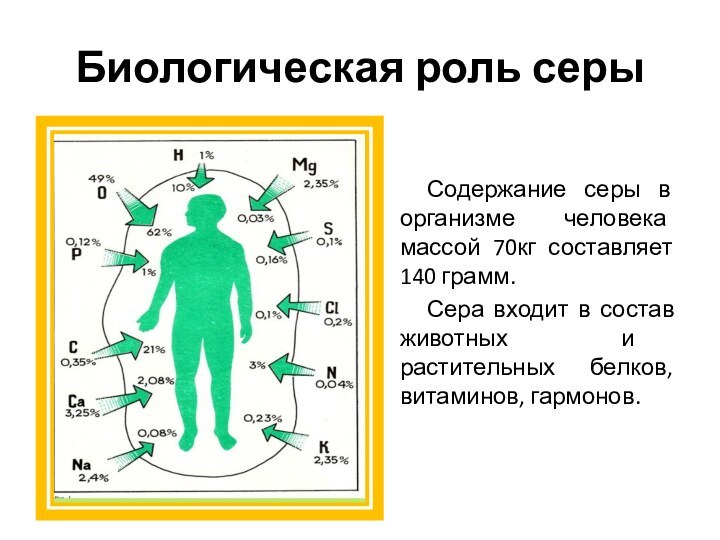
Содержание серы в организме человека массой
70кг составляет 140 грамм.
Сера входит в состав животных и
растительных белков, витаминов, гармонов.
Слайд 28
Биологическая роль серы
Сера содержится в организмах животных и
растений, т.к. входит в состав белковых молекул. Особенно много
серы в белках волос, рогов, шерсти. Кроме этого сера является составной частью биологически активных веществ: витаминов и гормонов. При недостатке серы в организме наблюдается хрупкость и ломкость костей, выпадение волос. Человек содержит примерно 2 г серы на 1 кг своего веса. В организме взрослого человека массой 70 кг - 140 г данного элемента. В сутки человеку необходимо 1 г серы.
Слайд 29
Биологическая роль серы
Ушная сера -это противная субстанция, которая
очень важна для нашего здоровья, а ее липкая консистенция
имеет свое значение. К ней приклеиваются пыль, грязь, бактерии, грибки и другие опасные раздражители, попадая таким образом в ухо, одну из наиболее чувствительных областей нашего организма, к тому же, как можно заметить, достаточно открытую внешним влияниям. Ушная сера содержит особые ферменты. Она бывает разных цветов. У белой и черной расы ушная сера желтоватого цвета, влажная и мягкая. Однако у некоторых азиатских групп (например, у монголов) она сероватая, сухая и ломкая.
Слайд 31
Биологическая роль серы
Серой богаты бобовые растения (горох, чечевица),
овсяные хлопья, яйца.
Тысячелистник обладает повышенной способностью извлекать из почвы
серу и стимулировать поглощение этого элемента с соседними растениями. Чеснок выделяет вещество – альбуцид ( едкое соединение серы). Это вещество предотвращает раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
Органические соединения серы содержатся в нефти.
Слайд 32
Продукты, содержащие серу
горох
чечевица
Овсяные хлопья
яйца
Слайд 33
Внимание. Опорный конспект
Ребята! Запишите.
4.Биологическая роль серы.
Сера содержится
в организмах животных и растений.
Слайд 34
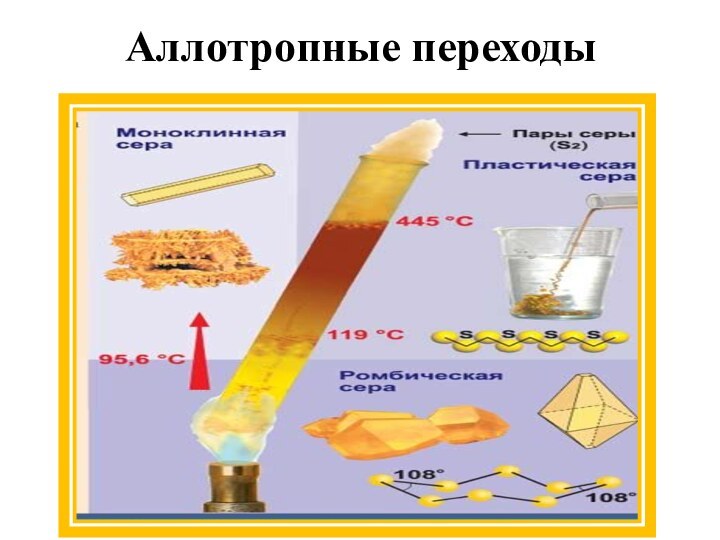
Физические свойства
Сера – твердое кристаллическое вещество желтого
цвета, не растворяется в воде. Растворяется в толуоле, сероуглероде,
анилине. Плохо проводит теплоту и не проводит электрический ток. При t = 112,8 0С плавится. Кипит при t = 444,6 0С
Слайд 36
Техника безопасности
Работа с
твердыми веществами.
1. Все сухие реактивы необходимо брать фарфоровыми ложками,
шпателями.
2.Брать реактивы незащищенными руками запрещается!
3.Необходимо проявлять осторожность при смешивании веществ.
4. Работу с порошкообразными веществами для предотвращения их распыления нужно проводить в таких местах, где нет сквозняков или сильного движения воздуха.
Слайд 37
Эксперимент
Опыт №1.Опишите образец данного неметалла по плану.
Опыт
№2.Растворение серы в воде.
Выполнение опыта: к данному
образцу неметалла прильём воду.
Что наблюдаем? Процесс имеет своё название.
Как он называется?
Слайд 39
Флотация
Одно из особенных физических свойств серы- флотация. Это
способность мелкого порошка серы всплывать. Однако её крупные кристаллы
тонут в воде. Дело в том, что сера не смачивается водой, и её частички держатся на поверхности за счёт прилипших к ним мелких пузырьков воздуха.
Флотация (франц. flottation, англ. flotation,),что означает плаванье на поверхности воды.
Слайд 40
Аллотропные видоизменения химического элемента серы
Аллотропия- это явление,
когда один и тот же химический элемент образует несколько
простых веществ.
Простые вещества, образованные одним и тем же химическим элементом, называют аллотропными видоизменениями этого элемента.
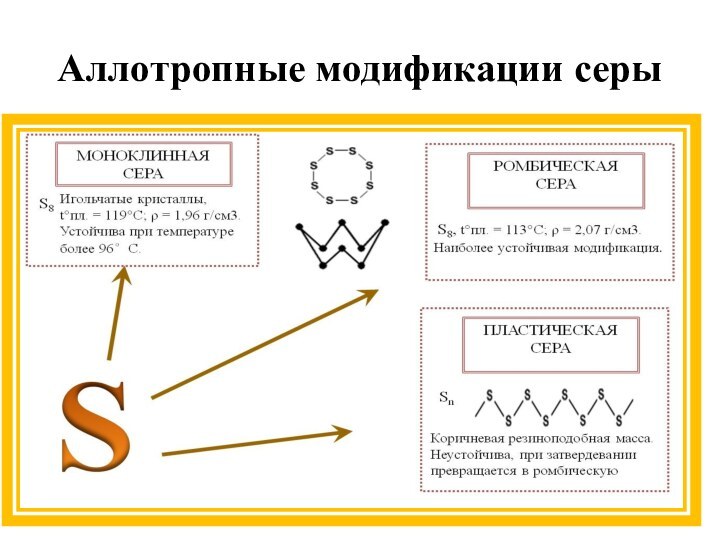
Аллотропные видоизменения химического элемента серы: ромбическая (кристаллическая), моноклинная (игольчатая) и пластическая сера.
Слайд 43
Внимание. Опорный конспект
Ребята! Запишите информацию в конспект.
5.Физические
свойства.
Сера – твердое кристаллическое вещество желтого цвета: не растворяется
в воде. Растворяется в толуоле, сероуглероде, анилине. Плохо проводит теплоту и не проводит электрический ток. При t = 112,8 0С плавится. Кипит при t = 444,6 0С
Аллотропные видоизменения химического элемента серы: ромбическая (кристаллическая), моноклинная (игольчатая) и пластическая сера.
Слайд 45
Физкультминутка
Раз» - поднять руки вверх,
«Два» - нагнуться
до земли,
Не сгибайте, дети, ноги,
Когда касаетесь вы пола.
«Три-четыре» -
прямо стать,
Будем снова начинать писать…
Слайд 46
Химические свойства серы
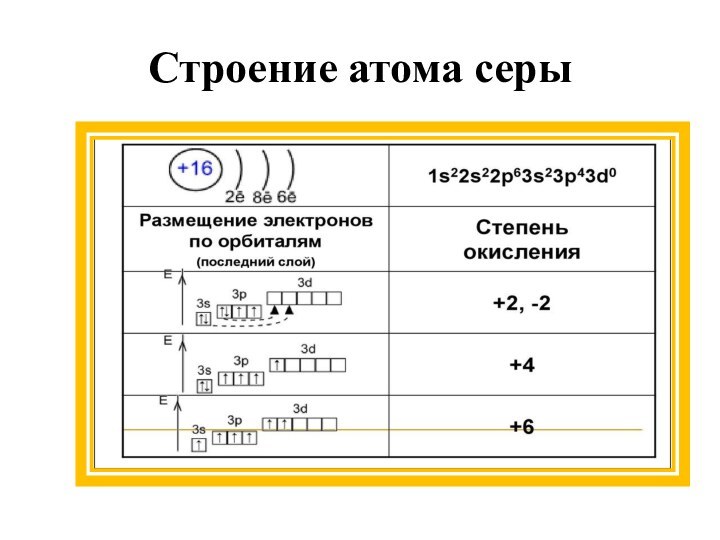
В связи с большим атомным радиусом,
чем у кислорода, окислительные свойства серы выражены гораздо слабее.
Поэтому в реакциях с кислородом сера – восстановитель и проявляет степени окисления +4 и +6.
Окислительные свойства серы проявляются, например, в реакциях с металлами и водородом, а восстановительные – в реакциях с кислородом и галогенами (с йодом сера не соединяется).
1.Сера реагирует почти со всеми металлами.
— 6e →
2Al0 + 3S0→ Al2+3 S3-2
Слайд 47
Взаимодействие серы с натрием
Видеофрагмент:https://www.youtube.com/watch?v=uoA__29o09s
Слайд 48
Химические свойства серы
С некоторыми металлами, например, натрием, калием
взаимодействует даже без нагревания.
— 2e →
2Na0 + S0→Na2+1 S-2
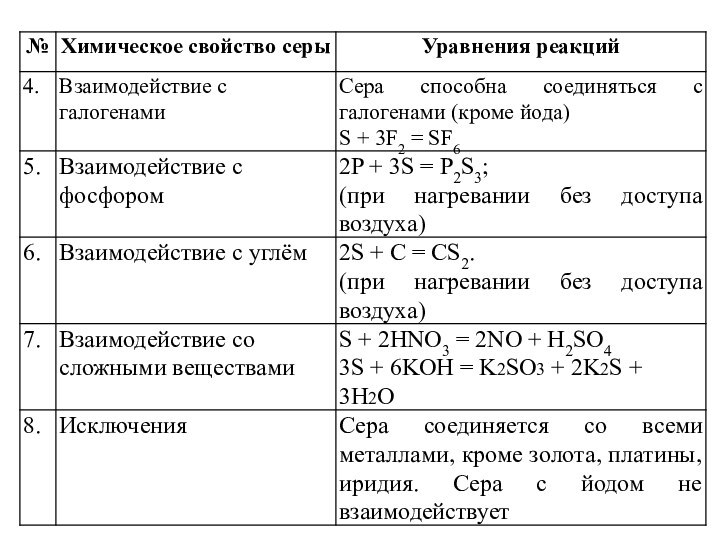
Сера соединяется со всеми металлами, кроме золота, платины, иридия
2. При повышенной температуре реагирует с водородом .
— 2e →
H20 + S0→ H2+1 S-2
Слайд 49
Химические свойства серы
3. При повышенной температуре сера реагирует
с фтором и кислородом.
— 4e →
S0 + O20→ S+4O2-2
При горении серы на воздухе или в кислороде образуется не только оксид серы (IV), но и частично оксид серы (VI).
4. Cера способна соединяться с галогенами (кроме йода), фосфором, углем. С азотом не взаимодействует.
Горение серы
Видеофрагмент:https://www.youtube.com/watch?v=g0HzZFCvPEc
Слайд 51
Химические свойства серы
5.Для серы характерны реакции взаимодействия со
сложными веществами. Она вступает во взаимодействие с азотной кислотой:
S + 2HNO3 = 2NO + H2SO4
6.Сера реагирует с щелочами. В процессе этой реакции образуются соединения серы со степенью окисления -2 и +4:
3S + 6KOH = K2SO3 + 2K2S + 3H2O
Слайд 52
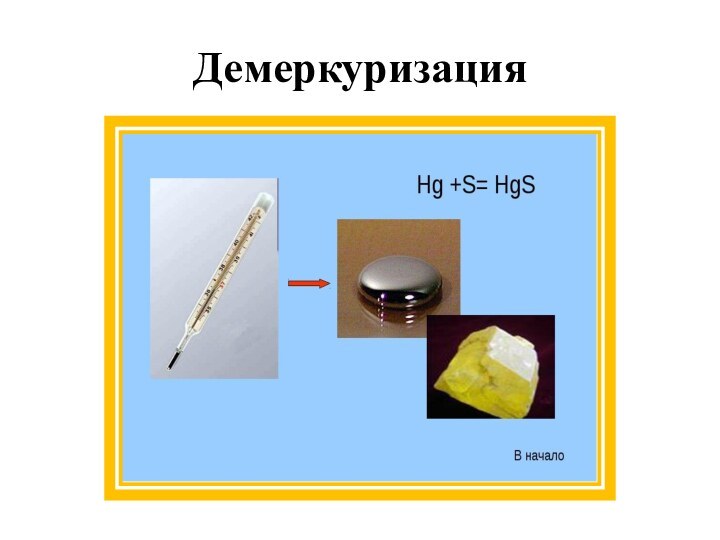
Демеркуризация
Демеркуризация — удаление ртути и её соединений физико-химическими или
механическими способами с целью исключения отравления людей и животных.
Если в лаборатории разлили ртуть, её сначала собирают, а те участки, где ртутные капли нельзя извлечь, засыпают порошкообразной серой. Происходит реакция с образованием сульфида ртути(II).
Слайд 57
Задание
Возьми конверт, найди соответствие между химическим свойством и
уравнением реакции. Внеси свои результаты в таблицу. Запиши уравнения
реакций.
Слайд 60
Внимание. Опорный конспект
Ребята! Зафиксируйте химические свойства.
Слайд 62
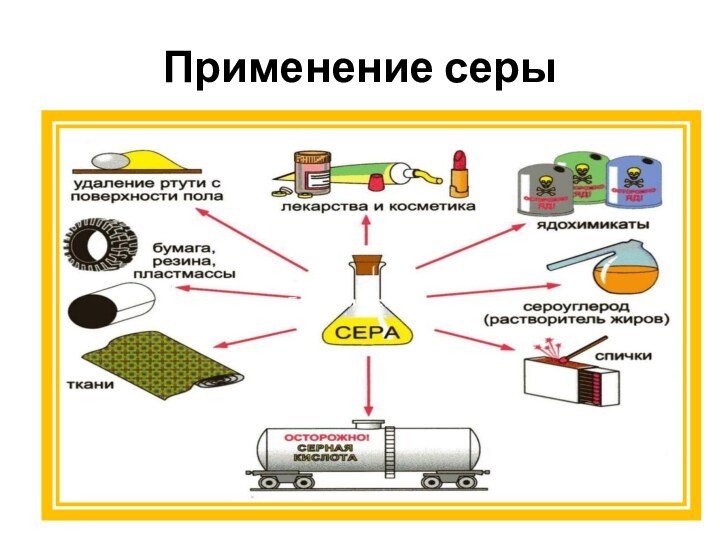
Применение серы
Серу используют для производства серной кислоты, изготовления
спичек, черного пороха, бенгальских огней, для борьбы с вредителями
сельского хозяйства и лечения болезней, в производстве красителей, взрывчатых веществ, люминофоров.
Слайд 65
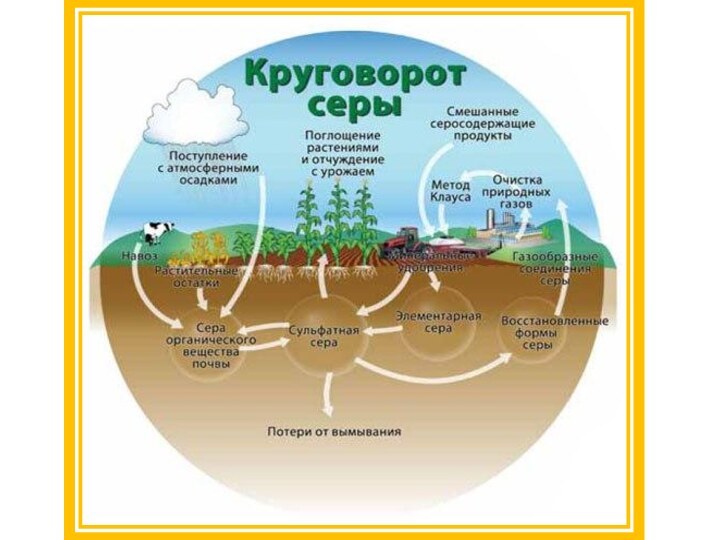
Круговорот серы в природе
Сера представляет собой один из
так называемых циклических элементов, миграция которых происходит в системе
"суша - океан - атмосфера - суша". Глобальный биогеохимический цикл серы представляет собой сложную и разветвленную сеть химических и биохимических процессов, в которых принимают участие соединения серы , находящиеся в различных агрегатных состояниях. В настоящее время круговорот серы нарушается из-за промышленного загрязнения воздуха оксидом серы (IV) и сероводородом.
Слайд 67
Экология и химия
Соединения серы попадают в окружающую среду
как естественным путем, так и в результате антропогенной деятельности.
К числу наиболее опасных соединений серы как загрязнителей природной среды относятся сероводород и диоксид серы
Слайд 69
Опорный конспект
1.Историческая справка.
Сера известна с древнейших времен.
2.
Положение элемента в периодической системе.
Сера – это
элемент главной подгруппы VI группы
3.Нахождение серы в природе.
Самородная сера встречается не так уж часто. Чаще она присутствует в виде соединений с другими элементами.
Слайд 70
Опорный конспект
Биологическая роль серы.
Сера содержится в
организмах животных и растений.
4.Физические свойства.
Сера – твердое кристаллическое вещество
желтого цвета: не растворяется в воде. Растворяется в толуоле, сероуглероде, анилине. Плохо проводит теплоту и не проводит электрический ток. При t = 112,8 0С плавится. Кипит при t = 444,6 0С
Слайд 71
Опорный конспект
Аллотропные видоизменения химического элемента серы.
Аллотропия- это
явление, когда один и тот же химический элемент образует
несколько простых веществ.
Простые вещества, образованные одним и тем же химическим элементом, называют аллотропными видоизменениями этого элемента.
Аллотропные видоизменения химического элемента серы: ромбическая (кристаллическая), моноклинная (игольчатая) и пластическая сера.
Слайд 74
Опорный конспект
6.Применение серы.
1.Производство серной кислоты.
2.Изготовление спичек,
черного пороха, бенгальских огней.
3. Для борьбы с вредителями сельского
хозяйства.
4.В медицине при лечении кожных заболеваний.
5.В производстве красителей, взрывчатых веществ, люминофоров.
Слайд 75
Опорный конспект
7.Круговорот серы в природе.
Сера представляет собой один
из так называемых циклических элементов, миграция которых происходит в
системе "суша - океан - атмосфера - суша".
8.Экология и химия.
Соединения серы попадают в окружающую среду. К числу наиболее опасных соединений серы относятся сероводород и диоксид серы.
Слайд 76
Тестовое задание
1. Сера в периодической системе химических элементов
Д. И.
Менделеева находится в:
а)третьем периоде и 4 группе
б)третьем периоде и 5 группе
в)третьем периоде
и 6 группе
г)втором периоде и 6 группе
2. Строение внешнего электронного слоя атома серы
а)3р3d0
б)3S23p5
в)3S23d4
г)3S23p43d0
Слайд 77
Тестовое задание
3. Сера в соединениях проявляет степень окисления
а) -2;+4;+6
б) -2,;+3;+4
в)
+3;+4;+6
г)+1;-2;+3
4. Сера является
а) металлом б) неметаллом в)переходным элементом
5.В какой форме
сера встречается в природе:
а) сульфатная
б) гидросульфидная
в) сульфитная
г)самородная
Слайд 78
Тестовое задание
6.Аллотропной модификацией серы не является:
а)моноклинная б)изогнутая
в)пластическая
г) ромбическая
7.Составьте формулы сульфидов натрия, магния, алюминия.
8.Закончите
уравнения реакций:
а) S + O2 =
б) S + Na =
в) S + H2 =
Укажите окислитель, восстановитель.
Слайд 79
Тестовое задание
9.С какой целью серу применяют в сельском
хозяйстве:
а) как удобрение;
б) для борьбы с вредителями;
в) для подкормки
скота.
Слайд 80
Ответы:
1. в)
2.г)
3.а)
4. б)
5. а), в), г)
6. б)
7. Na
2 S ;Мg S ; Аl2 S3
8.1)S+O2=SO2
S0-4е=S4+
O20+4e=2O2-
S0 – восстановитель,
O20 _ окислитель
Слайд 81
Ответы:
2)2Na+S=Na2S
Na0-1e=Na1+
S0+2e=S2-
Na0 – восстановитель
S0 - окислитель
3)S+H2=H2S
S0+2е=S2-
H20-2e=2H+1
S0 – окислитель,
H20
- восстановитель
Слайд 82
Домашнее задание
1.Прочитать параграф по теме: «Сера»
2.Выучить опорный конспект.
3.Составить
кроссворд по изученной теме.
4.Написать рассказ о загадочном элементе (по
желанию).
5.Для получения дополнительной информации по этой теме рекомендуется обратиться к интернет- ресурсам.
Слайд 83
Рефлексия деятельности
(поделись впечатлением)
Слайд 84
Рефлексивный тест
1.Мне это пригодится в жизни.
2. На уроке
было над чем подумать.
3. На все возникшие у меня
вопросы я получил(а) ответы.
4. На уроке я поработал(а) добросовестно.
В случае согласия с утверждением ставят напротив него знак «+»