Слайд 2
Тема урока: Обобщение и систематизация знаний по теме
«Неметаллы».
Тип урока: обобщение и систематизация знаний.
Технология урока: традиционное обучение.
Цели
урока:
- образовательные: повторение и систематизация знаний учащихся о строении атомов неметаллов, свойствах неметаллов и их соединений, формировка умений систематизировать и анализировать информацию, полученную на уроках химии;
- развивающие: развитие логического мышления, способности обобщать, речь, коммуникативные способности, самостоятельность, познавательный интерес;
- воспитательные: воспитывать культуру умственного труда, ответственность за результаты своей работы.
Слайд 3
План урока:
1. Организационная часть урока (5 минут).
2. Повторение
и обобщение пройденного материала (30 минут).
3. Подведение итогов (5
минут).
Слайд 4
Добрый день, друзья!
Повернитесь друг к другу, посмотрите в
глаза, улыбнитесь друг другу, пожелайте хорошего рабочего настроения на
уроке. Теперь посмотрите на меня. Я тоже желаю вам работать дружно, открыть что-то новое.
Слайд 5
Давайте разобьёмся на 4 группы
и постараемся вспомнить,
что же такое неметаллы
и какое строение они имеют.
Слайд 6
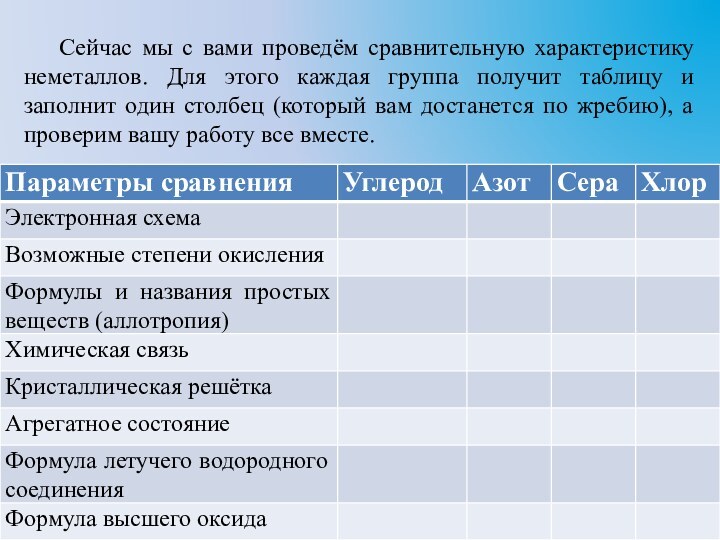
Сейчас мы с вами проведём сравнительную характеристику неметаллов.
Для этого каждая группа получит таблицу и заполнит один
столбец (который вам достанется по жребию), а проверим вашу работу все вместе.
Слайд 7
Мы можем сделать вывод о том, что:
для
атомов неметаллов характерны:
четыре и более электрона на внешнем
уровне,
тенденция к приёму недостающих до 8 электронов,
атомы элементов-неметаллов способны как принимать электроны, проявляя окислительные функции,
так и отдавать их, проявляя восстановительные функции.
Неметаллы имеют 2 типа кристаллических решёток:
- молекулярные ( O2, O3, N2, Cl2),
- атомные
(алмаз, графит).
Для неметаллов –
простых веществ
характерна
ковалентная
неполярная
химическая
связь.
Слайд 8
Сейчас я вам зачитаю определения, относящиеся к загаданному
химическому элементу неметаллу. Если ответ вашей команды готов после
первого определения, то она получает 5 баллов, после второго – 4, после третьего – 3,после четвертого – 2, после пятого – 1, не угадано вещество – 0.
Слайд 9
Задание для группы №1
- Его простое вещество называют
всесъедающим.
- Он обладает высокой химической активностью.
- Его соединения входят
в состав зубных паст.
- Он входит в состав фреона.
-Его находят в тефлоновых покрытиях.
Слайд 10
Задание для группы №2
- Это распространенный неметалл.
- Его
атомы входят в состав белков.
- Простое вещество горит синеватым
пламенем.
- Используют в производстве резины.
-Используют в производстве спичек.
Слайд 11
Задание для группы №3
- Простое газообразное вещество оказывает
сильное раздражающее действие на слизистую оболочку глаз и дыхательную
систему.
- Он входит в состав некоторых гербицидов, инсектицидов и пестицидов.
- Простое вещество получают главным образом в результате электролиза солей.
- Войска Антанты и германские войска применяли это вещество в боевых действиях.
- Соединения этого элемента используют для дезинфекции воды в плавательных бассейнах.
Слайд 12
Задание для группы № 4
- Этот неметалл образует
аллотропные модификации.
- Академик А.Е. Ферсман навал его «элементом жизни
и мысли».
- Входит в состав костей.
- Открыт в 1669 году немецким алхимиком Брандом.
- Одна из аллотропных модификаций светится в темноте.
Слайд 13
Химические свойства неметаллов и их соединений повторяем, играя
в «крестики-нолики».
Уравнения реакций
представители команд
запишут на доске.
Правильное
выполнение задания
оценивается
в 5 баллов.
Слайд 14
Задание для группы №1
Показать выигрышный путь, состоящий из
формул веществ, взаимодействующих с оксидом серы (IV). Составить уравнения
реакций взаимодействия оксида серы (IV) с веществами, формулы которых составляют выигрышный путь.
Слайд 15
Задание для группы №2
Показать выигрышный путь, состоящий из
формул веществ, взаимодействующих с соляной кислотой. Составить уравнения реакций
взаимодействия соляной кислоты с веществами, формулы которых составляют выигрышный путь.
Слайд 16
Задание для группы №3
Показать выигрышный путь, состоящий из
формул веществ, взаимодействующих с аммиаком. Составить уравнения реакций взаимодействия
аммиака с веществами, формулы которых
составляют выигрышный путь.
Слайд 17
Задание для группы №4
Показать выигрышный путь, состоящий из
формул веществ, взаимодействующих с карбонатом калия. Составить уравнения реакций
взаимодействия карбоната калия с веществами, формулы которых составляют выигрышный путь.
Слайд 18
Я вам загадаю загадки, а вы будете командно
отвечать. Право отвечать первым дается тому, кто быстрее поднимет
руку. За каждый правильный ответ – 1 балл.
Слайд 19
Джозеф Пристли как-то раз,
Окись ртути нагревая,
Обнаружил странный газ.
Газ
без цвета, без названья,
Ярче в нем горит свеча,
Угадайте Вы
меня!
Слайд 20
Из меня состоит все живое,
Графит, антрацит и алмаз.
Я
на улице, в школе и в поле,
Я в деревьях
и в каждом из вас.
Слайд 21
Тяжелый, жидкий и пахучий,
Подвижный, сильно ядовит.
Удушлив и весьма
летучий
Сквозь поры пробки он летит.
Лечебным действием заметен
И всем известен
потому.
Слайд 22
Я - газ легчайший и бесцветный,
Неядовитый и безвредный.
Рождаю
воду, когда сгораю,
Аэростаты наполняю,
А с кислородом образую
Я смесь горящую,
взрывную.
Слайд 23
Гулять в грозу - какой резон?
Подышим воздухом, дружище.
В
природе словно стало чище,
Повсюду в воздухе ...
Слайд 24
Я светоносный элемент.
Я спичку вам зажгу в момент.
Сожгут
меня, и под водой
Оксид мой станет кислотой.
Слайд 25
Предупреждаю вас заранее:
Я не пригоден для дыхания!
Но все
как будто бы не слышат
И постоянно мною дышат.
Слайд 26
На этом этапе вам нужно написать уравнения реакций,
с помощью которых можно осуществить превращения.
Задание для группы №1
P→Ca3P2→X→P2O5→H3PO4→Ag3PO4
Задание
для группы №2
C→CH4→CO2→X→Ca(HCO3)2→CO2
Задание для группы №3
S→H2S→SO2→X→H2SO4→Y
Задание для группы №4
NH4Cl→NH3→X→NO2→HNO3→Y
Сейчас представитель каждой команды
запишет на доске уравнения и мы все проверим
(за каждое уравнение – 1 балл).
Слайд 27
Знаете ли вы, что:
1) …алхимикам удалось получить серную кислоту
еще в Х в. при прокаливании некоторых сульфатов (купоросов).
Отсюда и произошло историческое название купоросное масло.
2) …самое обыкновенное средство
тушения пожаров
– вода – горит в струе фтора
светло-фиолетовым пламенем.
3) …алхимики называли серу
«желчью бога Вулкана».
Слайд 28
Чтобы закрепить материал
я предлагаю вам игру «Реши
задачу».
Сейчас я выдам вам карточки с условием задачи. Каждая
группа решает по отдельности. Решения вы записываете в свою рабочую тетрадь.
Через 5 минут я соберу работы.
Какой объем водорода (н.у.) выделится при взаимодействии алюминия с 49г 20% раствора серной кислоты?