- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Как устроен мир
Содержание
- 2. Немного историиПонятие об атомах зародилось еще в
- 3. Разные точки зренияПервое изложение этой теории относится
- 4. Если же деление нельзя продолжать бесконечно, рано
- 5. Британский химик Роберт Бойль (1627 – 1691)
- 6. Модели атомов«пудинг с изюмом» - предложил на
- 7. В 1932 году английский физик Джеймс Чедвик
- 8. Соединение атомовКовалентные соединения: при образовании ковалентных соединений
- 9. Такая разная материяТвердые тела, жидкости и газы
- 10. Газообразное состояние веществаГазы не имеют собственной формы
- 11. Конденсированное состояние веществаК конденсированным системам относятся жидкости
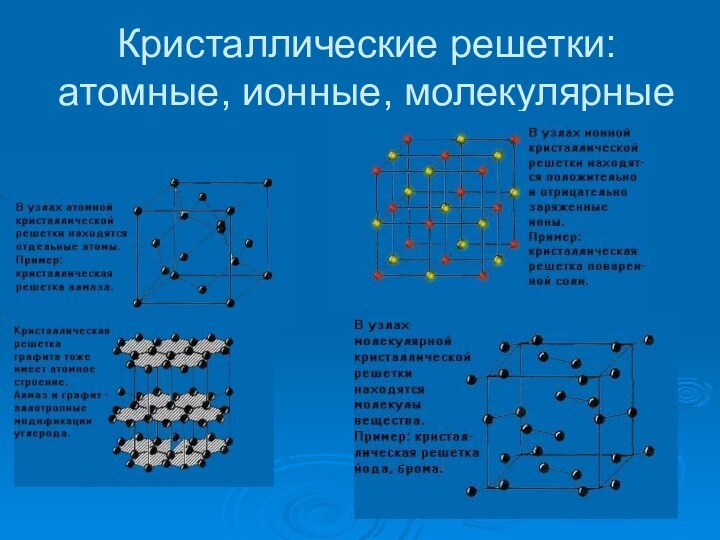
- 12. Кристаллические решетки: атомные, ионные, молекулярные
- 13. Скачать презентацию
- 14. Похожие презентации












Слайд 3
Разные точки зрения
Первое изложение этой теории относится примерно
к 400 г. До н.э. и принадлежит двум греческим
философам Левкиппу и Демокриту.Их занимал вопрос о её делимости на всё более мелкие частицы - конечен ли этот процесс или бесконечен. Если деление можно продолжать как угодно долго, значит, материя непрерывна, и ее структура принципиально не меняется при любом «увеличении».
Слайд 4 Если же деление нельзя продолжать бесконечно, рано поздно
мы дойдём до мельчайшей частички, которую Демокрит назвал атомом,
что в переводе и означает «неделимый».Четыре первоначала Аристотеля.
Аристотель
Некоторые философы, включая и самого знаменитого – Аристотеля (384 – 322 гг. до н.э.), оспаривали идею о неделимых частицах. Их точка зрения заключалась в том, что все состоит из четырех элементов: земли, огня, воздуха и воды, которые и определяют такие свойства веществ, как сухость, тепло, холод и влажность.
Слайд 5 Британский химик Роберт Бойль (1627 – 1691) выдвинул
предположение, что материя состоит их неких первичных частиц, которые,
соединяясь вместе, образуют и более крупные частицы – корпускулы.Британский химик Джон Дальтон (1766 – 1844) впервые ввел термин «атом», излагая свою атомистическую теорию в 1807 году. Его теория означала новую ступень в науке. Вот ее основные положения:
Вся материя состоит из мельчайших частиц, называемых атомами.
Атомы не создаются вновь, не разрушаются и не делятся.
Атомы одного и того же элемента совершенно одинаковы.
Химические реакции – это результат перегруппировки атомов.
Атомы способны соединяться, образуя более крупные частицы сложных веществ.
Впоследствии Дальтон предположил, что атом в принципе может быть разделен на еще более мелкие частицы.
Слайд 6
Модели атомов
«пудинг с изюмом» - предложил на грани
ХIХ и ХХ веков английский ученый Дж. Дж. Томсон
(1856 – 1940). В этой модели отрицательно заряженные зерна были погружены в некую твердую субстанцию.Эрнест Резерфорд (1871 – 1937) предложил модель, в которой отрицательно заряженные частицы – электроны –вращаются вокруг положительно заряженного ядра. Эту модель усовершенствовал датский физик Нильс Бор (1885 – 1962), предложивший, что электроны движутся по вполне определенным орбитам.
Слайд 7
В 1932 году английский физик Джеймс Чедвик (1891
– 1974) создал новую модель. Хоть она и походила
на предыдущие, но была более точной в отношении ядра атома, которое теперь предполагалось состоящим из частиц, называемых протонами и нейтронами.Современные ученые пользуются моделью электронных облаков. Каждое такое облако – часть пространства, где нахождение электрона наиболее вероятно.
Слайд 8
Соединение атомов
Ковалентные соединения: при образовании ковалентных соединений атомы
различных элементов делятся друг с другом своими электронами. Обычно
так бывает с различными неметаллами. Обобществление электронов связывает атомы вместе: образуется новая молекула. Пример ковалентного соединения – вода.Ионные соединения: получаются когда атом металла отдает электроны атому неметалла. Атом металла становится катионом, а атом неметалла – анионом. Оба они удерживаются вместе взаимным притяжением своих противоположных зарядов. Хлорид натрия (поваренная соль) – пример ионного соединения.
Слайд 9
Такая разная материя
Твердые тела, жидкости и газы –
это различные агрегатные состояния вещества. Вещество не обязано всегда
находиться в одном и том же состоянии. Состояние молекул, образующих вещество может измениться под действием температуры.
Слайд 10
Газообразное состояние вещества
Газы не имеют собственной формы и
объёма и, как правило, смешиваются друг с другом в
любых соотношениях (если, конечно, между ними не идёт химическая реакция). Эти свойства газов обусловлены тем, что молекулы в них находятся далеко друг от друга. «газ» - «хаос» (греч.)
Слайд 11
Конденсированное состояние вещества
К конденсированным системам относятся жидкости и
твердые тела. В жидкостях и твердых телах молекулы расположены
ближе друг к другу, поэтому их плотность больше плотности газов.Основное отличие твердого состояния от жидкого состоит в том, что в твердом веществе его атомы, молекулы или ионы находятся постоянно в узлах кристаллической решетки и лишь испытывают тепловые колебания, а в жидкости они беспорядочно движутся, скользят относительно друг друга, чем обусловлено основное свойство жидкости – текучесть, т.е. способность принимать форму того сосуда, в котором она находится.