Слайд 2
Особенности химии
Физика вырабатывает фундаментальные концепции и модели
естествознания.
Особенность химии состоит в том, что экспериментальное моделирование
явлений играет здесь доминирующее значений в развитии знаний. Химия – экспериментальная наука.
В химии успешно используется индуктивный подход, согласно которому на основе имеющихся фактов выявляются более или менее общие закономерности, а затем создаются общие модели.
Слайд 3
Структура химии
В настоящее время химия состоит из следующих
разделов:
неорганическая химия,
органическая химия,
физическая химия,
аналитическая химия;
химия
высоко молекулярных соединений.
Слайд 4
Задачи химии
Все разделы химии осуществляют решение двух крупных
задач:
Получение веществ с заданными свойствами;
Исследование генезиса (происхождения) веществ.
Решение этих
задач предполагает проведение исследований:
элементного молекулярного состава веществ,
структуры молекул вещества,
термодинамических и кинетических условий химического процесса,
процессов самоорганизации и эволюции химических соединений.
Слайд 5
История химии
Химия – очень древняя наука. До нашей
эры химия развивалась, в основном, в древнем Египте и
арабских странах.
Накопленные знания не выходили, однако, за пределы феноменологического уровня:
были описаны свойства веществ;
устанавливались некоторые закономерности их взаимодействия
сущность явлений подменялась мистической интерпретацией.
В Западной Европе
развитие химии было тесно связано с развитием техники,
химия продолжала быть связана с религиозно-философскими представлениями, т.е. оставалась «алхимией».
Слайд 6
История химии
Становление химии проходило на основе двух
законов:
Закон сохранения массы: полная масса замкнутой системы остается постоянной,
т.е. в результате химической реакции не происходит измеримого увеличения или уменьшения массы (закон Ломоносова-Лавуазье «если в одном месте что-нибудь прибудет, то в другом месте непременно столько же убудет»);
Закон постоянства состава: всякое химическое соединение, независимо от способа получения, всегда содержит определенные элементы в одинаковом весовом соотношении (французский химик Ж.Пруст).
Слайд 7
История химии
Универсальным законом химии считается периодический закон химических
элементов Д.И.Менделеева: свойства химических элементов не являются случайными, а
зависят от электронного строения атома; они закономерно изменяются в зависимости от атомного номера в таблице элементов.
Слайд 8
Периодический закон Менделеева
В основу систематизации свойств химических
элементов Менделеевым была положена концептуальная идея зависимости свойств элементов
от атомной массы.
Признаком химического элемента является не экспериментально установленная неразложимость данного вещества (как считалось раньше), а место в периодической системе, определяемое атомной массой.
Слайд 9
Химический элемент
Проблема химического элемента вышла за рамки
классического представления о веществе. Место элемента в периодической системе
получило новый смысл, связанный со структурой атома.
Химический элемент – это вид атомов с одинаковым зарядом ядра, т.е. совокупность изотопов.
Химические свойства атомов определяются характером заполнения электронных орбит.
Слайд 11
Химический элемент
Во времена Менделеева было известно 62
элемента.
В 1930 годы Система элементов заканчивалась ураном (Z=92).
С начала 40-х годов Система пополнялась путем физического синтеза. Элементы №93-96 (нептуний, плутоний, амерций, кюрий) открыли в 1940-1949 гг., элементы №97-101(берклий, калифорний, эйнштейний, фермий, менделеевий) стали известны в 1949-1952 гг.
Элементы, начиная со 102 неустойчивы, а начиная со 110 – настолько короткоживущие, что могут распасться в момент образования.
Есть предположения, что устойчивыми могут быть элементы с номерами 124, 164, 184, их еще предстоит открыть.
Слайд 12
Химическое соединение
Химические элементы образуют химические соединения в
соответствии с законом постоянства состава.
С точки зрения атомного
строения вещества, атом легче вступает в химические реакции, если он имеет незаполненные электронные оболочки.
Атом отдает или приобретает электроны на свою внешнюю электронную оболочку в зависимости от валентности – способности атома к образованию химической связи.
Слайд 13
Химическая связь
Под химической связью понимается определенное взаимодействие атомов,
которое приводит к заданной конфигурации атомов, отличающей одни молекулы
от других.
Вещество, которое состоит из атомов в определенном соотношении, объединенных определенной химической связью, является химическим веществом.
Ионная, ковалентная, металлическая химическая связь.
Слайд 14
Ионная связь
Атомы могут терять или приобретать электроны, превращаясь
в ионы (анионы и катионы). Анионы и катионы с
полностью заполненной электронной оболочкой имеют устойчивую электронную конфигурацию.
Между анионами и катионами возникает электростатическое притяжение. Химическая связь такого рода называется ионной связью.
Наиболее типичные ионные соединения состоят из катионов металлов I и II групп и анионов неметаллических элементов VI и VII групп (например, NaCl).
Слайд 15
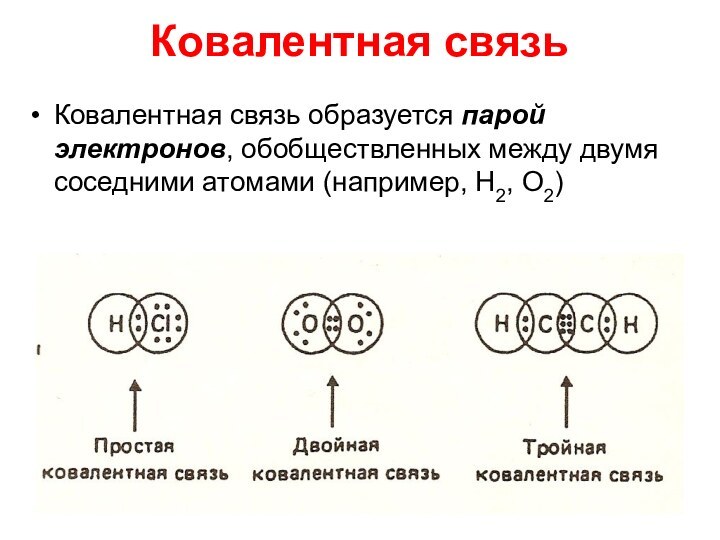
Ковалентная связь
Ковалентная связь образуется парой электронов, обобществленных между
двумя соседними атомами (например, Н2, О2)
Слайд 16
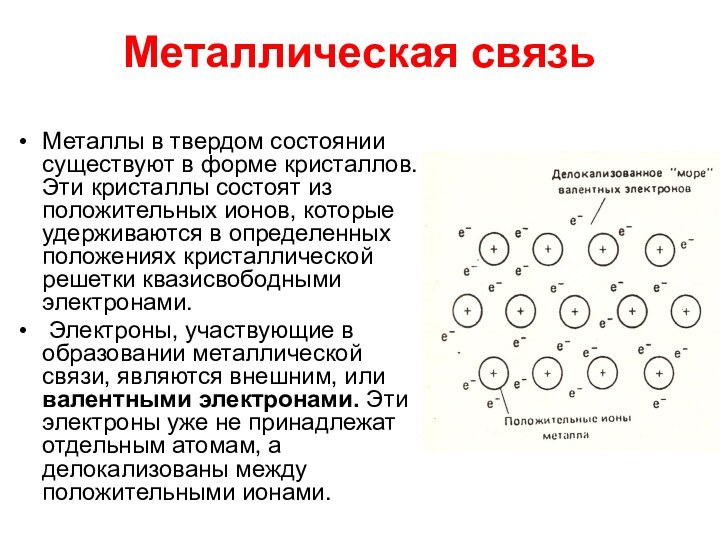
Металлическая связь
Металлы в твердом состоянии существуют
в форме кристаллов. Эти кристаллы состоят из положительных ионов, которые удерживаются в определенных положениях кристаллической решетки квазисвободными электронами.
Электроны, участвующие в образовании металлической связи, являются внешним, или валентными электронами. Эти электроны уже не принадлежат отдельным атомам, а делокализованы между положительными ионами.
Слайд 17
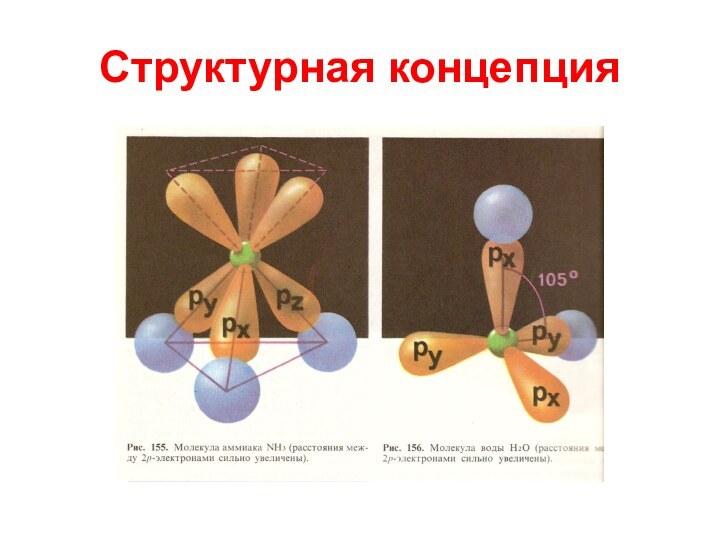
Структурная концепция
В соответствии со структурной концепцией молекулы
представляют собой не произвольную, а пространственно упорядоченную совокупность атомов,
входящих в нее.
Химические связи в молекуле имеют пространственное распределение, а форма молекул определяется углами между направлениями связей, соединяющих атомы в данную молекулу (линейные молекулы, уголковые молекулы).
Комбинируя атомы различных элементов, можно создавать структурные формы любого химического соединения, т.е. находить путь химического синтеза.
Слайд 19
Химическая активность
Созданная А.М.Бутлеровым теория химического строения объяснила причины
химической активности одних веществ и пассивности других. Позже теория
Бутлерова нашла обоснование на основе квантовой механики.
Реакционная способность - характеристика химической активности веществ, учитывающая как разнообразие реакций, возможных для данного вещества, так и их скорость.
Инертные газы химически инертны имеют низкую реакционную способность, а щелочные и галогены - высокую.
Реакционная способность зависит и от условий реакции (природы среды, присутствия катализаторов, давления, температуры, облучения и т.п.).
Слайд 20
Химическая активность
Химическую активность можно рассматривать с точки зрения
превращения энергии: если при образовании химической связи сумма энергий
связываемых компонент (атомов) больше, чем энергия образующейся молекулы, то такая связь оказывается устойчивой.
Наличие в молекуле двойных и тройных связей, приводит к дальнейшему увеличению реакционной способности.
Образование такой химической связи происходит с выделением энергии, такие реакции называются экзотермическими.
Слайд 21
Энергией химической связи
Энергия двойных и тройных связей больше
энергии одинарных связей.
Углерод и азот наиболее широко распространены
в окружающем мире – их связи самые прочные.
Чтобы разорвать химическую связь, необходимо затратить энергию, называемую энергией химической связи. Одним из способов сообщения достаточной энергии является поддержание необходимой температуры.
Слайд 22
Химические системы
Химические системы могут быть равновесными и неравновесными.
В равновесных системах идут обратимые химические процессы, а в
неравновесных – необратимые процессы, как правило, цепные и разветвленные. Именно в них возникают флуктуации и неустойчивости, а их развитие починяется законам нелинейной динамики.
Область химии, объясняющая типы реакций, их ход и возможность изменения направлений процессов, называется химической кинетикой.
Слайд 23
Химические системы
Принцип смещения равновесия установлен А. Ле Шателье
(1884) и термодинамически обоснован К. Брауном (1887).
Внешнее воздействие,
выводящее систему из состояния термодинамического равновесия, вызывает в системе процессы, стремящиеся ослабить эффект воздействия.
При нагревании равновесной системы в ней происходят изменения (например, химические реакции), идущие с поглощением теплоты, а при охлаждении — изменения, протекающие с выделением теплоты.
Слайд 24
Химические системы
Самопроизвольные химические реакции идут в сторону образования
более устойчивых химических соединений и сопровождаются выделением энергии.
Скорость реакции
зависит от температуры, при этом каждая молекула проходит стадию активации.
Катализаторы уменьшают энергию активации, что увеличивает скорость химической реакции.
Если скорости прямой и обратной реакции равны, то система находится в динамическом равновесии.
Слайд 25
Химические системы
Примером самопроизвольных периодических химических реакций является реакция
окисления лимонной кислоты в присутствии катализатора, впервые открытая Б.Белоусовым
в 1951 г.
Происходит чередование окислительно-восстановительных процессов, и раствор самопроизвольно периодически меняет цвет.
Подобные реакции в дальнейшем широко исследовались для различных веществ и получили название реакций Белоусова-Жаботинского.
Слайд 26
Реакции Белоусова -Жабатинского
Слайд 27
Химические системы
В современной химии важнейшее значение имеет
проблема поиска эффективных катализаторов для различных химических технологий.
В
биохимии установлено, что основой химии живого являются каталитические реакции, т.н. биокатализ. Интенсивные исследования последнего времени направлены на выяснение механизмов химических превращений, присущих живой материи.
Химиков-органиков интересуют перспективы синтеза сложных веществ, аналогичных образующимся в живом организме. Изучив принципы, заложенные эволюцией в химизм живой природы, можно использовать их для развития химической науки и технологии.
Слайд 28
Химическая эволюция
Проблемы моделирования биокатализаторов показали необходимость детального
изучения химической эволюции, т.е. установления закономерностей самопроизвольного синтеза новых
химических соединений, являющихся более высокоорганизованными по сравнению с исходными веществами.
В 1960-х годах было обнаружено самосовершенствование катализаторов в ходе реакции (обычно катализаторы в ходе реакции дезактивировались), что позволило говорить о самоорганизация химического процесса – такое состояние химической системы, которому присущи все более высокие уровни сложности и упорядоченности.
Слайд 29
Химическая эволюция
Одна задач из эволюционной химии – понять,
как из неорганической материи возникает жизнь. Поэтому эволюционную химию
можно назвать «предбиологией».
Есть два подхода к изучению предбиологических систем:
Синергетический, который в химии получил название функционального;
Субстратный, связанный с вещественной основой процессов химической самоорганизации.
Слайд 30
Химическая эволюция
Субстратный подход - накопление информации о роли
отдельных химических элементов и структур в ходе химической эволюции.
В настоящее время известно более ста химических элементов, но основу живых систем составляют только шесть из них, т.н. органогенов (углерод, водород, кислород, азот, фосфор и сера). Их общая весовая доля в живой материи составляет 97.4%.
Еще двенадцать элементов (Na, К, Ca, Mg, Fe, Si, Al, Cl, Cu, Zn, Co, Mn) составляют в живом примерно 1.6%, остальные слабо представлены в живой материи.
Слайд 31
Химическая эволюция
На Земле наиболее распространены кислород, кремний, алюминий,
железо, а углерод занимает только 16-е место. Совместная весовая
доля четырех органогенов (C, N, P, S) в поверхностных слоях Земли составляет 0.24%. Следовательно, геохимические условия не сыграли сколько-нибудь существенной роли при формировании органических систем.
С химической точки зрения отбор элементов происходил по следующим признакам:
Способность образовывать достаточно прочные энергоемкие связи;
Образованные связи должны быть достаточно лабильными, т.е. изменчивыми.
Слайд 32
Химическая эволюция
Углерод был отобран эволюцией как органон №1.
Он участвует почти во всех типах химических связей, известных
в химии, образует углерод-углеродные связи, строя длинные и стабильные скелеты молекул в виде цепей, колец и даже сложных трехмерных образований (т.н. фуллеренов).
Материалы, построенные на основе углерода, легли в основу развития нанаотехнологий.
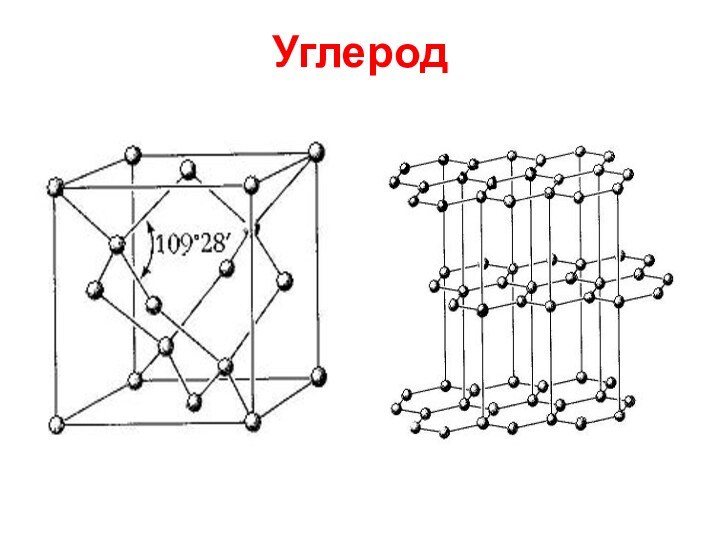
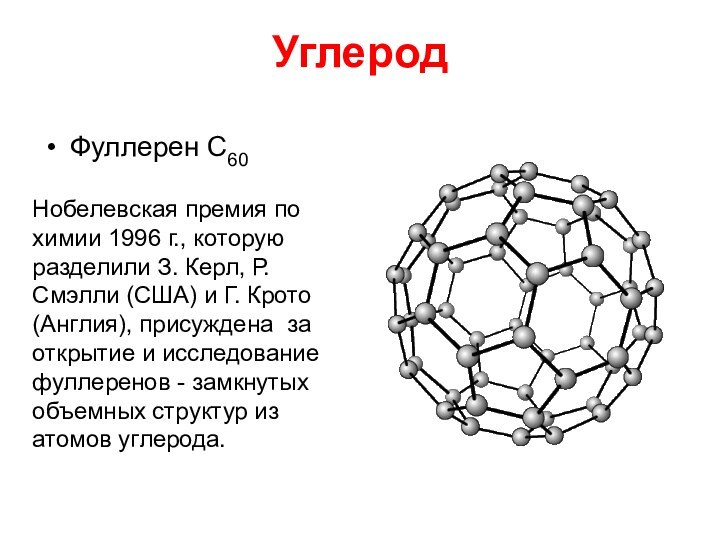
Слайд 35
Углерод
Фуллерен С60
Нобелевская премия по химии 1996 г., которую
разделили З. Керл, Р. Смэлли (США) и Г. Крото
(Англия), присуждена за открытие и исследование фуллеренов - замкнутых объемных структур из атомов углерода.
Слайд 37
Химическая эволюция
Углеродные атомы создают связи с атомами H,
N, O, P, S в различных комбинациях, что обеспечивает
колоссальное разнообразие органических соединений, проявляющееся в размерах, структуре и химических свойствах молекул.
Подобно тому, как только шесть органогенов отобраны природой в основу биосистем, также в предбиологи-ческой эволюции из миллионов органических соединений в построении живого участвуют лишь несколько сотен (из ста известных аминокислот в состав белков входят только двадцать).
Слайд 38
Химическая эволюция
В природе происходит отбор тех соединений, которые
получаются относительно большим числом химических путей и обладают широким
каталитическим спектром.
Согласно теории развития элементарных открытых каталитических систем (1964 г., профессор МГУ А.П.Руденко), химическая эволюция представляет собой саморазвитие каталитических систем, и следовательно, эволюционирующим веществом являются катализаторы. Одно из важнейших следствий этой теории – установление пределов химической эволюции и перехода хемогенеза в биогенез (т.е. зарождение живого).