- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Биологическая химия
Содержание
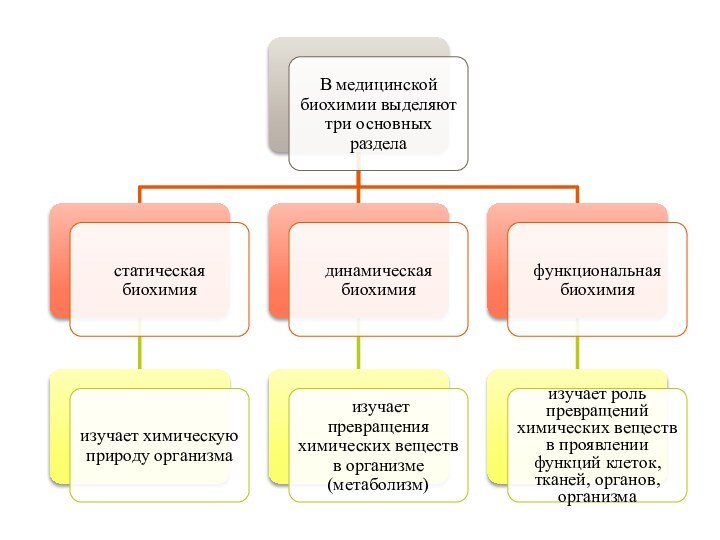
- 2. Термин "биохимия" эпизодически употреблялся с середины XIX
- 3. Биохимия (биологическая, или физиологическая химия) – наука
- 9. Структура основных биополимеров и их метаболизм в организме человека
- 10. Строение и функции белковБелки – важнейшая составная
- 11. Биологические функции белков.1. Ферментативная – в клетке
- 12. 2. Гормональная – в организме человека 50% всех гормонов имеют белковую природу.
- 13. 3. Рецепторная – избирательное связывание различных регуляторных
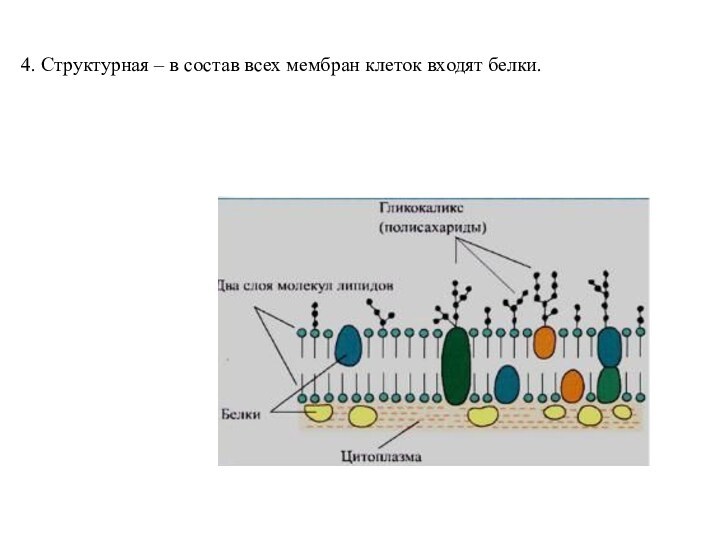
- 14. 4. Структурная – в состав всех мембран клеток входят белки.
- 15. 5. Регуляторная – гормоны белковой природы.
- 16. 6.Защитная – иммунитет организма человека связан с наличием специальных белков - γ-глобулинов (антител).
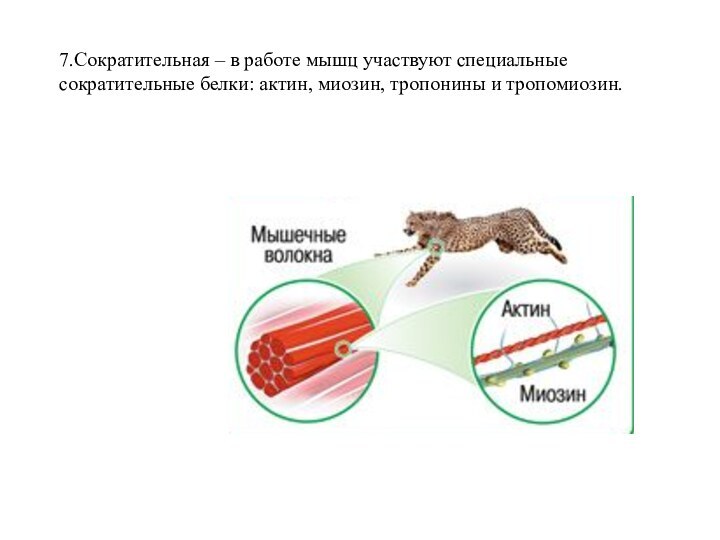
- 17. 7.Сократительная – в работе мышц участвуют специальные сократительные белки: актин, миозин, тропонины и тропомиозин.
- 18. 8.Трофическая или резервная белки: использование белков как запасного материала для питания развивающихся клеток, например, глютелины.
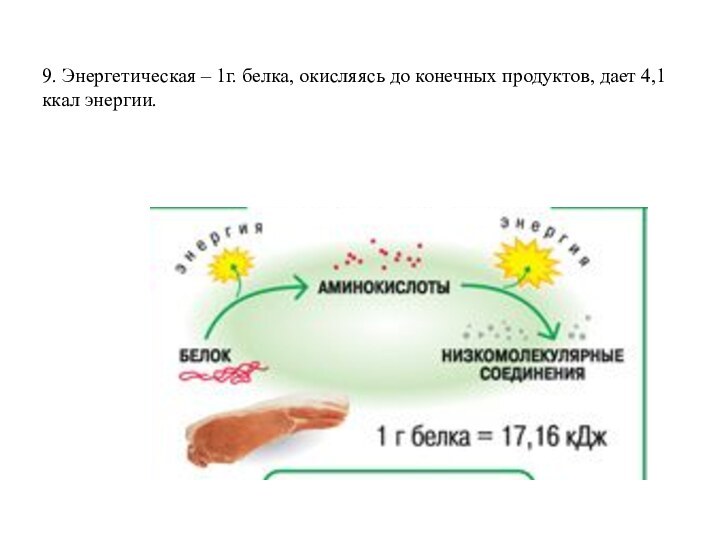
- 19. 9. Энергетическая – 1г. белка, окисляясь до конечных продуктов, дает 4,1 ккал энергии.
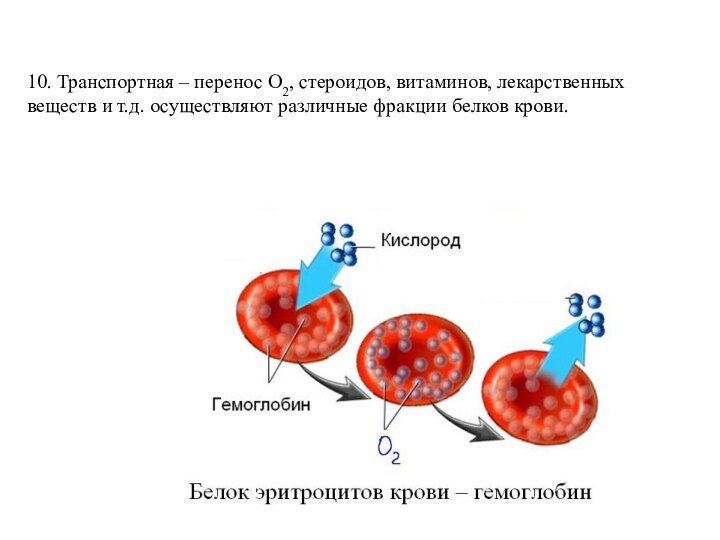
- 20. 10. Транспортная – перенос О2, стероидов, витаминов, лекарственных веществ и т.д. осуществляют различные фракции белков крови.
- 21. 11. Опорная или механическая – прочность соединительной,
- 22. 12. Гемостатическая – свертывание крови связано с наличием в крови белков свертывания крови.
- 23. Аминокислоты – структурные мономеры белков. Классификация и физико-химические свойства аминокислот. Аминокислоты, пептиды и белки как фармакопрепараты.
- 24. Мономерами белков служат α-аминокислоты L-ряда, общим признаком
- 26. Существует 3 классификации аминокислот:I. Структурная, т.е. по
- 27. II. Электрохимическая, т.е. по основным свойствам аминокислот.
- 28. Кислые аминокислоты (глутаминовая кислота, аспарагиновая кислота) имеют
- 29. III. Биологическая или физиологическая, т.е. по степени
- 30. 1. Отдельные аминокислоты-глутаминовая кислота, используется при заболеваниях
- 31. Первичная структура белков. Видовая специфичность белков. Наследственные
- 32. Аминокислотные остатки в пептидной цепи расположены в
- 33. Для пептидной связи характерны следующие свойства:копланарность –
- 34. 4. способность к образованию водородных связей, причем
- 35. Линейная последовательность аминокислотных остатков в полипептидной цепи,
- 36. Правила написания пептидов: название начинается всегда с
- 37. При генетических нарушениях в организме возможен синтез
- 38. Вторичная структура белка, ее основные типы: α-спираль
- 39. В α – спирали NН2-группа аминокислотного остатка
- 40. В β – структуре полипептидные цепи располагаются
- 41. Повторяющиеся, более сложные комбинации, образованные из трех
- 42. Третичная структура белков – трехмерная пространственная структура,
- 43. К ковалентным связям относятся:дисульфидные связи – образуются
- 44. В стабилизации третичной структуры принимают участие неполярные (слабые) ван-дер-ваальсовые связи, которые образуются между гидрофобными радикалами аминокислот.
- 45. В некоторых случаях, при большом содержании аминокислотных
- 46. Четвертичная структура белка.
- 47. Многие белки построены из двух или более
- 48. Основные группы сложных белков.Сложные белки состоят из
- 49. Фосфопротеины, кроме белковой части (апопротеина), содержат остатки
- 50. Гликопротеины – сложные белки, состоящие из белковой
- 51. Липопротеины – сложные белки, состоящие из белковой
- 52. Кофакторпротеины состоят из белка и небелковой части
- 53. Нуклеиновые кислотыОбщая характеристика нуклеиновых кислот. Компоненты НК,
- 54. Нуклеотид = нуклеозид + 1–3 остатка H3PO4.Нуклеиновые
- 58. Номенклатура:
- 60. Биологическая роль нуклеотидов:1) являются универсальными источниками энергии
- 61. Функции ДНК: хранение, воспроизводство и передача по
- 62. Вторичная структура ДНК (1953 г., Д. Уотсон,
- 63. ФерментыФерменты (энзимы) – вещества белковой природы, обеспечивающие
- 64. Энергия активации (свободная энергия активации) – дополнительное
- 65. Ферменты и небиологические катализаторы имеют следующие сходные
- 66. Отличия ферментов от небиологических катализаторов:1. Скорость ферментативного
- 67. Классификация и номенклатура ферментов.Все ферменты разделены на
- 68. Скачать презентацию
- 69. Похожие презентации



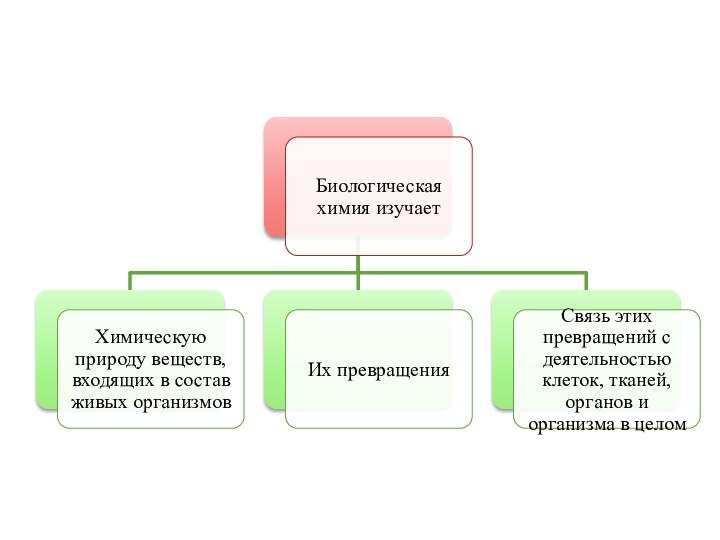



























Слайд 3 Биохимия (биологическая, или физиологическая химия) – наука о
химическом составе живых клеток и организмов и о химических
процессах, лежащих в основе их жизнедеятельности.Биохимия изучает химическую природу веществ, входящих в состав живых организмов, их превращения, а также связь этих превращений с деятельностью клеток, органов и тканей и организма в целом.
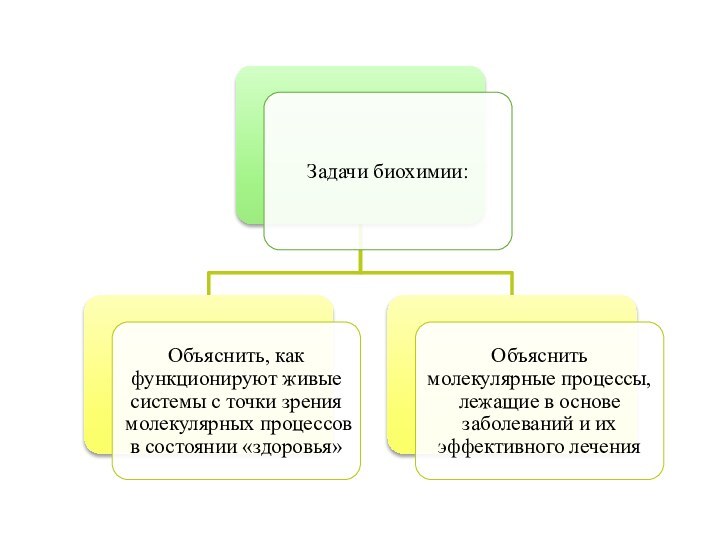
Главной задачей биохимии является установление связи между молекулярной структурой и биологической функцией химических компонентов живых организмов.
Слайд 10
Строение и функции белков
Белки – важнейшая составная часть
живой материи.
Белки – основной структурный элемент тканей. Белки
имеют большой молекулярный вес, содержат азот в своём составе, состоят из аминокислот, соединённых в цепи с помощью пептидных связей.
Слайд 11
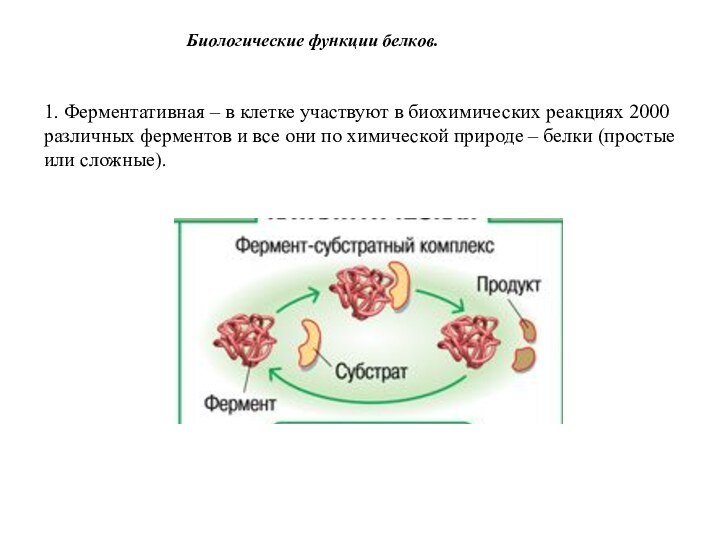
Биологические функции белков.
1. Ферментативная – в клетке участвуют
в биохимических реакциях 2000 различных ферментов и все они
по химической природе – белки (простые или сложные).Слайд 13 3. Рецепторная – избирательное связывание различных регуляторных веществ
– гормонов, биогенных аминов, медиаторов, протекает с помощью белков-
рецепторов на мембранах клеток.Слайд 16 6.Защитная – иммунитет организма человека связан с наличием
специальных белков - γ-глобулинов (антител).
Слайд 17 7.Сократительная – в работе мышц участвуют специальные сократительные
белки: актин, миозин, тропонины и тропомиозин.
Слайд 18 8.Трофическая или резервная белки: использование белков как запасного
материала для питания развивающихся клеток, например, глютелины.
Слайд 20 10. Транспортная – перенос О2, стероидов, витаминов, лекарственных
веществ и т.д. осуществляют различные фракции белков крови.
Слайд 21 11. Опорная или механическая – прочность соединительной, хрящевой
и костной ткани осуществляется за счет белков – коллагена,
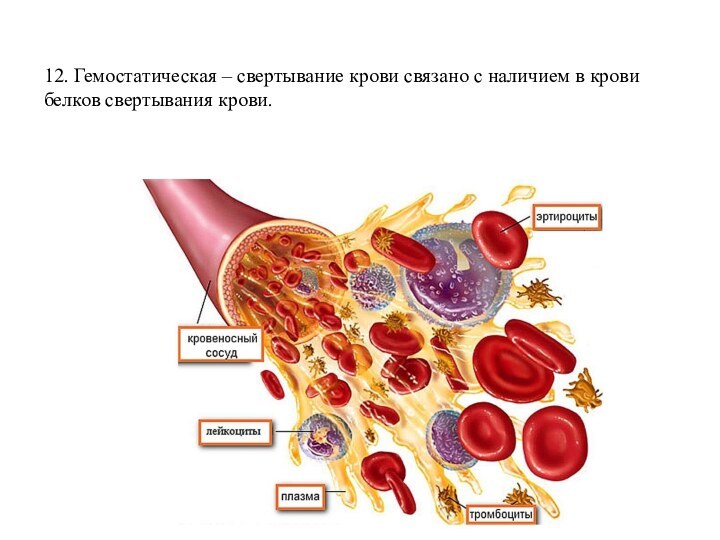
эластина.Слайд 22 12. Гемостатическая – свертывание крови связано с наличием
в крови белков свертывания крови.
Слайд 23
Аминокислоты – структурные мономеры белков.
Классификация и физико-химические
свойства аминокислот. Аминокислоты, пептиды и белки как фармакопрепараты.
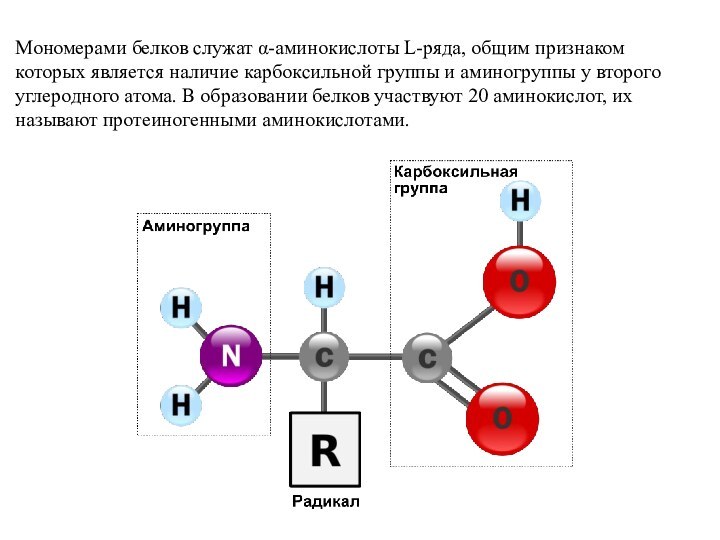
Слайд 24 Мономерами белков служат α-аминокислоты L-ряда, общим признаком которых
является наличие карбоксильной группы и аминогруппы у второго углеродного
атома. В образовании белков участвуют 20 аминокислот, их называют протеиногенными аминокислотами.
Слайд 26
Существует 3 классификации аминокислот:
I. Структурная, т.е. по строению
бокового радикала, от этого зависят физико-химические свойства аминокислот. Все
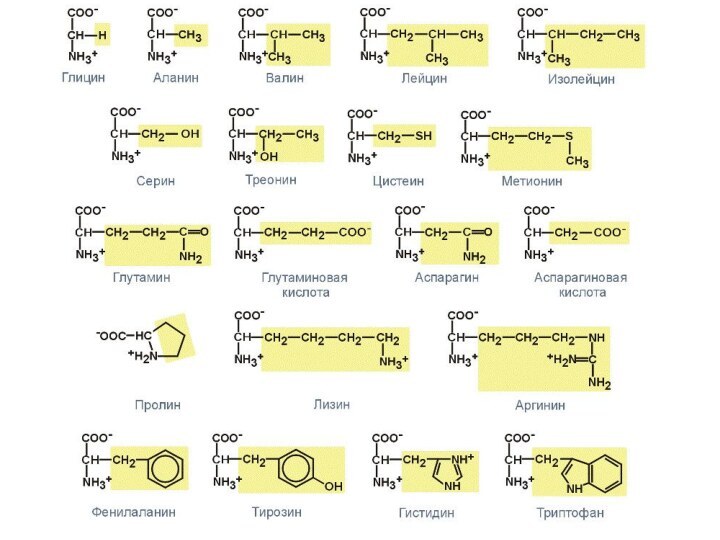
аминокислоты делят на:1.АЦИКЛИЧЕСКИЕ
а)алифатические незамещенные (валин, лейцин, изолейцин, глицин)
б)алифатические замещенные
-гидроксиаминокислоты (серин, треонин)
-тиоаминокислоты (цистеин, метионин)
-карбоксиаминокислоты (аспарагиновая, глутаминовая, аминолимонная)
-диаминокислоты (лизин)
-гуанидиноаминокислоты (аргинин)
2.ЦИКЛИЧЕСКИЕ
а)Ароматические (фенилаланин. тирозин)
б)Гетероциклические (триптофан, гистидин)
в)Циклические иминокислоты (пролин)
Слайд 27
II. Электрохимическая, т.е. по основным свойствам аминокислот. Различают:
1.Кислые
аминокислоты (аспарагиновая, глутаминовая, аминолимонная)
2.Основные аминокислоты (гистидин, аргинин, лизин)
3.Нейтральные аминокислоты
Слайд 28 Кислые аминокислоты (глутаминовая кислота, аспарагиновая кислота) имеют отрицательный
заряд и изоэлектрическую точку меньше 7, основные аминокислоты (лизин,
гистидин, аргинин) несут положительный заряд и имеют изоэлектрическую точку больше 7.Изоэлектрическая точка нейтральных аминокислот приближается к
нейтральному заряду.
Изоэлектрическая точка - это значение pH раствора, при котором молекула аминокислоты имеет нейтральный заряд.
Слайд 29 III. Биологическая или физиологическая, т.е. по степени незаменимости
аминокислоты для организма
1. Незаменимые аминокислоты не могут синтезироваться организмом
и должны обязательно поступать в организм с пищей. Таких аминокислот для человека 8: валин, лейцин, изолейцин, триптофан,
лизин, треонин, фенилаланин, метонин.
2. Полузаменимые аминокислоты могут синтезироваться в организме, но в недостаточном количестве.
Таких аминокислот 3: гистидин, аргинин, тирозин.
3. Заменимые аминокислоты синтезируются в организме в достаточном количестве.
Слайд 30
1. Отдельные аминокислоты
-глутаминовая кислота, используется при заболеваниях центральной
нервной системы;
-глицин является нейромедиатором тормозного типа действия. Улучшает метаболические
процессы в тканях мозга;-метионин, как донор метильных групп, используется в медицине в качестве липотропных средств;
-цистеин применяется в глазной практике.
В медицинской практике применяются:
2. Смесь отдельных аминокислот
-церебролизин содержит 18 аминокислот. Применяется при заболеваниях центральной нервной системы, при травмах головного мозга
3. Полный набор аминокислот в виде белковых гидролизатов.
Используется, как белковое питание.
Слайд 31 Первичная структура белков. Видовая специфичность белков. Наследственные изменения
первичной структуры.
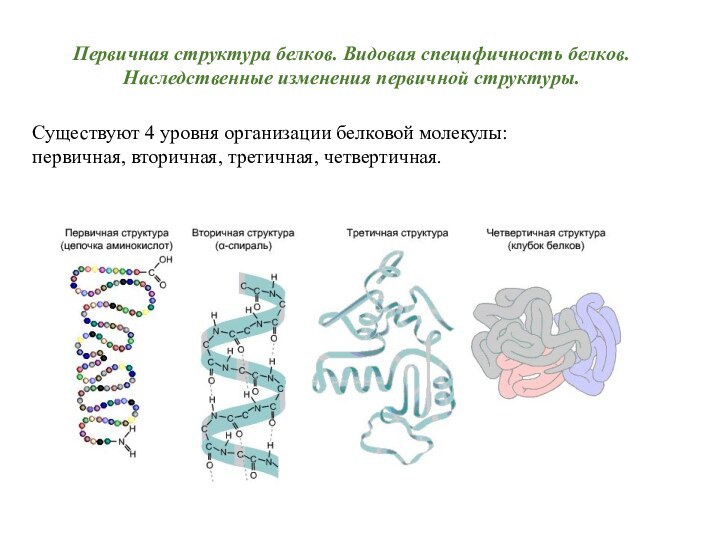
Существуют 4 уровня организации белковой молекулы:
первичная, вторичная,
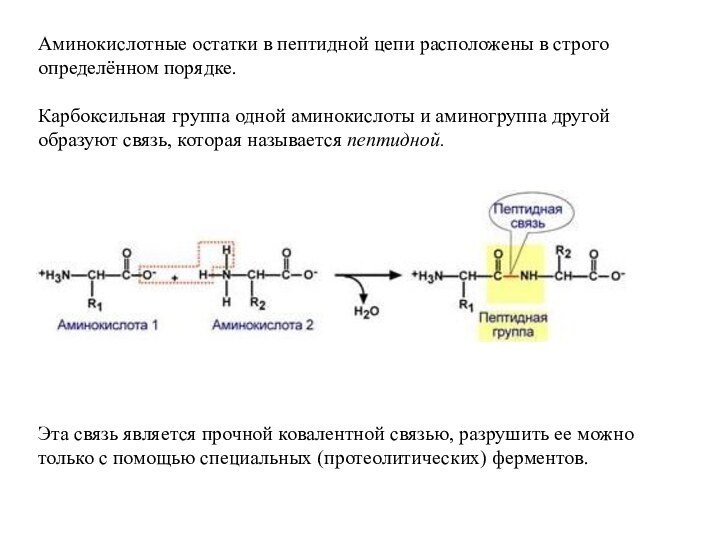
третичная, четвертичная.Слайд 32 Аминокислотные остатки в пептидной цепи расположены в строго
определённом порядке.
Карбоксильная группа одной аминокислоты и аминогруппа другой образуют
связь, которая называется пептидной. Эта связь является прочной ковалентной связью, разрушить ее можно только с помощью специальных (протеолитических) ферментов.
Слайд 33
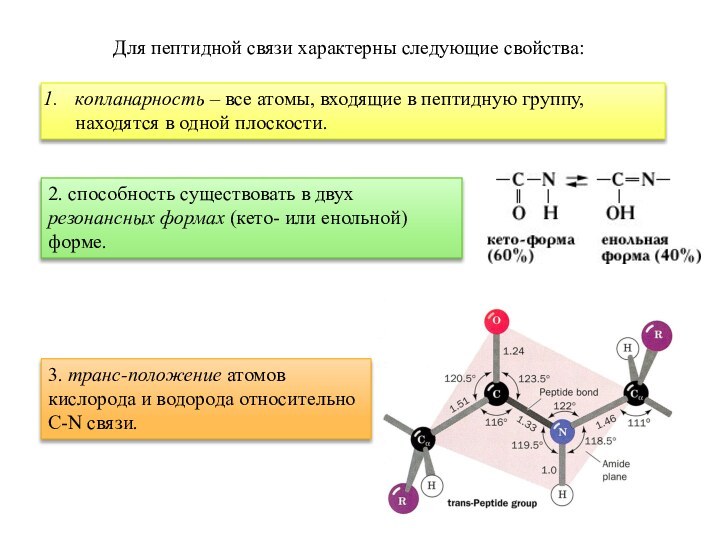
Для пептидной связи характерны следующие свойства:
копланарность – все
атомы, входящие в пептидную группу, находятся в одной плоскости.
2.
способность существовать в двух резонансных формах (кето- или енольной) форме.3. транс-положение атомов кислорода и водорода относительно
С-N связи.
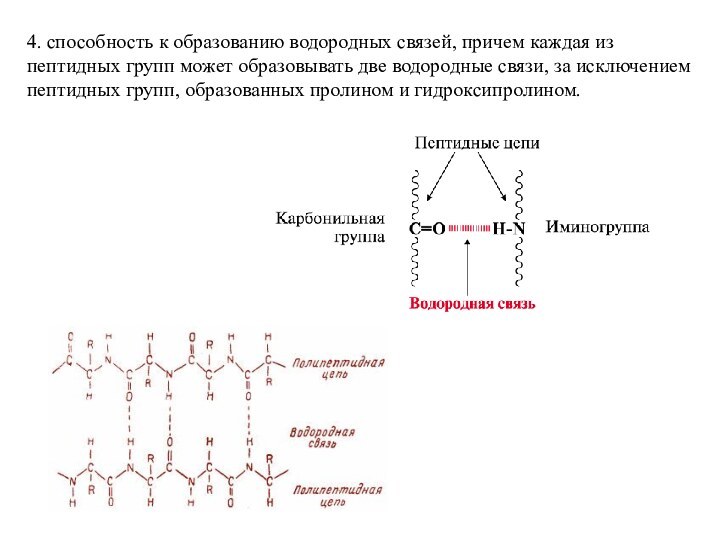
Слайд 34 4. способность к образованию водородных связей, причем каждая
из пептидных групп может образовывать две водородные связи, за
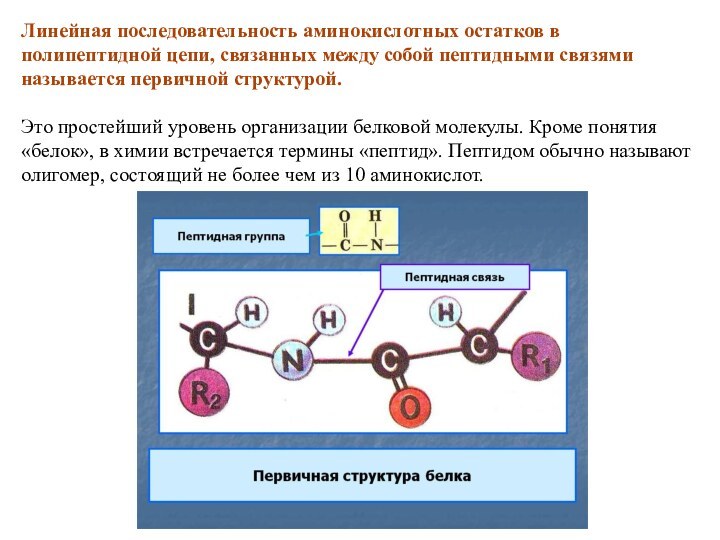
исключением пептидных групп, образованных пролином и гидроксипролином.Слайд 35 Линейная последовательность аминокислотных остатков в полипептидной цепи, связанных
между собой пептидными связями называется первичной структурой.
Это простейший
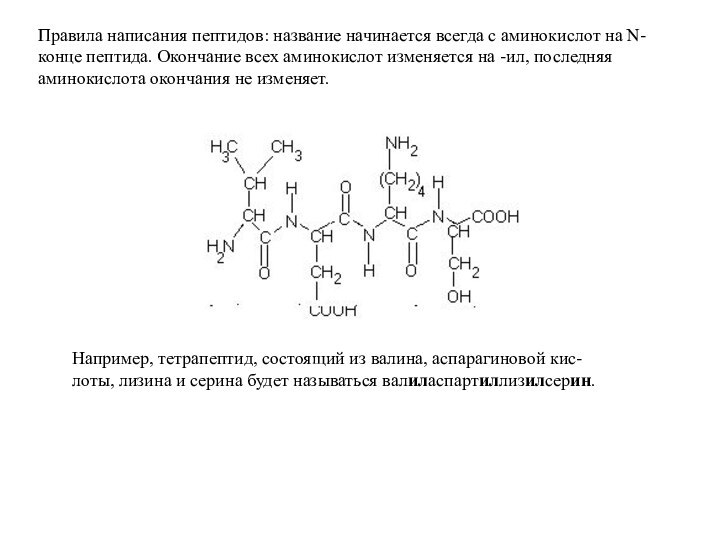
уровень организации белковой молекулы. Кроме понятия «белок», в химии встречается термины «пептид». Пептидом обычно называют олигомер, состоящий не более чем из 10 аминокислот.Слайд 36 Правила написания пептидов: название начинается всегда с аминокислот
на N-конце пептида. Окончание всех аминокислот изменяется на -ил,
последняя аминокислота окончания не изменяет.Например, тетрапептид, состоящий из валина, аспарагиновой кис-
лоты, лизина и серина будет называться валиласпартиллизилсерин.
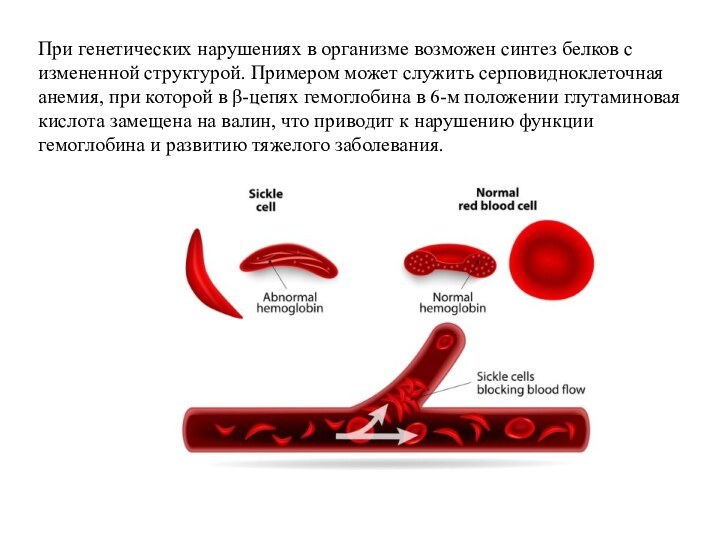
Слайд 37 При генетических нарушениях в организме возможен синтез белков
с измененной структурой. Примером может служить серповидноклеточная анемия, при
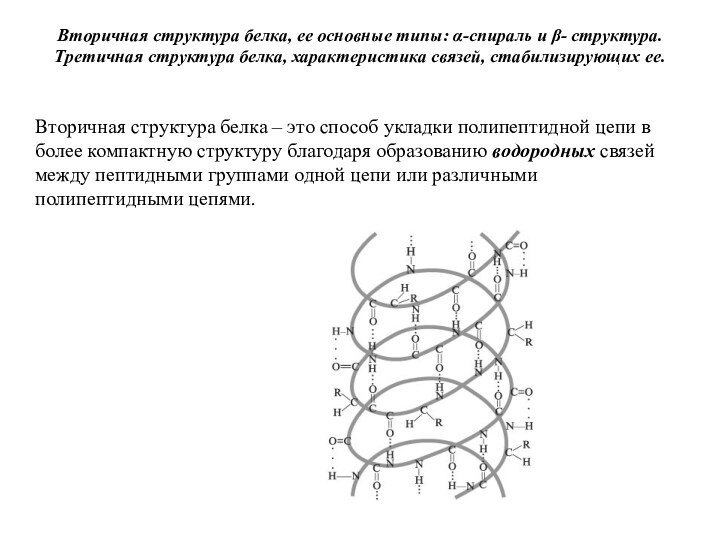
которой в β-цепях гемоглобина в 6-м положении глутаминовая кислота замещена на валин, что приводит к нарушению функции гемоглобина и развитию тяжелого заболевания.Слайд 38 Вторичная структура белка, ее основные типы: α-спираль и
β- структура. Третичная структура белка, характеристика связей, стабилизирующих ее.
Вторичная
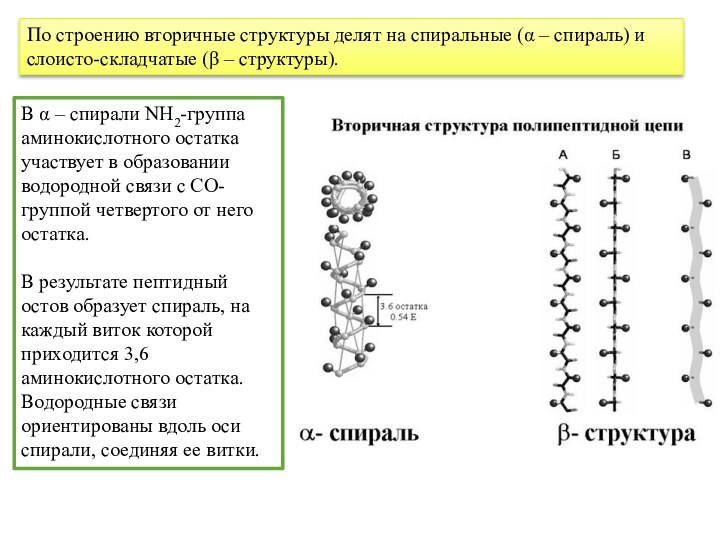
структура белка – это способ укладки полипептидной цепи в более компактную структуру благодаря образованию водородных связей между пептидными группами одной цепи или различными полипептидными цепями. Слайд 39 В α – спирали NН2-группа аминокислотного остатка участвует
в образовании водородной связи с СО-группой четвертого от него
остатка.В результате пептидный остов образует спираль, на каждый виток которой приходится 3,6 аминокислотного остатка. Водородные связи ориентированы вдоль оси спирали, соединяя ее витки.
По строению вторичные структуры делят на спиральные (α – спираль) и слоисто-складчатые (β – структуры).
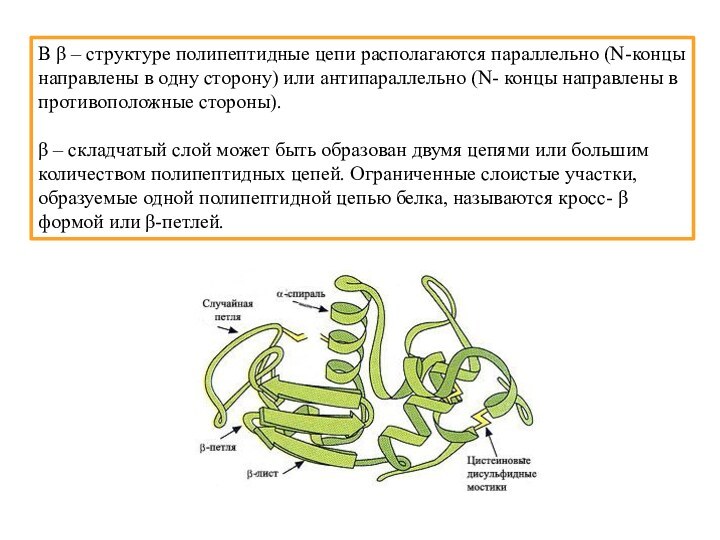
Слайд 40 В β – структуре полипептидные цепи располагаются параллельно
(N-концы направлены в одну сторону) или антипараллельно (N- концы
направлены в противоположные стороны).β – складчатый слой может быть образован двумя цепями или большим количеством полипептидных цепей. Ограниченные слоистые участки, образуемые одной полипептидной цепью белка, называются кросс- β формой или β-петлей.
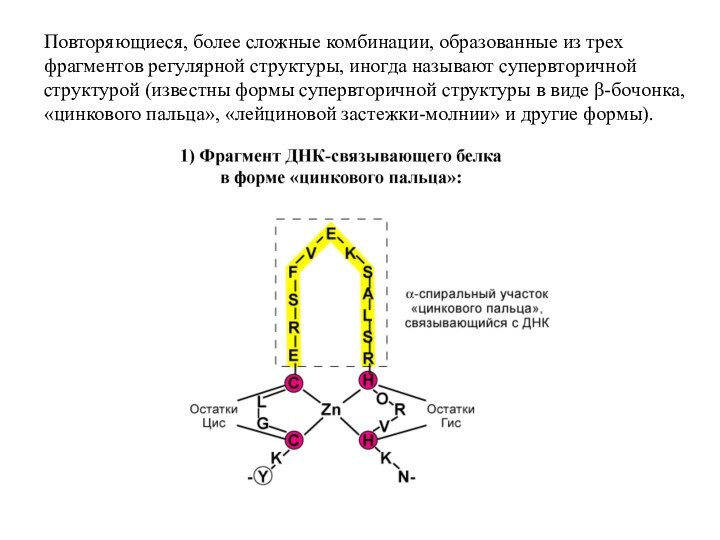
Слайд 41 Повторяющиеся, более сложные комбинации, образованные из трех фрагментов
регулярной структуры, иногда называют супервторичной структурой (известны формы супервторичной
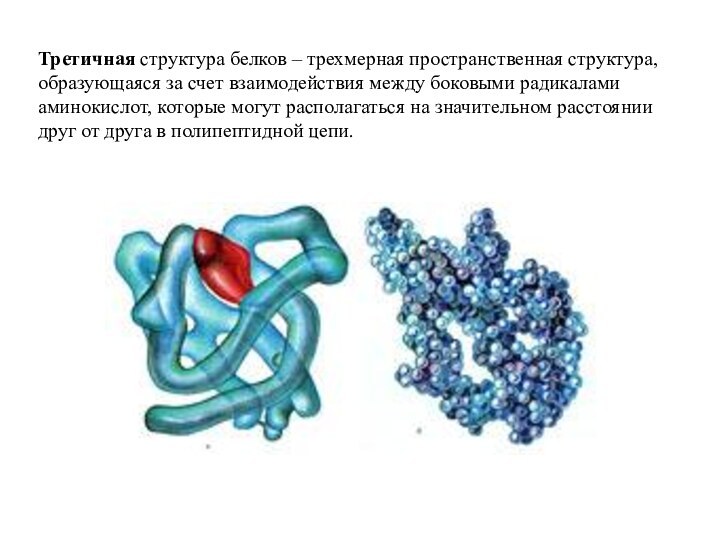
структуры в виде β-бочонка, «цинкового пальца», «лейциновой застежки-молнии» и другие формы).Слайд 42 Третичная структура белков – трехмерная пространственная структура, образующаяся
за счет взаимодействия между боковыми радикалами аминокислот, которые могут
располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Слайд 43
К ковалентным связям относятся:
дисульфидные связи – образуются между
боковыми радикалами серосодержащих аминокислот, например, между 2 остатками цистеинов
изопептидные
(псевдопептидные) – между аминогруппами боковых радикалов лизина, аргинина и СООН-группами боковых радикалов аспарагиновой, глутаминовой и аминолимонной кислот.эфирные – между СООН-группой дикарбоновых (аспарагиной, глутаминовой) и ОН-группой гидроксиаминокислот (серина, треонина).
Связи, участвующие в стабилизации третичной структуры можно разделить на сильные (ковалентные) и слабые.
К полярным (слабым) относятся:
водородные связи, которые возникают между гидрофильными незаряженными группами (такими как –ОН, -СОNH2, -SH);
ионные связи образуются между разнозаряженными группами боковых радикалов – NH3+ (лизина, аргинина, гистидина)
и СОО-(аспарагиновой и глутаминовой кислот).
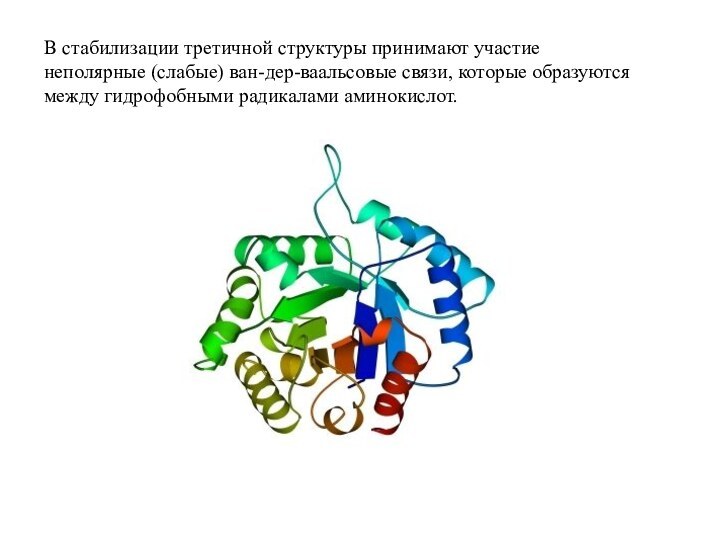
Слайд 44 В стабилизации третичной структуры принимают участие неполярные (слабые)
ван-дер-ваальсовые связи, которые образуются между гидрофобными радикалами аминокислот.
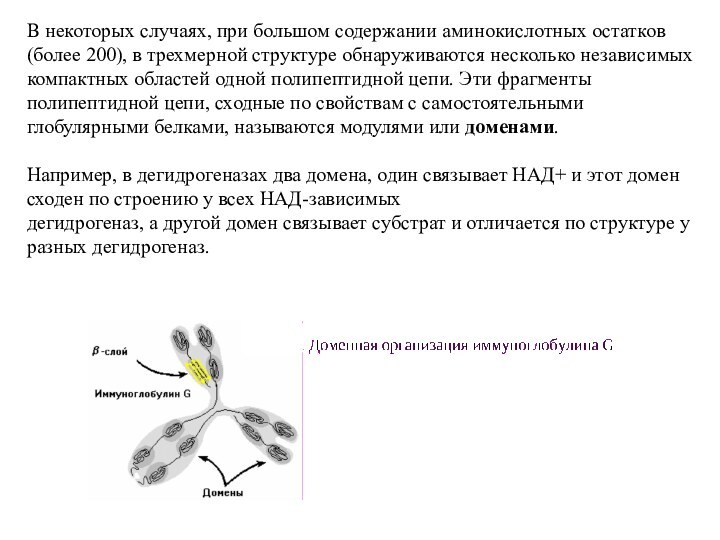
Слайд 45 В некоторых случаях, при большом содержании аминокислотных остатков
(более 200), в трехмерной структуре обнаруживаются несколько независимых компактных
областей одной полипептидной цепи. Эти фрагменты полипептидной цепи, сходные по свойствам с самостоятельными глобулярными белками, называются модулями или доменами.Например, в дегидрогеназах два домена, один связывает НАД+ и этот домен сходен по строению у всех НАД-зависимых
дегидрогеназ, а другой домен связывает субстрат и отличается по структуре у разных дегидрогеназ.
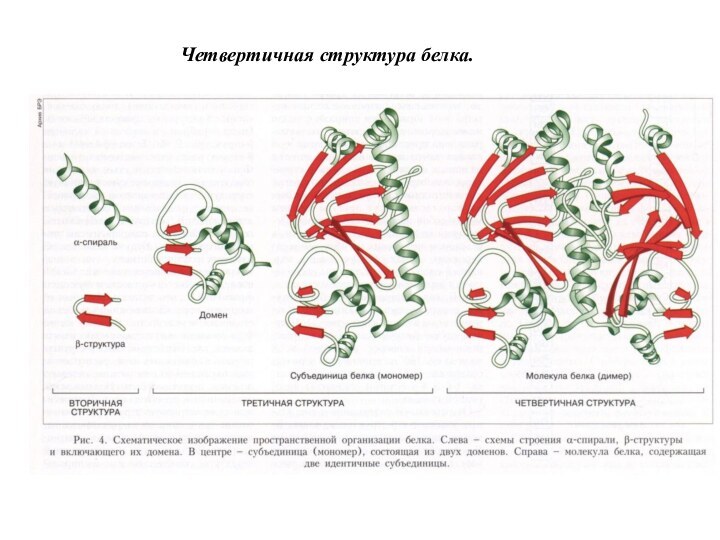
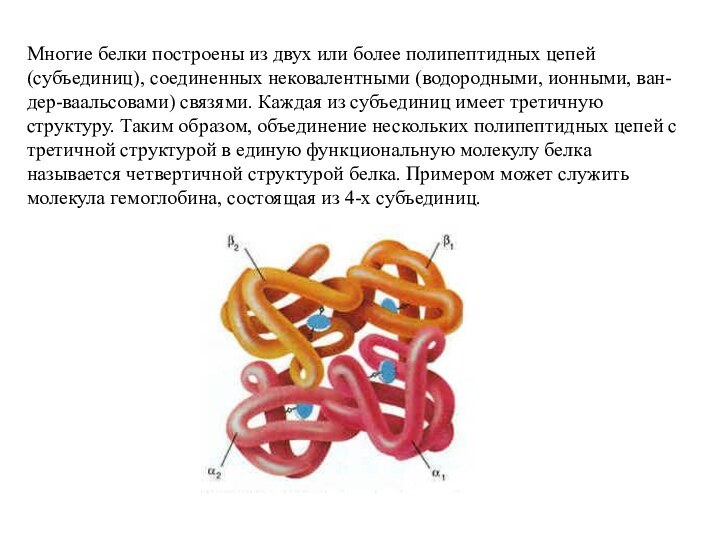
Слайд 47 Многие белки построены из двух или более полипептидных
цепей (субъединиц), соединенных нековалентными (водородными, ионными, ван-дер-ваальсовами) связями. Каждая
из субъединиц имеет третичную структуру. Таким образом, объединение нескольких полипептидных цепей с третичной структурой в единую функциональную молекулу белка называется четвертичной структурой белка. Примером может служить молекула гемоглобина, состоящая из 4-х субъединиц.
Слайд 48
Основные группы сложных белков.
Сложные белки состоят из белковой
части (апопротеина) и небелковой части (простетической группы).
В зависимости
от строения простетической группы, принято различать следующие группы сложных белков:- фосфопротеины;
- гликопротеины;
- липопротеины;
- нуклеопротеины;
- хромопротеины;
- металлопротеины.
Слайд 49 Фосфопротеины, кроме белковой части (апопротеина), содержат остатки фосфорной
кислоты (Н3РО4). С белковой частью она соединяется прочной ковалентной
связью через –ОН группу серина, треонина, реже тирозина.Изменение активности фермента, вызванное фосфорилированием, обратимо. Отщепление остатка фосфорной кислоты осуществляется ферментами протеинфосфатазами и называется дефосфорилированием. Активность протеинкиназ и протеинфосфатаз регулируется гормонами, что позволяет быстро изменять активность ключевых (основных) ферментов в зависимости от условий внешней среды. Процессы фосфорилирования/ дефосфорилирования являются основным путем регуляции ферментативной активности.
Молекула фосфорной кислоты придает белковой молекуле сильный отрицательный заряд и новые свойства. Присоединение фосфорной кислоты осуществляется ферментами – протеинкиназами и называется фосфорилированием.
При фосфорилировании изменяется конформация (строение) активного центра и его каталитическая активность. Одни ферменты при фосфорилировании активируются (например, гликогенфосфорилаза), другие – становятся неактивными (например, гликогенсинтаза).
Слайд 50 Гликопротеины – сложные белки, состоящие из белковой части
(апопротеина) и углеводной части. Углеводный компонент чаще всего представлен
одним моносахаридом (глюкозой, галактозой и др.).Присоединяется углеводный компонент за счет гликозидной связи через гидроксильную группу серина или треонина (О-гликозидное соединение) или амидную группу аспарагина (N-гликозидное соединение).
Биологические функции гликопротеинов.
Гликопротеины являются гормонами (фоллитропин и др.), рецепторами для гормонов (рецептор для инсулина), ферментами (холинэстераза), антителами, компонентами межклеточного матрикса (коллаген).
В гликопротеинах белковая часть молекулы преобладает над углеводной. Позже были обнаружены макромолекулы, где углеводов больше, их назвали протеогликанами, они содержат длинные углеводные цепи – гликозиламиногликаны (мукополисахариды).
Протеогликаны являются важными компонентами внеклеточного матрикса.
Слайд 51 Липопротеины – сложные белки, состоящие из белковой части
(апопротеина) и липидного компонента.
Существует 5 основных типов липопротеинов: хиломикроны,
липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП), липопротеины высокой плотности (ЛПВП).— Хиломикроны синтезируются в эпителии тонкого кишечника и транспортируют пищевые липиды (триацилглицерины - ТАГ) из клеток кишечника в кровь. Основной апопротеин в составе хиломикрон.
— ЛПОНП содержат несколько меньше ТАГ, чем хиломикроны, но больше холестерина, фосфолипидов и белка. Синтезируются в клетках печени и транспортируют ТАГ (эндогенные липиды) из печени к периферическим тканям.
— ЛППП – промежуточная форма превращения ЛПОНП в ЛПНП под действием фермента липопротеин-липазы.
— ЛПНП синтезируются в крови из ЛПОНП и ЛППП, доставляют холестерол клеткам периферических тканей.
— ЛПВП – предшественники ЛПВП синтезируются в печени. Основная функция – удаление избытка холестерола из клеток и транспорт его в печень для заключительного этапа катаболизма.
Слайд 52 Кофакторпротеины состоят из белка и небелковой части –
кофактора.
В зависимости от строения кофактора различают:
гемпротеины (небелковая
часть – гем), флавопротеины (небелковая часть флавины или производные витамина В2),
хлорофиллпротеины (небелковая часть – хлорофилл) и другие группы.
Слайд 53
Нуклеиновые кислоты
Общая характеристика нуклеиновых кислот.
Компоненты НК, их
строение. Нуклеозид-5-трифосфаты, циклические нуклеотиды, их функции
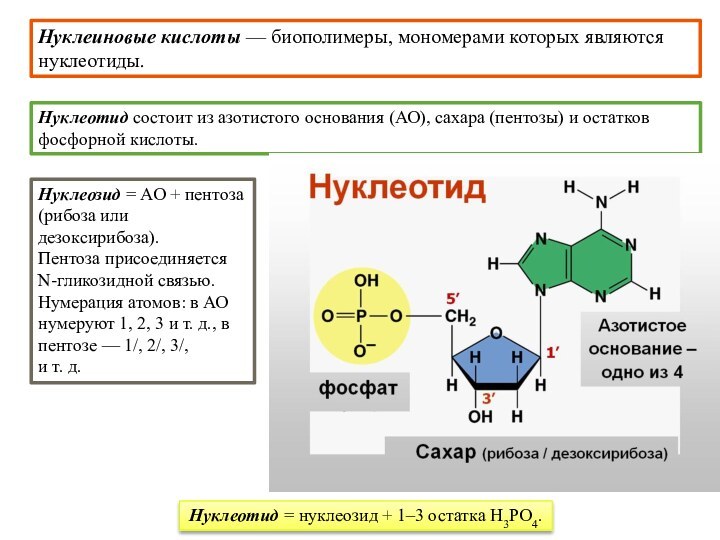
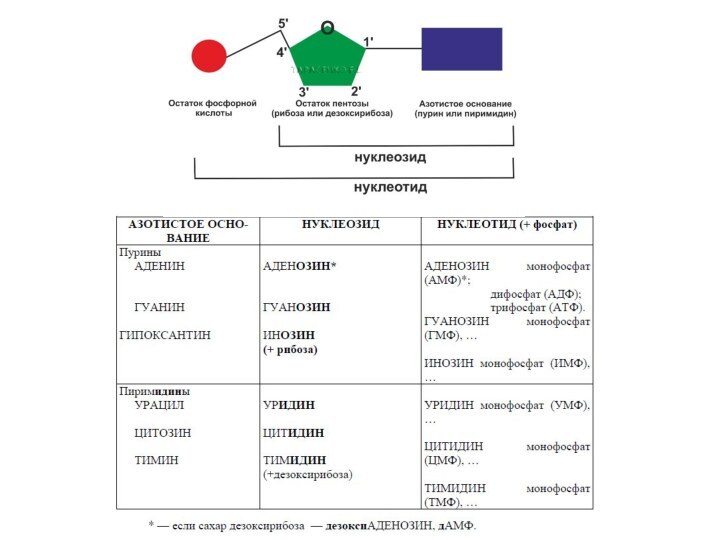
Нуклеиновые кислоты — биополимеры,
мономерами которых являются нуклеотиды.
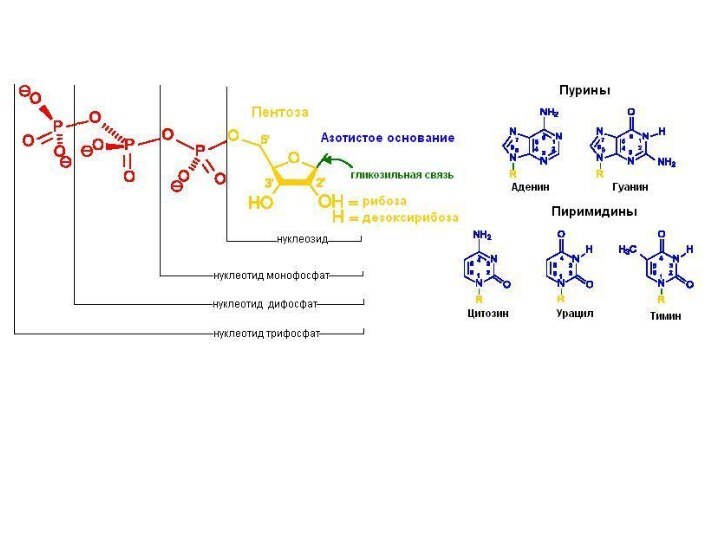
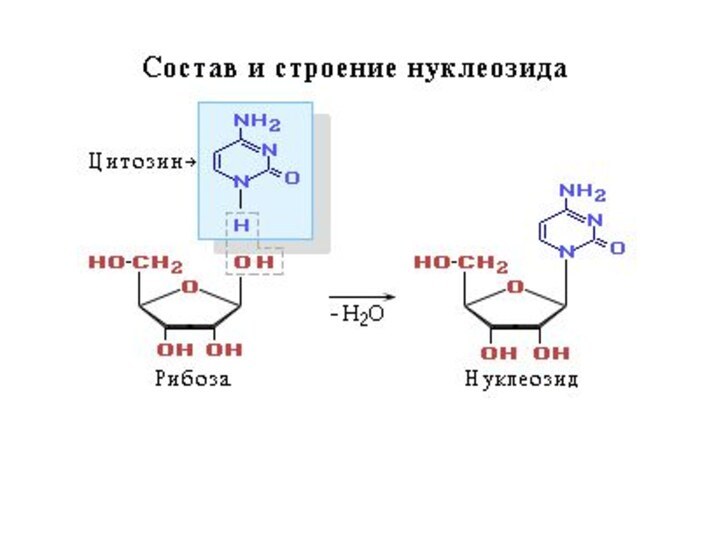
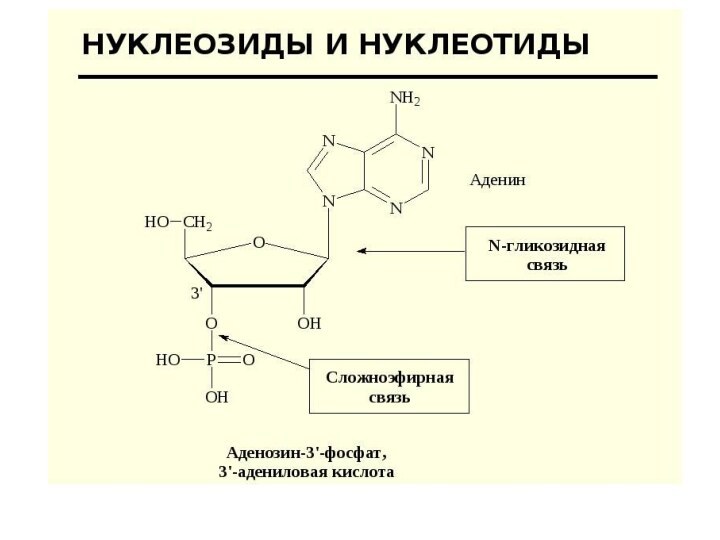
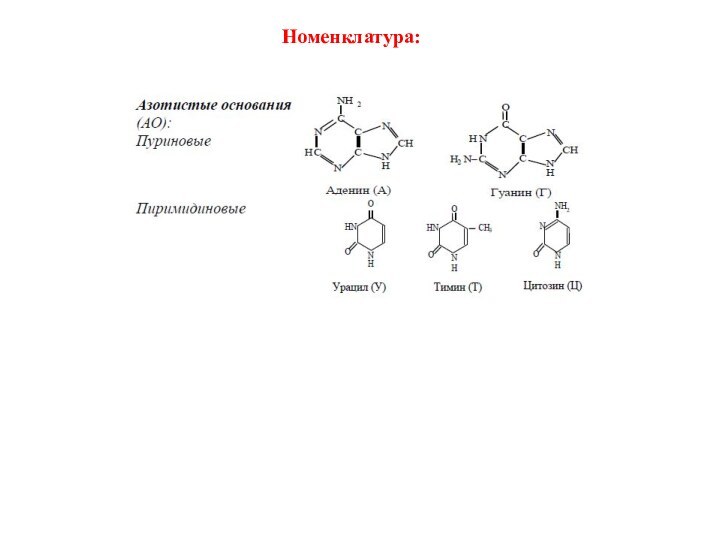
Слайд 54
Нуклеотид = нуклеозид + 1–3 остатка H3PO4.
Нуклеиновые кислоты
— биополимеры, мономерами которых являются нуклеотиды.
Нуклеотид состоит из азотистого
основания (АО), сахара (пентозы) и остатков фосфорной кислоты.Нуклеозид = АО + пентоза (рибоза или дезоксирибоза).
Пентоза присоединяется N-гликозидной связью.
Нумерация атомов: в АО нумеруют 1, 2, 3 и т. д., в пентозе — 1/, 2/, 3/,
и т. д.
Слайд 60
Биологическая роль нуклеотидов:
1) являются универсальными источниками энергии в
клетке (АТФ, ГТФ);
2) являются мономерами в составе нуклеиновых кислот.
3)
входят в состав коферментов (НАД+, НАДФ+, ФАД, КоА-SH);4) являются аллостерическими регуляторами активности ферментов;
5) циклические мононуклеотиды (цАМФ, цГМФ) являются вторичными посредниками действия гормонов и других сигналов на
клетку.
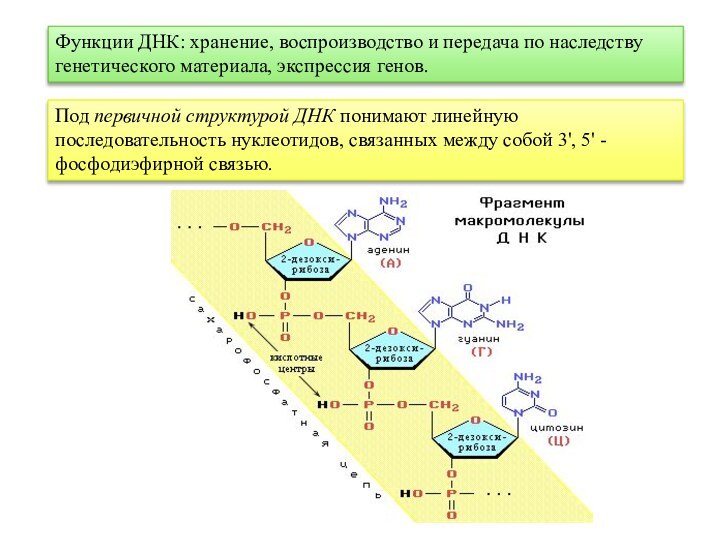
Слайд 61 Функции ДНК: хранение, воспроизводство и передача по наследству
генетического материала, экспрессия генов.
Под первичной структурой ДНК понимают линейную
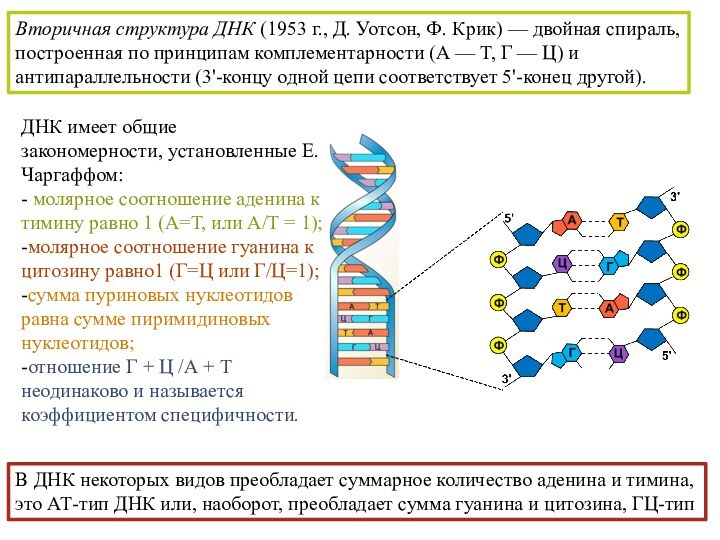
последовательность нуклеотидов, связанных между собой 3', 5' - фосфодиэфирной связью.Слайд 62 Вторичная структура ДНК (1953 г., Д. Уотсон, Ф.
Крик) — двойная спираль, построенная по принципам комплементарности (А
— Т, Г — Ц) и антипараллельности (3'-концу одной цепи соответствует 5'-конец другой).ДНК имеет общие закономерности, установленные Е.Чаргаффом:
- молярное соотношение аденина к тимину равно 1 (А=Т, или А/Т = 1);
-молярное соотношение гуанина к цитозину равно1 (Г=Ц или Г/Ц=1);
-сумма пуриновых нуклеотидов равна сумме пиримидиновых нуклеотидов;
-отношение Г + Ц /А + Т неодинаково и называется коэффициентом специфичности.
В ДНК некоторых видов преобладает суммарное количество аденина и тимина, это АТ-тип ДНК или, наоборот, преобладает сумма гуанина и цитозина, ГЦ-тип
Слайд 63
Ферменты
Ферменты (энзимы) – вещества белковой природы, обеспечивающие протекание
биохимических реакций с высокой скоростью.
Чтобы произошла химическая реакция,
необходимы следующие условия:молекулы должны сблизиться (столкнуться);
2) запас энергии молекул в момент столкновения должен быть достаточен для преодоления энергетического барьера реакции, причем высота этого барьера неодинакова для различных реакций.
Слайд 64 Энергия активации (свободная энергия активации) – дополнительное количество
кинетической энергии, которое необходимо сообщить молекулам вещества, чтобы они
вступили в химическую реакцию, т.е. преодолели энергетический барьер.При достижении этого энергетического барьера в молекулах вещества происходят изменения, вызывающие перераспределение химических связей и образование новых соединений. Чем больше молекул обладает энергией, способной преодолеть энергетический барьер, тем выше скорость химической реакции.
Это становится возможным в двух случаях, если:
придать реагирующим веществам избыточную энергию (например, за счет увеличения температуры);
снизить высоту энергетического барьера, что становится возможным при ферментативном катализе за счет увеличения числа стадий химического процесса. Активирование ряда промежуточных реакций приводит к тому, что исходный энергетический барьер дробится на несколько более низких барьеров, преодолеть которые значительно легче.
Слайд 65
Ферменты и небиологические катализаторы имеют следующие сходные признаки:
1.
Они катализируют только энергетически возможные реакции (когда свободная энергия
исходных веществ выше, чем у продуктов реакции).2. Они никогда не изменяют направление реакции.
3. Они не расходуются в процессе реакции.
Слайд 66
Отличия ферментов от небиологических катализаторов:
1. Скорость ферментативного катализа
намного выше.
2. Ферменты обладают высокой специфичностью.
3. Ферменты катализируют реакции
в "мягких" условиях, температуре около 370 , обычном давлении и рН среды, близком к нейтральной. Небиологические катализаторы "работают" при высоком давлении, температуре и крайних значениях рН.4. Скорость протекания ферментативной реакции можно регулировать в отличие от небиологических катализаторов.
5. Для ферментативных реакций характерна следующая зависимость: чем больше концентрация фермента, тем выше скорость реакции.
Слайд 67
Классификация и номенклатура ферментов.
Все ферменты разделены на 6
классов, каждый из которых имеет свой порядковый номер, строго
закрепленный за ним!1. Оксидоредуктазы
2. Трансферазы
3. Гидролазы
4. Лиазы
5. Изомеразы
6. Лигазы (Синтетазы)