т.е. укрупнение, соединение отдельных «молекул» до частиц коллоидного размера.
обязательна взаимная нерастворимость д. ф. и д. с.
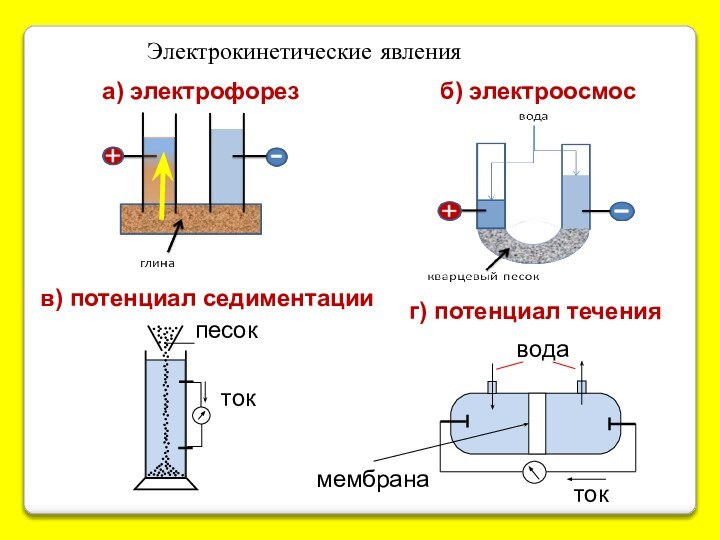
Внутренняя структура коллоидных частиц
суспезоиды,
молекулярные и
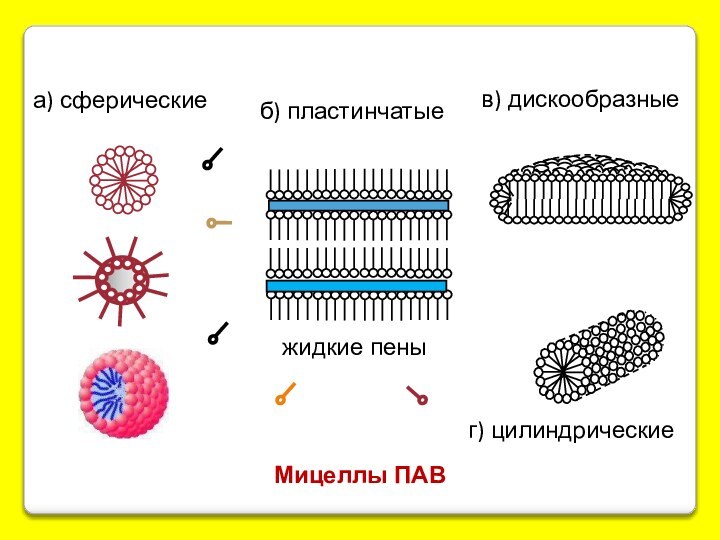
мицеллярные коллоиды.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



















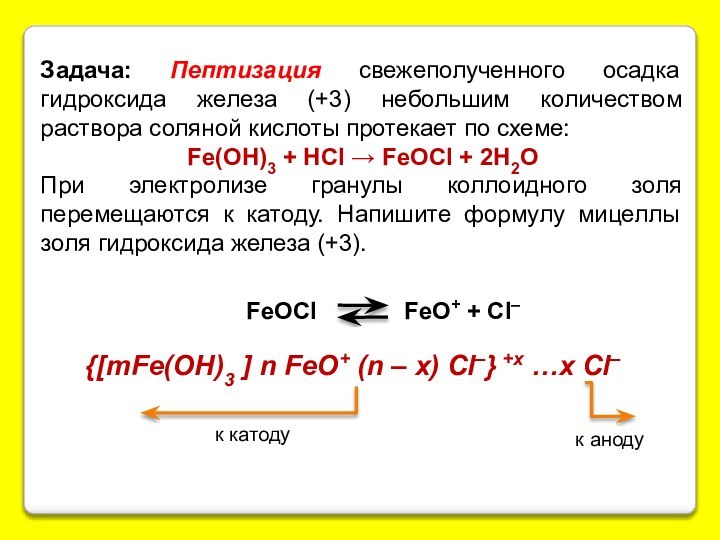
{[mAgI] nI – (n-x)K+ yH2O}-х xK+ zH2O
Строение мицеллы лиофильного золя:
{[mSiO2·jH2O] nSiO32-·2(n-x)H+·yH2O}2х- 2xH+·zH2O.
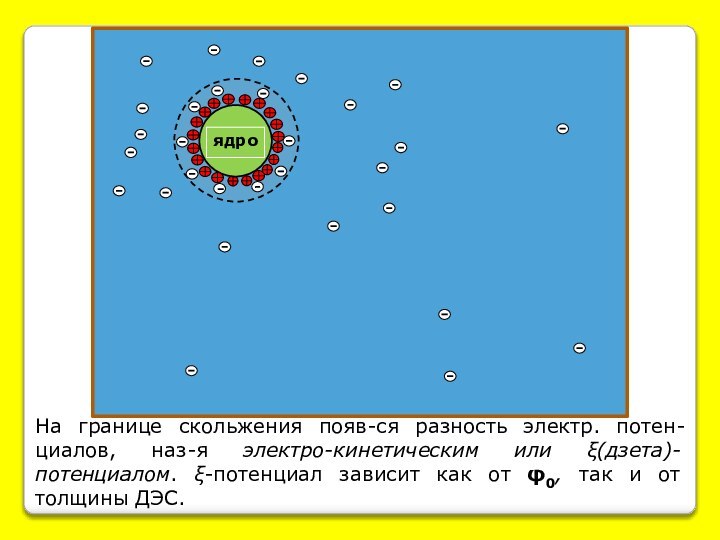
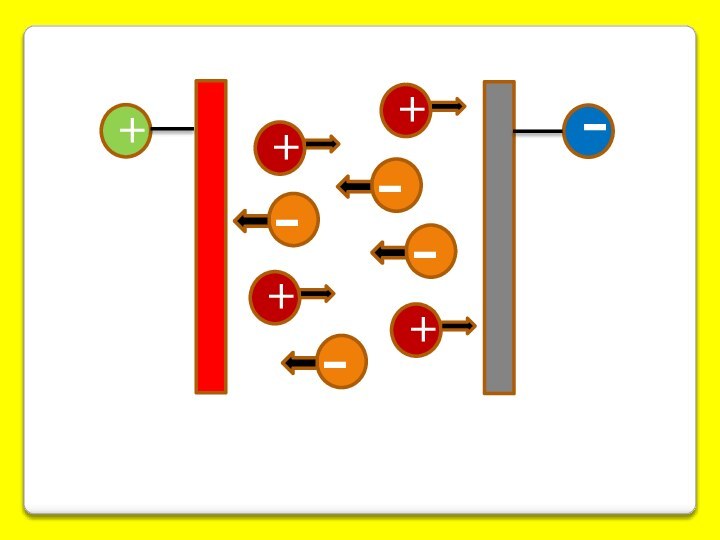
Наличие электрического заряда у частиц дисперсной фазы приводит к их значительной гидратации.
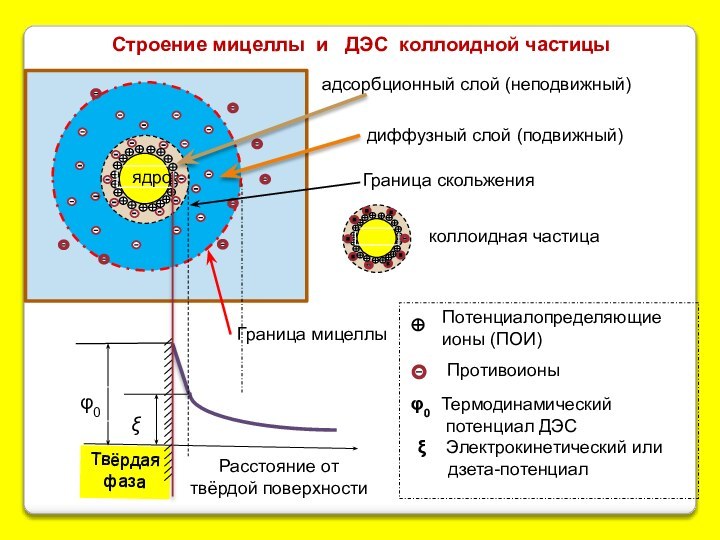
φ0
ξ
ядро
диффузный слой (подвижный)
адсорбционный слой (неподвижный)
коллоидная частица
Граница мицеллы
Строение мицеллы и ДЭС коллоидной частицы
полярная или ионогенная группа («головка»)
Дифильные молекулы принято изображать символом
неполярный углеводородный радикал («хвост»)
С ув-нием конц-ции отд. молекулы начинают ассоциировать друг с другом с обр-нием агрегатов или мицелл коллоидных размеров.
( лат. gelate - замерзать)
(раствор)
правило Шульца и Гарди