- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Коррозия металлов
Содержание
- 2. 1813 г. Гемфри Деви открыл электрохимическую коррозию металлов
- 3. Коррозия – от лат. corrodere - разъедать
- 4. Коррозия- это самопроизвольное разрушение металлов и сплавов под влиянием окружающей среды
- 5. Ежегодно 1/4 всего произведенного Fe теряется из-за коррозии
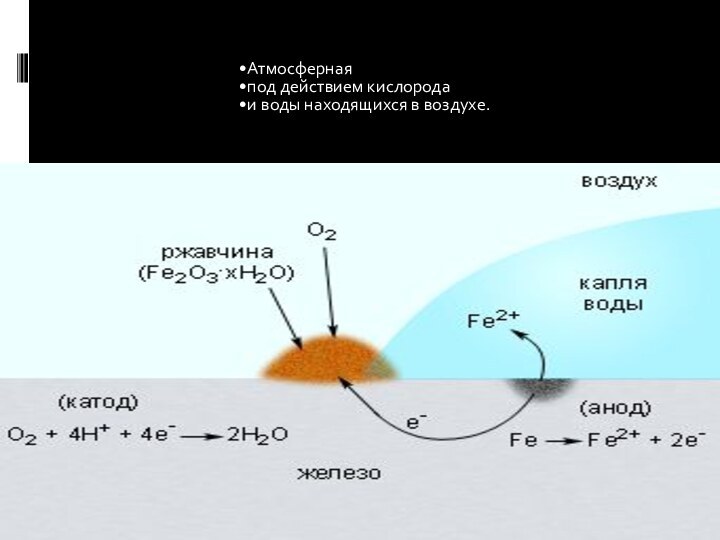
- 6. УСЛОВИЯ, СПОСОБСТВУЮЩИЕ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИПоложение металла в
- 9. Протекающие при химической коррозии окислительно - восстановительные
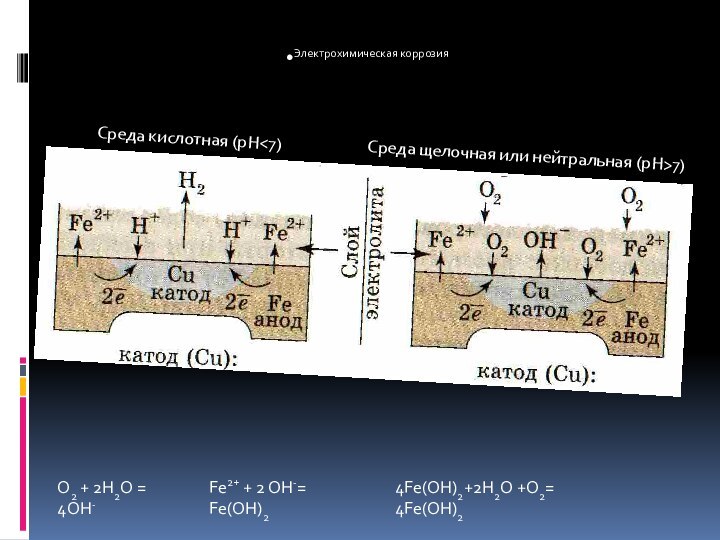
- 11. Среда кислотная (pH7)O2 + 2H2O = 4OH-Fe2+ + 2 OH-= Fe(OH)24Fe(OH)2+2H2O +O2= 4Fe(OH)2
- 12. Последствия коррозии
- 13. Химически чистое железо не ржавеет, т.к. не содержит примесейИндия, Новый Дели, Железный столб 1 в н.э
- 14. коррозионные свойства металлов1 группа – щелочные металлы
- 15. 3 группа – Алюминий – образуется прочная
- 16. 5,6,7,8группы. – металлы побочных подгрупп обладают высокой
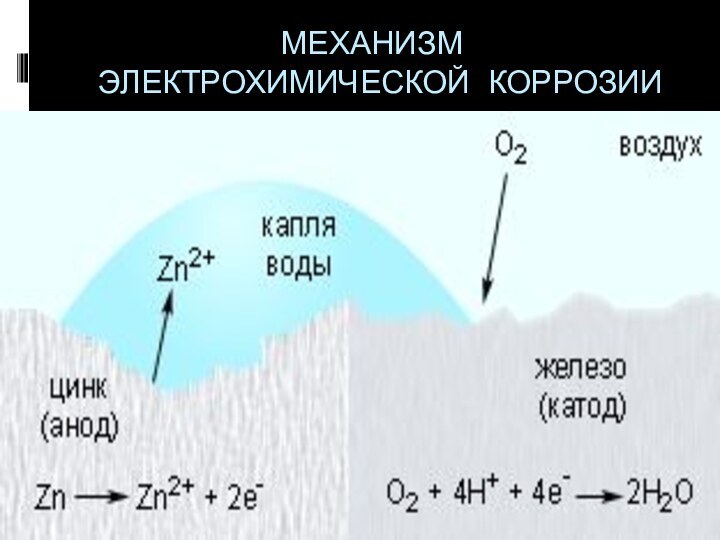
- 17. МЕХАНИЗМ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
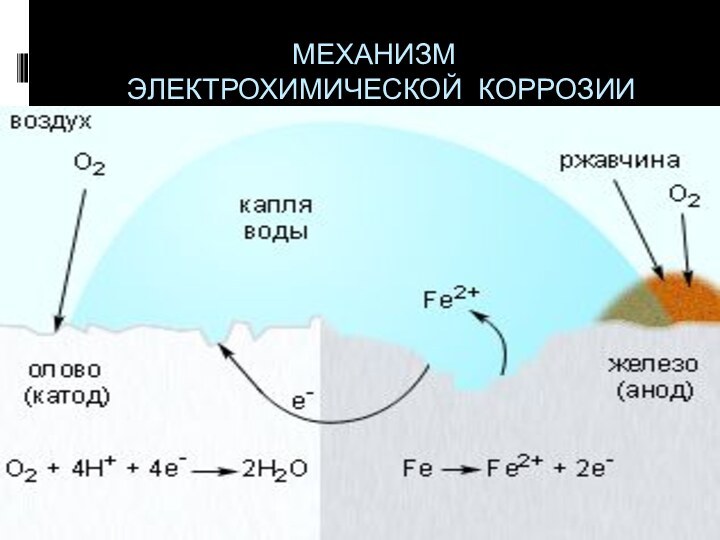
- 18. МЕХАНИЗМ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
- 19. Скачать презентацию
- 20. Похожие презентации
1813 г. Гемфри Деви открыл электрохимическую коррозию металлов















Слайд 6
УСЛОВИЯ,
СПОСОБСТВУЮЩИЕ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
Положение металла в ряду активности
металлов: чем они дальше расположены друг от друга, тем
быстрее происходит коррозия.Чистота металла: примеси ускоряют коррозию.
Неровности поверхности металла, трещины.
Грунтовые воды, морская вода, среда электролита.
Повышение температуры.
Действие микроорганизмов (грибы, бактерии и лишайники воздействуют на металл с высокой коррозионной стойкостью).
Слайд 9 Протекающие при химической коррозии окислительно - восстановительные реакции
осуществляются путем непосредственного перехода электронов с атомов металлов на
частицы окислителя, входящего в состав среды.Слайд 13 Химически чистое железо не ржавеет, т.к. не содержит
примесей
Индия, Новый Дели, Железный столб
1 в н.э
Слайд 14
коррозионные
свойства металлов
1 группа – щелочные металлы –
наименьшая коррозийная
стойкость.(побочная подгруппа
– весьма стойкие металлы)
2 группа
– главная подгруппа – малоустойчивы, побочная – более
устойчивы( в присутствии кислорода образуют
прочные пленки оксидов,
предохраняющие от дальнейшего разрушения)
Слайд 15 3 группа – Алюминий – образуется прочная оксидная
пленка ( но она разрушается в растворах кислот и
щелочей).4 группа – Олово и свинец – стойкие к коррозии металлы, благодаря прочным оксидным пленкам.





























