- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Nk-клетки
Содержание
- 2. NK-клеткибольшие гранулярные лимфоциты, обладающие цитотоксичностью противопухолевых клеток и клеток,
- 3. ХарактеристикаЗадача- выявлять и уничтожать собственные клетки организма,
- 5. МаркёрыNK-клетки не имеют основных маркёров Т- или
- 6. РецепторыNK-клетки уничтожают клетку-мишень после установления с ней
- 8. Роль цитокиновАктивность NK-клеток регулируют цитокины (у-ИФН и
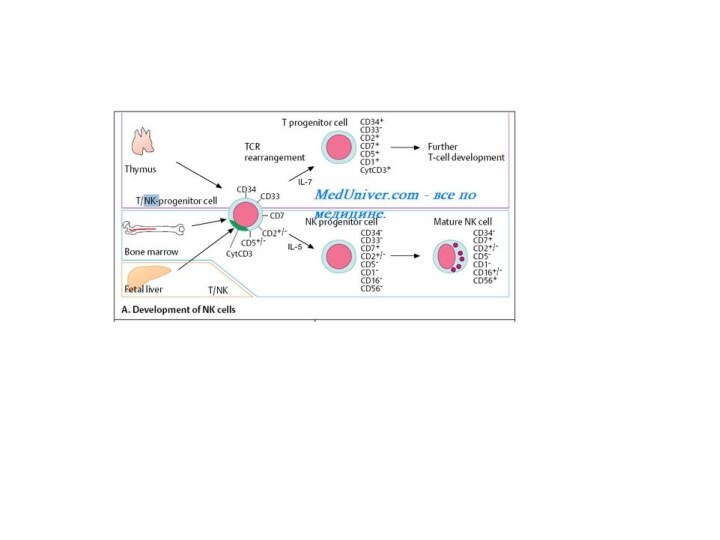
- 9. Развитие
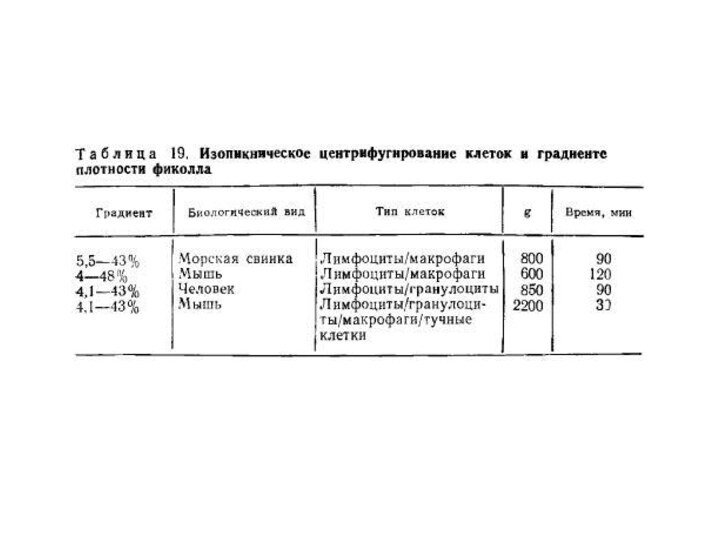
- 10. Современные методы выделения лимфоцитов и других клеток
- 11. Для выделения мононуклеаров крови наиболее широкое распространение
- 12. Для выделения моноцитов из суммарной фракции мононуклеаров
- 13. Разделение клеток в градиенте плотностиМатериалы и оборудование.
- 14. Центрифугирование в градиенте плотностиВвиду разнообразия применяемых методов
- 16. ступенчатый градиент плотностиОдновременное разделение эозинофилов, нейтрофилов и
- 17. Составляют градиент осторожно, наслаивая друг на друга
- 18. Разделение гранулоцитов и фракции лимфоциты/моноциты человека в
- 19. Изокинетическое разделениеИзокинетическое разделение используют при необходимости разделять
- 20. Все многообразие методов разделения клеток можно видеть
- 21. Седиментация в градиенте плотностиФракционирование клеток различной величины
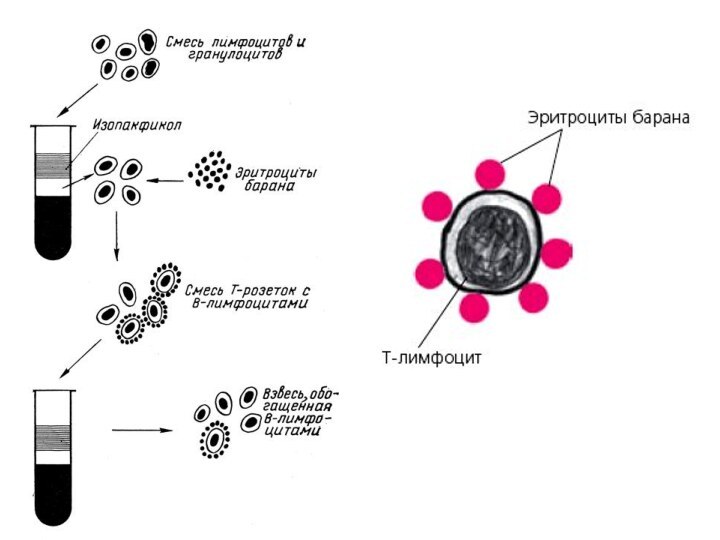
- 22. Идентификация T-лимфоцитов1. Выделение чистых лимфоцитов в градиенте
- 23. 4. Постановка реакции. К 0,25 мл рабочей
- 24. 5. Готовят мазки па предметных стеклах методом
- 25. 6. Учет реакции. Под иммерсионной системой микроскопа
- 27. Идентификация В-лимфоцитов1. Эритроциты барана трижды отмывают раствором
- 28. 5. Отмытые эритроциты инкубируют с равным объемом
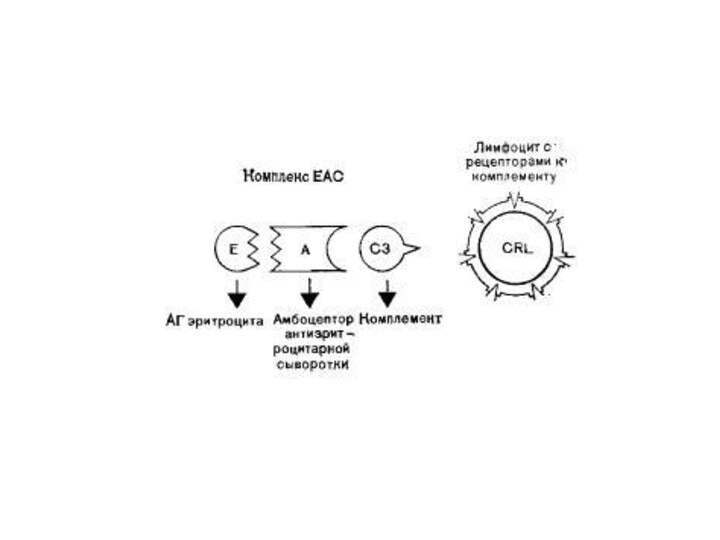
- 30. Оценка функциональной активности NK-клеток с использованием проточной цитометрии
- 31. В качестве метки для КМ применяют флуоресцентный
- 32. Первоначально нефлуоресцирующий КФДЭ проникает через клеточную мембрану.
- 33. Скачать презентацию
- 34. Похожие презентации
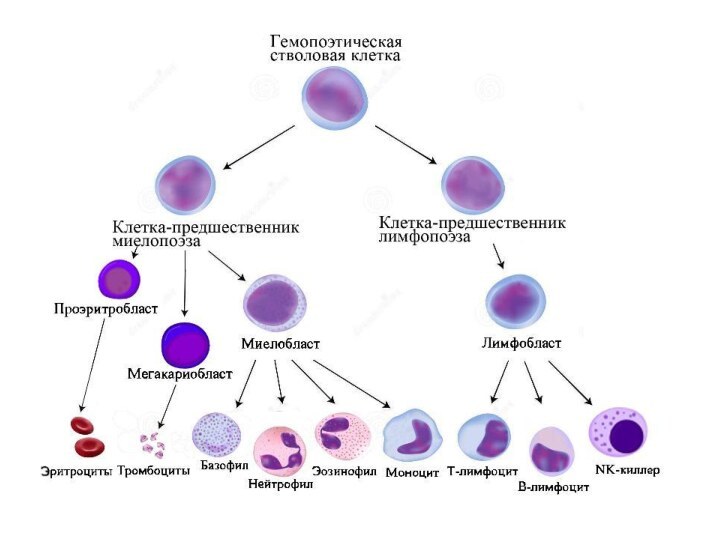
NK-клеткибольшие гранулярные лимфоциты, обладающие цитотоксичностью противопухолевых клеток и клеток, зараженных вирусами. В настоящее время NK-клетки рассматривают как отдельный класс лимфоцитов. NK выполняют цитотоксические и цитокин-продуцирующие функции. NK являются одним из важнейших компонентов клеточного врождённого иммунитета.



























Слайд 2
NK-клетки
большие гранулярные лимфоциты, обладающие цитотоксичностью противопухолевых клеток и клеток, зараженных вирусами.
Слайд 3
Характеристика
Задача- выявлять и уничтожать собственные клетки организма, в
которых что-то нарушилось.
Составляют 5% лимфоцитов периферической крови
Фенотип: CD3-CD16+CD56+CD94+ и
гаметное (неперестроенное) расположение генов.
Слайд 5
Маркёры
NK-клетки не имеют основных маркёров Т- или B-лимфоцитов
(поэтому их также называют нулевые лимфоциты), но экспрессируют дифференцировочные
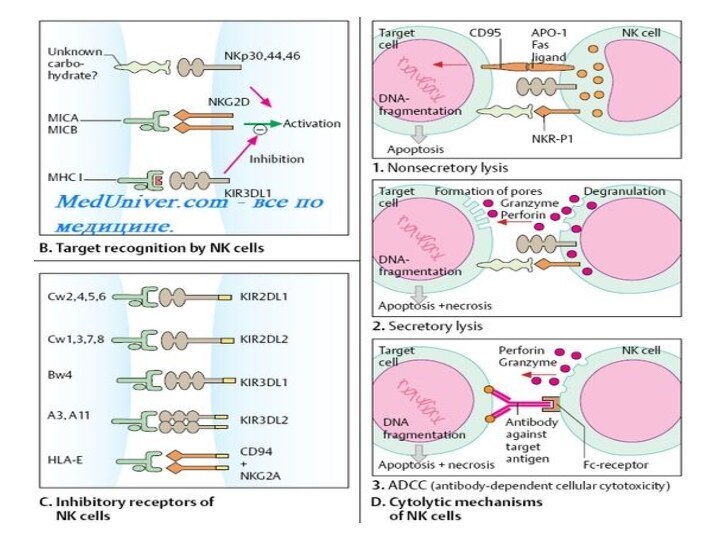
CD2, CD56 и CD16 (рецептор Fc-фрагмента AT) Аг. В отличие от цитотоксических лимфоцитов, способность NK-клеток к цитолизу связана со самостоятельным распознаванием «своё-чужое» на поверхности мишени.
Слайд 6
Рецепторы
NK-клетки уничтожают клетку-мишень после установления с ней прямого
контакта при помощи специальных белков — перфоринов. Перфорины встраиваются
в мембрану чужеродной или трансформированной клетки, образуя в ней «дыру», приводящую к необратимому и гибельному выравниванию ионного состава между цитоплазмой и внешней средой.
Слайд 8
Роль цитокинов
Активность NK-клеток регулируют цитокины (у-ИФН и ИЛ-2
усиливают их цитолитическую активность). Наряду с макрофагами, нейтрофилами и
эозинофилами они также участвуют в антителозависимом клеточно-опосредованном цитолизе. Для этого NK-клетки экспрессируют на своей поверхности рецептор Fc-фрагмента IgG (GD16). Реакция зависит от присутствия AT, узнающих клетку-мишень и связывающихся с ней. Fc-фрагмент связанных с клеткой-мишенью AT взаимодействует с рецептором Fc-фрагмента, встроенным в плазматическую мембрану NK-клетки. Природа агента, убивающего клетку-мишень в этом случае, неизвестна.Слайд 11 Для выделения мононуклеаров крови наиболее широкое распространение получил
метод дифференциального центрифугирования в градиенте плотности фиколл-верографин (с плотностью
1.077 г/см3). После центрифугирования образуется осадок эритроцитов и гранулоцитов на дне пробирки, над ним находится слой смеси фиколл-верографин, а на границе между этим слоем и верхним слоем плазмы крови располагается тонкий слой (в виде кольца) мононуклеаров крови, которые отличаются от других форменных элементов значительно меньшей плотностью. После отмывания мононуклеаров от смеси фиколл-верографин и от плазмы подсчитывают количество выделенных клеток, среди которых обычно 70—90 % составляют лимфоциты, а на долю моноцитов приходится от 10 до 30 % (примесь гранулоцитов не должна превышать 2 %, жизнеспособность выделенных клеток, по данным теста с трипановым синим, должна быть не ниже 98 %).Слайд 12 Для выделения моноцитов из суммарной фракции мононуклеаров самый
простой и доступный метод основан на избирательной способности моноцитов
(в отличие от большинства лимфоцитов) быстро и прочно прикрепляться к поверхности стекла или пластика. Инкубация смеси моноцитов с лимфоцитами в течение 2—24 ч используется для их разделения на прилипающую (моноциты) и неприлипающую (лимфоциты) фракции.
Слайд 13
Разделение клеток в градиенте плотности
Материалы и оборудование. Для
работы необходимы: центрифуга с охлаждением, бакет-ротор, градиентный смеситель, вещества
для формирования градиента, такие, как альбумин, сыворотка эмбрионов коров, фиколл, лимфопреп, перколл (Pharmacia, Швеция), визотраст или другие рентгеноконтрастные вещества.
Слайд 14
Центрифугирование в градиенте плотности
Ввиду разнообразия применяемых методов фракционирования
клеток в градиенте плотности невозможно в рамках настоящей главы
дать их детальный разбор. В зависимости от биологического вида, органного происхождения, стадии жизненного цикла и активации плотность лимфоцитов, макрофагов, гранулоцитов варьирует в пределах 1,04—1,12 г/мл. Обычно разброс величин плотности составляет около половины этого интервала. Условия центрифугирования подбираются индивидуально в зависимости от характера эксперимента, основные варианты представлены в таблице:
Слайд 16
ступенчатый градиент плотности
Одновременное разделение эозинофилов, нейтрофилов и моноцитов
человека в градиенте фиколл/гипак:
(A) 15,0 мл 9% фиколла + 10,0
мл 50% гипака; плотность 1,14 г/мл.(Б) 17,5 мл 9% фиколла + 10,0 мл 50 гипака; плотность 1,13 г/мл.
(B) 20,0 мл 9% фиколла+10,0 мл 50% гипака; плотность 1,12 г/мл.
(Г) 24,0 мл 9% фиколла + 10,0 мл 50% гипака; плотность 1,06 г/мл.
Слайд 17 Составляют градиент осторожно, наслаивая друг на друга по
2,0 мл растворов уменьшающейся плотности. Сверху наслаивают 2,0 мл
гепаринизированной крови, разведенной в соотношения 1:2 0,15 М NaCl. Центрифугируют 40 минут при 1000 g и 22°С. Клетки распределяются тогда между различными слоями следующим образом: между плазмой и слоем Г — моноциты и лимфоциты с 97—100% чистотой, между Г и В — нейтрофилы с 94—99% чистотой, между В и Б — непрофилы (50—98%) и эозинофилы (2—50%), между Б и А —эозинофилы с 80—99% чистотой.Слайд 18 Разделение гранулоцитов и фракции лимфоциты/моноциты человека в градиенте
фиколл/триомбраст:
(А) 10 объемов 34% триомбраста плотность 1,075 г/мл при
22°С24 объема 9% фиколла (Б) 10 объемов 34% триомбраста плотность 1,097 г/мл при 22°С 24 объема 14,6% фиколла
На градиент, составленный из 5 мл фракции А и 5 мл фракции Б, наслаивают 10 мл разведенной в соотношении 1:2 гепаринизированной крови. Центрифугируют 40 минут при 400 g и 22°С. Легкая фракция содержит лимфоциты (свыше 60%), моноциты (свыше 35%) и гранулоциты (около 1%).
Плотная фракция содержит 98% гранулоцитов, их выход составляет 60%.