- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАДОПОЛНИТЕЛЬНОГО ОБРАЗОВАНИЯ ДЕТЕЙ Мое открытие химии
Содержание
- 2. Обобщение и систематизация знаний по теме "Подгруппа азота"
- 3. На этом занятии мы закрепим и обобщим
- 4. Часть 1. Характеристика элементов главной подгруппы V
- 5. Электронное строение атомов подгруппы У атомов элементов
- 6. Задание 1. Как изменяются неметаллические свойства в
- 7. Подсказка 1Вспомним, чтов главных подгруппах элементов с
- 8. Решение: в подгруппе азота с ростом
- 9. Подсказка 2Чтобы ответить на второй вопросСуществуют ли
- 10. Подсказка 3 1. Основной характер оксидов R2O5 увеличивается,
- 11. Решение: Теперь ответим на второй вопрос задания.
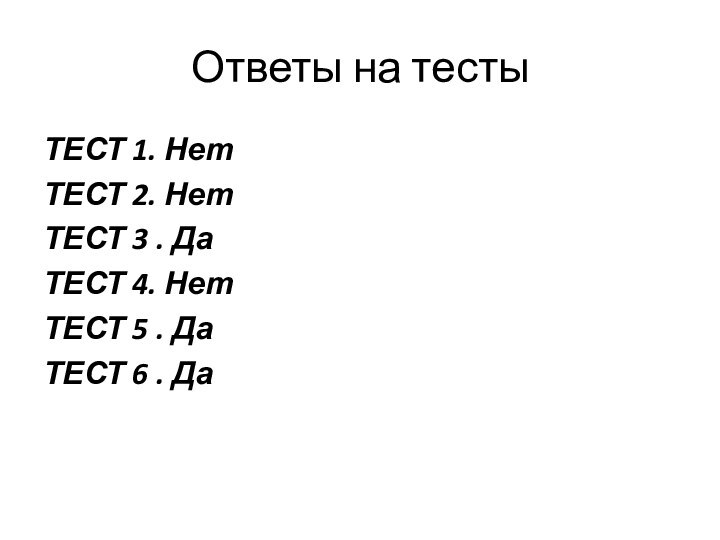
- 12. ТестыТЕСТ 1. В ряду N — P
- 13. Ответы на тестыТЕСТ 1. НетТЕСТ 2. ДаТЕСТ 3 . Нет
- 14. Часть 2. Сравнение свойств простых веществ –
- 15. Простое вещество- азот . Строение атома азота.У
- 16. «Азот» означает «безжизненный» (приставка «а» -
- 17. В жидком состоянии (темп. кипения −195,8 °C) —азот бесцветная,
- 19. Простое вещество- фосфор. СТРОЕНИЕ АТОМА ФОСФОРАР +15)2
- 20. Аллотропия фосфора. Молекулы белого фосфора тетраэдрические, атом
- 21. Задание 2. В этом отрывке из знаменитой
- 22. ПодсказкаБелый фосфор - воскообразное, прозрачное вещество с
- 23. Решение. Белый фосфор – чрезвычайно ядовит. Вспыхивает
- 24. Однако человеку издавна были известны светящиеся организмы
- 25. Задание 3.На рисунке приведена установка для получения
- 26. ПодсказкаВнимательно посмотрим на прибор. Вы видите, что
- 27. Решение. получаемое вещество необходимо охлаждать и собирать
- 28. Задание 4 На основании строения простых веществ
- 29. ПодсказкаВыполняя это задание, следует помнить, что для
- 30. Решение. На примере этих реакций мы видим,
- 31. На основании сравнения окислительных и восстановительных способностей
- 32. Получение азотаФизическое выделение из воздуха.Турбодетандерный агрегат Температура
- 33. Получение фосфораФосфорит Ca3(PO4)2Во 2-й половине 19 века
- 34. ТестыТЕСТ 1. Элемент азот образует много аллотропных
- 35. Ответы на тестыТЕСТ 1. НетТЕСТ 2. НетТЕСТ
- 36. Часть 3. Сравнение свойств основных бинарных соединений азота и фосфора.Образование хлорида аммонияГорение аммиака NH3 в кислороде
- 37. Элементы группы азота образуют с водородом соединения
- 38. Летучие водородные же соединения фосфора и азота.
- 40. Задание 5На основании данных о строении молекул
- 41. Подсказка 1Вспомните, как межмолекулярные взаимодействия влияют на
- 42. Решение: Молекулы аммиака связаны слабыми водородными связями Водородная
- 43. Подсказка 2Чтобы ответить на второй вопросПочему фенолфталеин
- 44. Решение: Атом азота присоединяет протон, образуя ион
- 45. Горение аммиака и фосфина«Блуждающие огни» часто вызывают
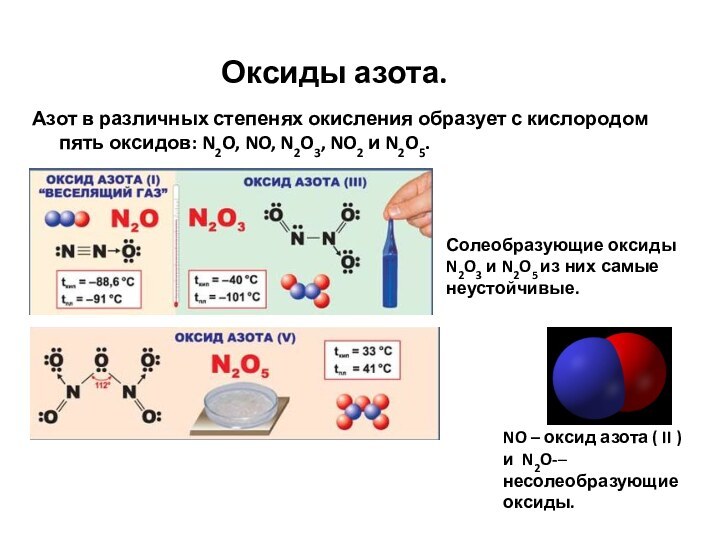
- 46. Оксиды азота.Азот в различных степенях окисления образует
- 47. Оксиды азота.Это бурый ядовитый газ с неприятным
- 48. Получение оксидов азота (II) и (IV). Промышленный
- 49. Получение оксидов азота (II) и (IV). В
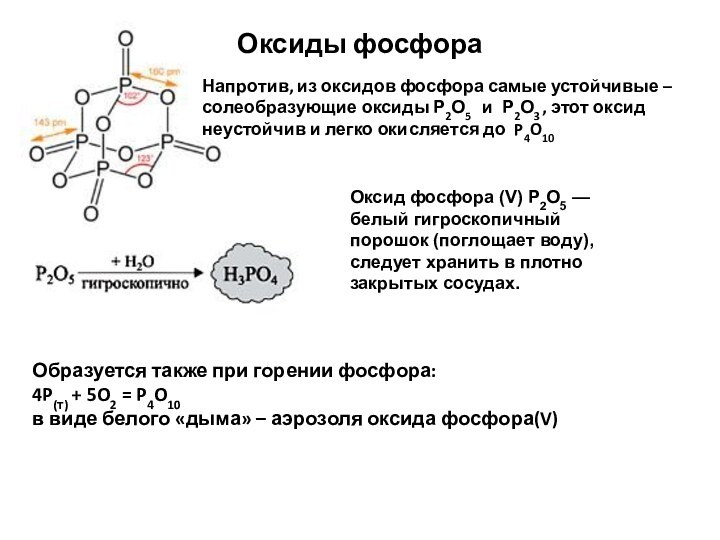
- 50. Оксиды фосфора Оксид фосфора (V) Р2О5
- 52. Задание 6. Докажите, что оксид азота (IV) является веществом с двойственной окислительно-восстановительной функцией.
- 53. ПодсказкаВспомните какие степени окисления характерны для элементов,
- 54. Решение. Азот в NО2 находится в промежуточной степени окисления +4, и может как повышать степень окисления (быть
- 55. ТестыТЕСТ 1 . Оксиды азота состава N2O
- 56. Ответы на тестыТЕСТ 1. НетТЕСТ 2. НетТЕСТ
- 57. Часть 4. Сравнение свойств азотной и фосфорной кислот.
- 58. Важнейшими соединениями азота и фосфора являются азотная
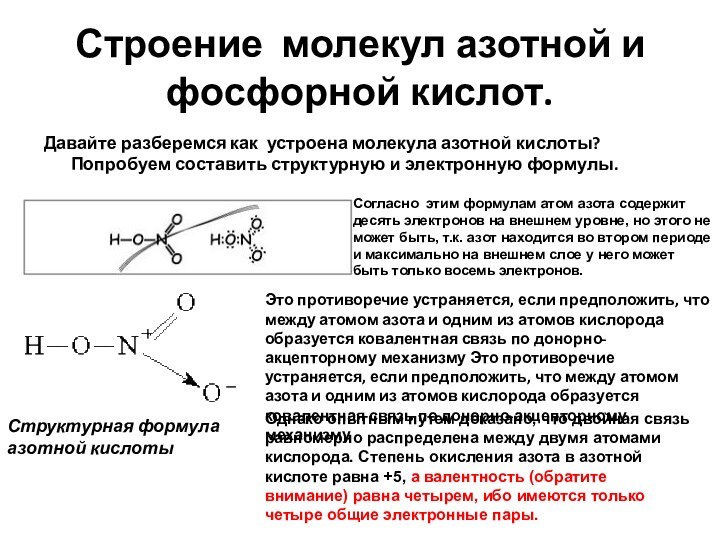
- 59. Строение молекул азотной и фосфорной кислот. Давайте
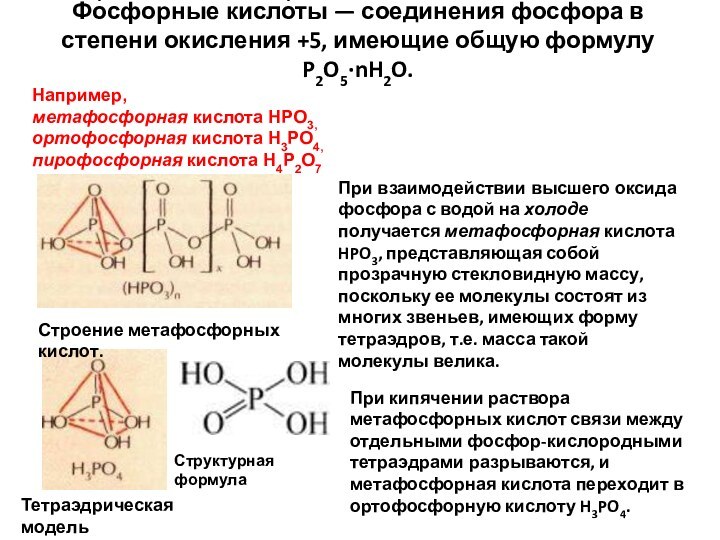
- 60. Фо́сфорные кисло́ты — соединения фосфора в степени окисления
- 61. Различия химических свойств кислот Различия в
- 62. Свойства, характерные для всех кислот. Водный раствор
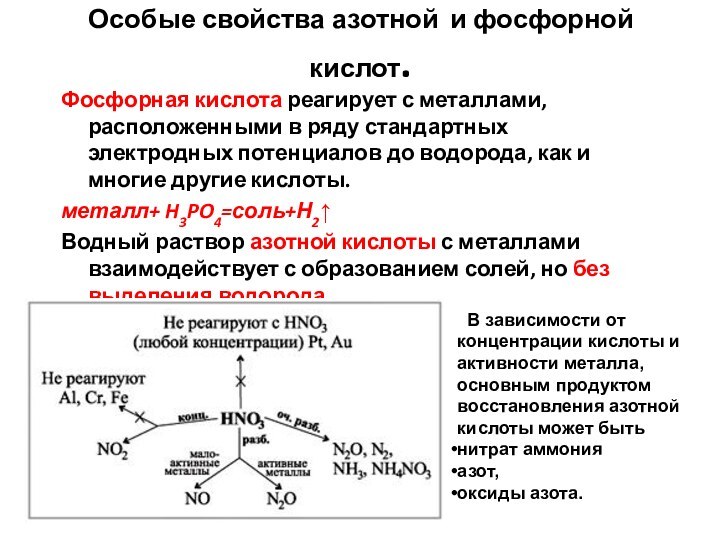
- 63. Особые свойства азотной и фосфорной кислот.Фосфорная кислота
- 64. Взаимодействие азотной кислоты с медью Концентрированная азотная
- 65. Задание 7. В трех пробирках без этикеток находятся концентрированные растворы кислот: Н2SО4, НNО3, H3PO4. Как с помощью одного реактива определить, в какой пробирке какая кислота находит-ся?
- 66. ПодсказкаВспомните специфические свойства концентрированных серной и азотной
- 67. Решение.Данный реактив - малоактивный металл, например, серебро.
- 68. Азотная кислота способна окислять и некоторые неметаллы,
- 69. ТестыТЕСТ 5 . Азотная кислота реагирует с
- 70. Ответы на тестыТЕСТ 1. ДаТЕСТ 2.НетТЕСТ 3. Да ТЕСТ 4.НетТЕСТ 5. Да ТЕСТ 6. Нет
- 71. Часть 5 Соли азотной и фосфорной кислотАпатитКруговорот фосфора в природе.
- 72. Сравнение свойств нитратов и фосфатов. НИТРАТЫ -
- 73. Сравнение химических свойств нитратов и фосфатов. Li→R
- 74. Разложение нитратов.Соли металлов, расположенные в ряду стандартных
- 75. Разложение нитратов.Природные нитраты натрия и калия —
- 76. Биологическая роль фосфатов и нитратов. Растения потребляют
- 77. Удобрения — вещества, применяемые для улучшения питания растений,
- 78. Задание 8. В трех пронумерованных пробирках
- 79. Подсказка 1Все эти соли имеют одинаковый катион-ион
- 80. Решение. Все нитраты хорошо растворимые соли,
- 81. Подсказка 2Как экспериментально доказать, что в состав
- 82. Решение. Качественная реакция на катион
- 84. Часть 6. Составление уравнений реакций по схемам взаимопревращений соединений азота и фосфора
- 85. Задание 9. Составьте уравнения химических реакций, позволяющих осуществить следующие превращения:Р → Р2O5 → Н3РO4 → Са3(РO4)2 → Н3РO4.
- 86. Подсказка Вспомните характерные признаки генетических рядов.Все вещества
- 87. Решение. При сжигании фосфора в избытке кислорода образуется оксид фосфора (V):4Р + 5О2
- 88. Генетический ряд азота. Хотя азотная кислота
- 89. Задание 10. В книге выдающегося писателя-сатирика
- 90. Подсказка В данном случае явно имеется в
- 91. Решение. Реакция получения аммиака.N2 +
- 92. Тесты ТЕСТ 1. Удобрение аммофос является солью азотной
- 93. Ответы на тестыТЕСТ 1. НетТЕСТ 2.НетТЕСТ 3.
- 94. Скачать презентацию
- 95. Похожие презентации














































































Слайд 4 Часть 1. Характеристика элементов главной подгруппы V группы (
подгруппы азота)
В группу входят азот N, фосфор P,
мышьяк As, сурьма Sb и висмут Bi. Все элементы имеют электронную конфигурацию внешнего энергетического уровня атома ns²np³
Химия этих элементов очень разнообразна и, учитывая различия в свойствах элементов, при изучении её разбивают на две подгруппы — подгруппу азота и подгруппу мышьяка.
Наличие трех неспаренных электронов на внешнем энергетическом уровне объясняет то, что в нормальном, невозбужденном состоянии валентность элементов подгруппы азота равна трем.
Слайд 5
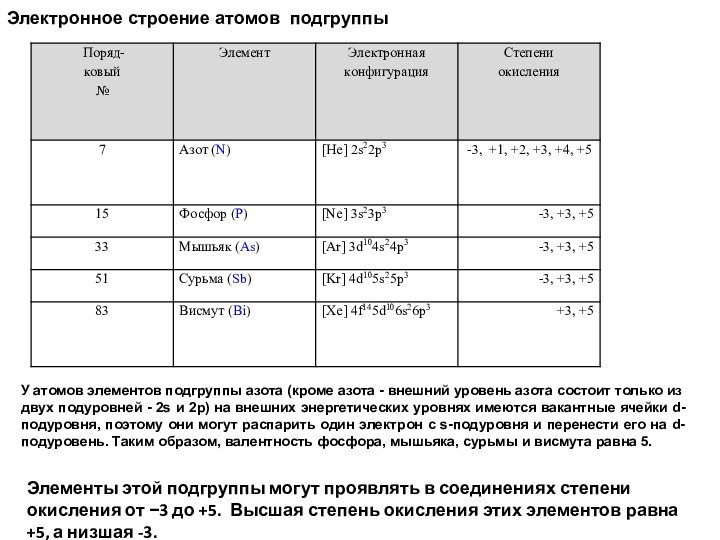
Электронное строение атомов подгруппы
У атомов элементов подгруппы
азота (кроме азота - внешний уровень азота состоит только
из двух подуровней - 2s и 2p) на внешних энергетических уровнях имеются вакантные ячейки d-подуровня, поэтому они могут распарить один электрон с s-подуровня и перенести его на d-подуровень. Таким образом, валентность фосфора, мышьяка, сурьмы и висмута равна 5.Элементы этой подгруппы могут проявлять в соединениях степени окисления от −3 до +5. Высшая степень окисления этих элементов равна +5, а низшая -3.
Слайд 6
Задание 1.
Как изменяются неметаллические свойства в ряду N
— P — As — Sb — Bi: Ответ
обоснуйте , исходя из знаний о полюжении элемента в Периодической системе.Существуют ли закономерности в изменении свойств высших оксидов и летучих водородных соединений этих элементов?
Слайд 7
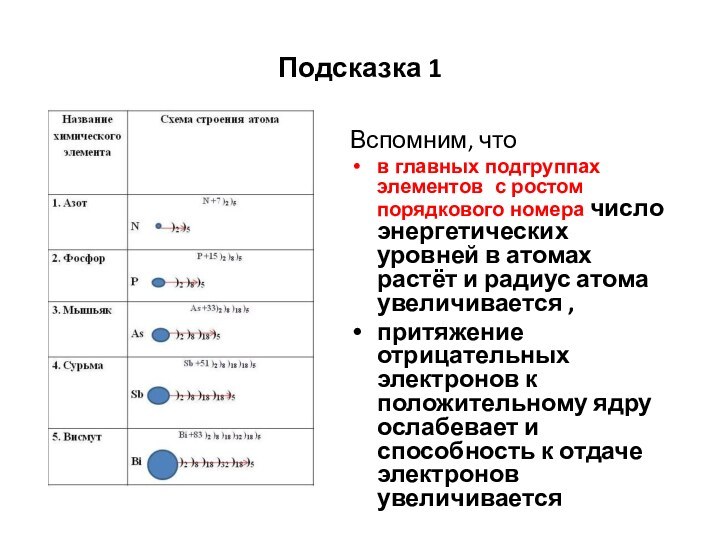
Подсказка 1
Вспомним, что
в главных подгруппах элементов с ростом
порядкового номера число энергетических уровней в атомах растёт и
радиус атома увеличивается ,притяжение отрицательных электронов к положительному ядру ослабевает и способность к отдаче электронов увеличивается
Слайд 8
Решение:
в подгруппе азота с ростом порядкового номера
неметаллические свойства убывают, а металлические усиливаются.
N, P -
типичные неметаллы. Простое вещество As представляет собой хрупкий полуметалл стального цвета. Сурьма — металл серебристо-белого цвета с синеватым оттенком,. Число сплавов, в которые входит сурьма, близко к двумстам. Висмут- тяжёлый серебристо-белый металл с розоватым оттенком. Наряду со свинцом и оловом входит в состав большинства легкоплавких припоев и сплавов.Таким образом, в данной группе резко изменяются свойства составляющих её элементов: от типичного неметалла до типичного металла
Слайд 9
Подсказка 2
Чтобы ответить на второй вопрос
Существуют ли закономерности
в изменении свойств высших оксидов и летучих водородных соединений
этих элементов?необходимо вспомнить чем отличаются свойства оксидов металлов и неметаллов, и характерны ли летучие водородные соединения для металлов.
Слайд 10
Подсказка 3
1. Основной характер оксидов R2O5 увеличивается, а
кислотный – ослабевает с увеличением порядкового номера.
2. Гидроксиды всех
элементов в пятивалентном состоянии имеют кислотный характер.3. Основной характер гидроксидов R(OH)3 увеличивается, а кислотный – ослабевает с увеличением порядкого номера.
4. Восстановительные свойства водородных соединений RH3 усиливаются, а устойчивость уменьшается с увеличением порядкого номера.
Слайд 11
Решение:
Теперь ответим на второй вопрос задания.
Как известно,
неметаллам соответствует кислотный характер оксидов, а металлам – основный.
Поэтому основный характер высших оксидов состава R2O5 увеличивается, а кислотный – ослабевает с увеличением порядкового номера.
А вот гидроксиды всех элементов в пятивалентном состоянии имеют кислотный характер, правда устойчивость их падает – такие кислоты для металлов неустойчивы. .
Основной характер гидроксидов R(OH)3 увеличивается, а кислотный – ослабевает с увеличением порядкого номера.
Поскольку металлы не образуют летучих водородных соединений от азота к сурьме прочность таких соединений состава RH3 уменьшается, Восстановительные свойства водородных соединений RH3 усиливаются с увеличением порядкого номера, что связано с падением ЭО элементов в этом ряду..
Слайд 12
Тесты
ТЕСТ 1. В ряду N — P —
As — Sb — Bi неметаллические свойства увеличиваются.
1. Нет
2. Да
ТЕСТ 2. Все элементы главной подгруппы V группы проявляют в соединениях высшую степень окисления +5
1.Да.
2.Нет.
ТЕСТ 3 . Валентность азота в ионе аммония равна 3.
1. Да
2. Нет
Слайд 14 Часть 2. Сравнение свойств простых веществ – азота и
фосфора и способов их получения.
свечение азота в высокочастотном
разрядежидкий азот
Открытие фосфора изображено на картине английского художника Дж. Райта («Райт из Дерби»)
Слайд 15
Простое вещество- азот .
Строение атома азота.
У атома азота
5 электронов на внешнем уровне. Три неспаренных электрона на
2р-орбитали, способные к образованию трех связей, прежде всего, ответственны за трехковалентность азота.Азот образует единственное простое молекулярное вещество N2 с тройной связью двухатомной в молекуле .
Связь в молекуле N2 – ковалентная неполярная тройная
Энергия этой связи равна 942 кДж/моль, что превышает значения других энергий связи . Этим объясняется инертность азота при обычных температурах.
По физическим характеристикам азот – бесцветный газ без запаха, хорошо знакомый нам с рождения (земная атмосфера на три четверти состоит из азота). В воде азот малорастворим.
Слайд 16 «Азот» означает «безжизненный» (приставка «а» - отрицание.
«зоэ» - жизнь).
Азот не поддерживает горения и дыхания.
Хотя
название “азот" означает “не поддерживающий жизни", на самом деле это - необходимый для жизнедеятельности элемент. Слайд 17 В жидком состоянии (темп. кипения −195,8 °C) —азот бесцветная, подвижная,
как вода, жидкость.
Теплота испарения жидкого азота невелика, хотя и
в 50 раз больше, чем у жидкого гелия. Поэтому жидкий гелий вообще невозможно налить в обычный стакан - при такой операции он непременно испарится. С жидким азотом такую операцию провести можно, но значительная его часть испарится, охлаждая сосуд, а оставшаяся жидкость выкипит довольно быстро.Криоаге́нт(от греч. κρύος — холод, мороз) — вещество, использующееся в качестве рабочего тела в системах , предназначенных для заморозки веществ и продуктов.
Криоагенты имеют температуру кипения ниже −120˚C. В качестве криоагента используются, как правило, чистые газы: гелий, азот.
Слайд 19
Простое вещество- фосфор.
СТРОЕНИЕ АТОМА ФОСФОРА
Р +15)2 )8 )5
(Ne)3s23p33 d0
Валентные возможности фосфора шире, чем у атома азота,
так как в атоме фосфора имеются свободные d-орбитали. Поэтому элемент фосфор образует довольно много аллотропных модификаций. Из них наиболее устойчивы три модификации: белый фосфор, красный фосфор и черный фосфор.
Белый фосфор – воскообразное ядовитое склонное к самовозгоранию на воздухе вещество, состоящее из молекул P4
Существует 11 аллотропных модификаций фосфора: белый, красный, черный, фиолетовый, коричневый и светло – красный фосфор. В зависимости от условий аллотропные модификации переходят одна в другую. Наиболее химически активен белый фосфор.
Слайд 20
Аллотропия фосфора.
Молекулы белого фосфора тетраэдрические, атом фосфора в
них трехвалентен.
Красный фосфор – немолекулярное менее активное вещество
темно-красного цвета с довольно сложным строением. Черный фосфор – также немолекулярное вещество со сложным каркасным строением. Закрепим представления об аллотропии фосфора, выполнив несколько заданий.
Слайд 21
Задание 2.
В этом отрывке из знаменитой «Собаки
Баскервилей» А. Конан-Дойл допустил существенную химическую ошибку. Назовите ее.
Слайд 22
Подсказка
Белый фосфор - воскообразное, прозрачное вещество с характерным
чесночным запахом.
Вспомните о каких еще свойствах фосфора Вы знаете.
Слайд 23
Решение.
Белый фосфор – чрезвычайно ядовит. Вспыхивает на воздухе.
Хотя герои . Конан-Дойла , в частности знаменитый сыщик
Шерлок Холмс интересуются химией, в этом знаменитом описании собаки Баскервилей допущена ошибка_ писатель перепутал фосфор и фосфорецирующие вещества ( действительно в этих словах два одинаковых греческих корня- фос и фор – фосфор светоносец, фосфоресцирующий- дающий свет). Из всех аллотропных модификаций фосфора только белый фосфор обладает уникальной способностью светиться в темноте за счёт медленного окисления до низших оксидов. Белый фосфор - воскообразное, прозрачное вещество , т.е.его можно было бы нанести на шерсть собаки в виде пасты,однако вдобавок он чрезвычайно ядовит, может попасть в организм через органы дыхания и пищеварения, а также через повреждения кожи, Белый фосфор не только является сильным ядом, при попадании на кожу вызывает долго не заживающие ожоги. поэтому животное намазанное белым фосфором было бы обречено на быструю и мучительную смерть. Кроме того. фосфор белый воспламеняется на воздухе, а красный - при поджигании, в обоих случаях образуется оксид фосфора (V), выделяющийся в виде густого белого дыма.
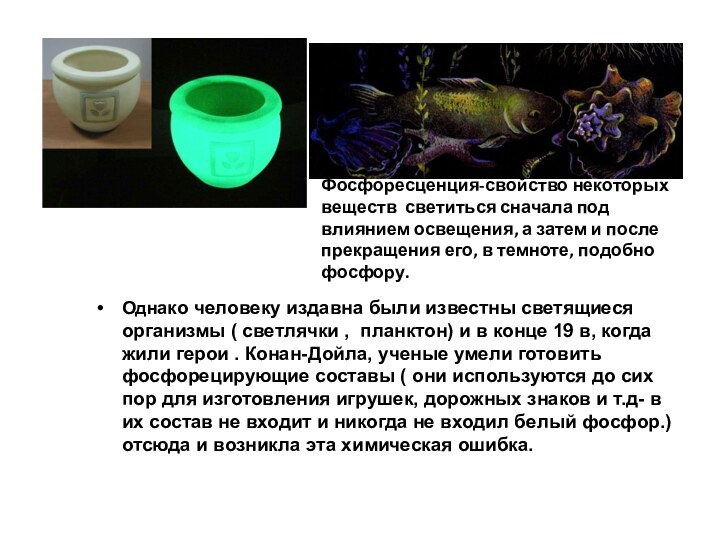
Слайд 24 Однако человеку издавна были известны светящиеся организмы (
светлячки , планктон) и в конце 19 в, когда
жили герои . Конан-Дойла, ученые умели готовить фосфорецирующие составы ( они используются до сих пор для изготовления игрушек, дорожных знаков и т.д- в их состав не входит и никогда не входил белый фосфор.) отсюда и возникла эта химическая ошибка.Фосфоресценция-свойство некоторых веществ светиться сначала под влиянием освещения, а затем и после прекращения его, в темноте, подобно фосфору.
Слайд 25
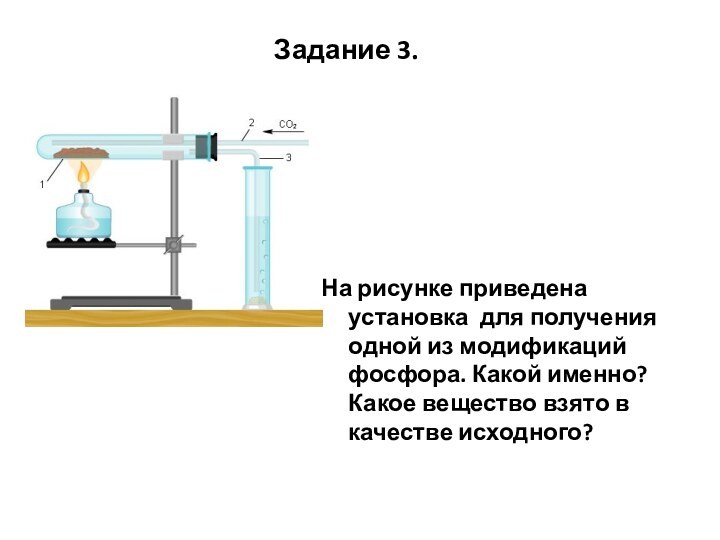
Задание 3.
На рисунке приведена установка для получения одной
из модификаций фосфора. Какой именно? Какое вещество взято в
качестве исходного?
Слайд 26
Подсказка
Внимательно посмотрим на прибор. Вы видите, что он
состоит из следующих частей:
пробирки-реактора 1, вещество, в котором нагревается
спиртовкой, трубки 2, по которой в пробирку-реактор поступает углекислый газ,
газоотводной трубки 3, по которой выходят пары получаемого вещества из пробирки и охлаждаются водой в цилиндре - приемнике.
Можно ли сделать вывод о химической активности получаемого вещества?
Слайд 27
Решение.
получаемое вещество необходимо охлаждать и собирать под водой,
т.е. оно химически активно и его пары могут вспыхнуть
на воздухе, кроме того для получения этого вещества необходимо несильное нагревание без доступа воздуха (он вытесняется углекислым газом)-известна лищь одна химически чрезвычайно активная модификация фосфора- это белый фосфор. Его получают нагреванием красного фосфора. В ходе этого опыта происходит испарение красного фосфора Px, переход его в газовой фазе в четырехатомные молекулы белого фосфора P4. и осаждение капелек белого фосфора на холодных частях пробирки. Газоотводную трубку при нагревании пробирки опускают в цилиндр с холодной водой, где также появляются шарики белого фосфора. Если поместить сзади пробирки темный экран, то можно наблюдать свечение белого фосфора, оставшегося на стенках пробирки .
Слайд 28
Задание 4
На основании строения простых веществ сравните реакционную
способность азота и фосфора, рассмотрите их характерные химические свойства.
Какова
химическая активность фосфора в сравнении с азотом? Почему?
Слайд 29
Подсказка
Выполняя это задание, следует помнить, что для фосфора,
в отличие от азота характерен целый ряд различных аллотропных
модификаций. Белый фосфор в целом реакционно способнее красного фосфора .Однако можно выделить некоторые общие и различные реакции для фосфора и азота, вспомнив химические свойства неметаллов.
Слайд 30
Решение.
На примере этих реакций мы видим, что восстановительная
способность фосфора выше, чем у азота, т.к число энергетических
уровней у него больше , фосфор окисляется кислородом до степени окисления +5, причем для белого фосфора возгорание фосфора может происходить самопроизвольно,а азот в достаточно жестких условиях окисляется только до +2. Соответственно окислительная способность азота должна быть выше, чем у фосфора - он должен реагировать с металлами легче, чем фосфор. Однако, этого не наблюдается. Вы знаете , что непосредственно без нагревания азот реагирует только с литием и магниемобщие реакции.
1.Взаимодействие с кислородом ( восстановительные свойства азота и фосфора)
2. Взаимодействие с щелочными и щелочноземельными металлами окислительные свойства азота и фосфора
2.Взаимодействие с водородом
Слайд 31 На основании сравнения окислительных и восстановительных способностей неметаллов
нельзя делать однозначный вывод о их химической активности. Очень
важно строение вещества.Вспомним,как устроена молекула азота
Связь в этой молекуле тройная- очень прочная и поэтому простое вещество азот никак нельзя отнести к химически активным, с галогенами азот в отличие от фосфора не реагирует. А вот с водородом в специально подобранных условиях азот вступает в реакцию, проявляя в этой реакции свои окислительные свойства. У фосфора окислительная способность значительно ниже и в реакцию с водородом он вступить не может. Однако для фосфора характерны реакции, в которых он проявляет свои восстановительные свойства, например.реакция с азотной кислотой.. Таким образом сделаем заключение об окислительно-восстановительной двойственности свойств.
Слайд 32
Получение азота
Физическое выделение из воздуха.
Турбодетандерный агрегат
Температура кипения
азота немного ниже (-195,8°C), чем другого компонента воздуха -
кислорода (-182,9°C), поэтому при осторожном нагревании жидкого воздуха азот испаряется первым.Получение азота в лаборатории
Разложение солей.
при нагревании насыщенного раствора хлорида аммония и твердого нитрита натрия:
(t)
NaN+3O2 + N-3H4Cl = NaCl + N02 + 2H2O.
Ещё один лабораторный способ получения азота — нагревание дихромата аммония
(N -3H4)2Cr +62O7 → Cr +32O3 + N 02↑ + 4H2O
Слайд 33
Получение фосфора
Фосфорит Ca3(PO4)2
Во 2-й половине 19 века возникло
промышленное производство фосфора из фосфоритов в ретортных печах; в
начале 20 века они были заменены электрическими печами.2Ca3(P+5O4)2 + 10C0 + 6SiO2 → P04 + 10C+2O + 6CaSiO3.
P+5 + 5е = P0 2 4
C0 - 2е = C+2 5 10
Слайд 34
Тесты
ТЕСТ 1. Элемент азот образует много аллотропных модификаций.
1.Нет
2.Да
ТЕСТ 2. Простое вещество – азот поддерживает горение, пригоден
для дыхания 1. Да
2. Нет
ТЕСТ 3. Реакция 6Li + N2 → 2Li3N является окислительно-восстановительной
1. Да
2. Нет
ТЕСТ 4.
Простое вещество фосфор плохо реагирует с сильными окислителями
1.Нет.
2. Да
ТЕСТ 5 . В промышленности азот получают из воздуха.
1 Да.
2. Нет
ТЕСТ 6 . Вещество азот- химически малоактивно.
1.Нет
2. Да
Слайд 36 Часть 3. Сравнение свойств основных бинарных соединений азота и
фосфора.
Образование хлорида аммония
Горение аммиака NH3 в кислороде
Слайд 37
Элементы группы азота образуют
с водородом соединения состава
RH3,
с кислородом оксиды вида - R2O3 и R2O5.
Оксидам соответствуют кислоты HRO2 и HRO3 (и ортокислоты H3PO4, кроме азота).
Важнейшие соединения.
Оксиды фосфора более устойчивы, чем оксиды азота. Водородные же соединения менее стабильны.
Азот проявляет большое разнообразие степеней окисления: -3, -2, -1, 0, +1, +2, +3, +4 и +5.
Наивысшая степень окисления, которую может проявлять фосфор, равна +5. Соединения, содержащие фосфор в степени окисления меньшей, чем +5 проявляют себя как восстановители.
Слайд 38
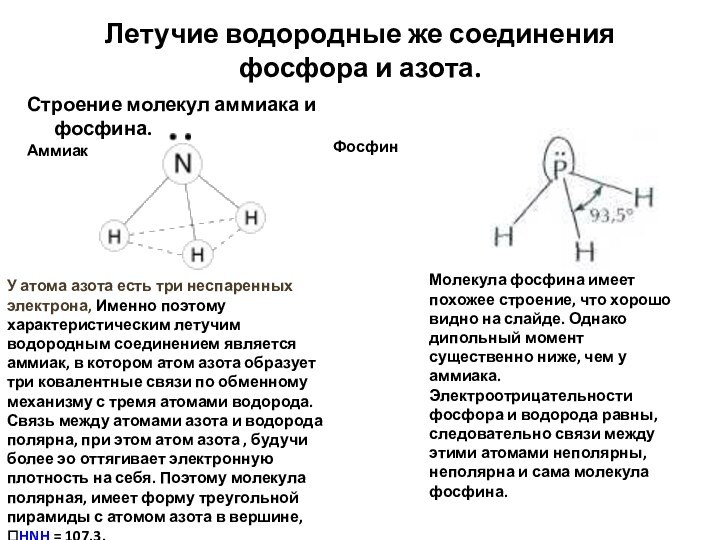
Летучие водородные же соединения фосфора и азота.
Строение молекул
аммиака и фосфина.
Аммиак
Фосфин
У атома азота есть три неспаренных электрона, Именно поэтому характеристическим летучим водородным соединением является аммиак, в котором атом азота образует три ковалентные связи по обменному механизму с тремя атомами водорода. Связь между атомами азота и водорода полярна, при этом атом азота , будучи более эо оттягивает электронную плотность на себя. Поэтому молекула полярная, имеет форму треугольной пирамиды с атомом азота в вершине,
HNH = 107,3.
Молекула фосфина имеет похожее строение, что хорошо видно на слайде. Однако дипольный момент существенно ниже, чем у аммиака. Электроотрицательности фосфора и водорода равны, следовательно связи между этими атомами неполярны, неполярна и сама молекула фосфина.
Слайд 40
Задание 5
На основании данных о строении молекул аммиака
и фосфина объясните:
Более низкие температуры плавления и кипения фосфина
по сравнению с аммиаком.Почему фенолфталеин окрашивает раствор аммиака в малиновый цвет, а растворы фосфина при добавлении индикаторов не меняют цвет
Слайд 41
Подсказка 1
Вспомните, как межмолекулярные взаимодействия влияют на температуры
плавления и кипения веществ.
Какого типа связи могут возникнуть между
полярными молекулами аммиака?
Слайд 42
Решение:
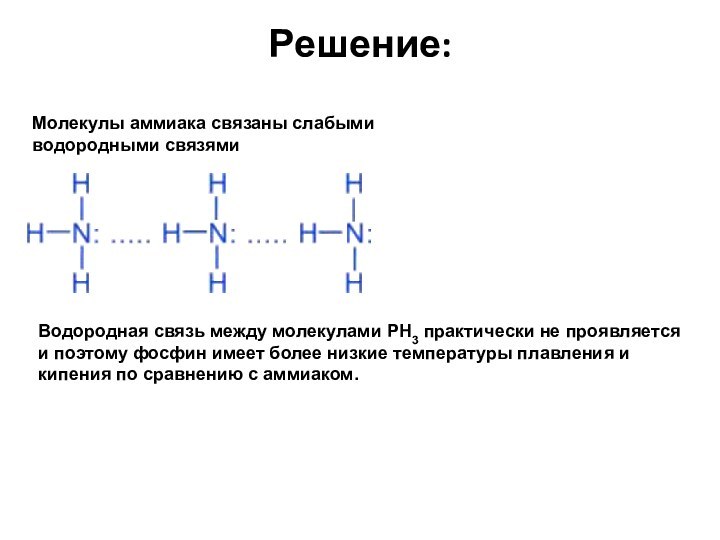
Молекулы аммиака связаны слабыми водородными связями
Водородная связь между
молекулами PH3 практически не проявляется и поэтому фосфин имеет
более низкие температуры плавления и кипения по сравнению с аммиаком.
Слайд 43
Подсказка 2
Чтобы ответить на второй вопрос
Почему фенолфталеин окрашивает
раствор аммиака в малиновый цвет, а растворы фосфина при
добавлении индикаторов не меняют цвет ?вспомним
в какой среде фенолфталеин меняет цвет на малиновый?
может ли молекула аммиака образовывать связи по донорно-акцепторному механизму ?
Что происходит при взаимодействии молекулы аммиака с молекулой воды?
Слайд 44
Решение:
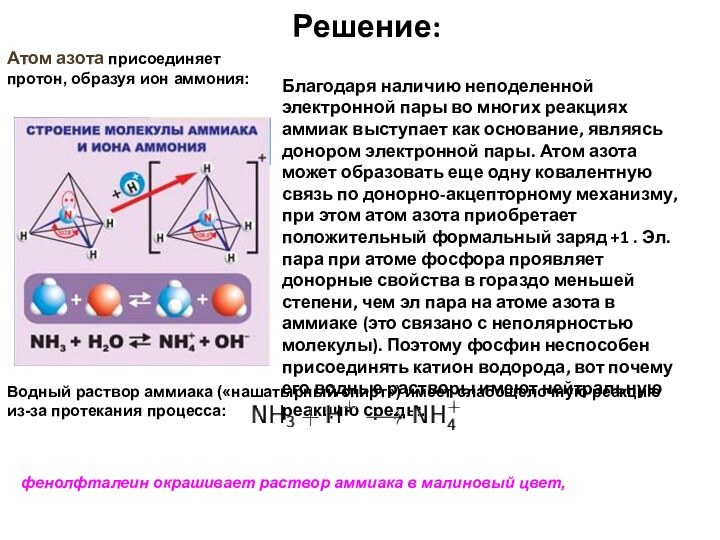
Атом азота присоединяет протон, образуя ион аммония:
Благодаря
наличию неподеленной электронной пары во многих реакциях аммиак выступает
как основание, являясь донором электронной пары. Атом азота может образовать еще одну ковалентную связь по донорно-акцепторному механизму, при этом атом азота приобретает положительный формальный заряд +1 . Эл. пара при атоме фосфора проявляет донорные свойства в гораздо меньшей степени, чем эл пара на атоме азота в аммиаке (это связано с неполярностью молекулы). Поэтому фосфин неспособен присоединять катион водорода, вот почему его водные растворы имеют нейтральную реакцию среды.Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
фенолфталеин окрашивает раствор аммиака в малиновый цвет,
Слайд 45
Горение аммиака и фосфина
«Блуждающие огни» часто вызывают суеверный
страх.
PH3 + 2O2 = H3PO4
Газообразный фосфин легко горит в
кислороде воздуха.
Подобного рода процессы происходят и в природе, являясь причиной появления так называемых «блуждающих огней» на кладбищах. Вспышки фосфина днем, конечно, не бывают видны, но ночью они вызывают суеверный страх у многих людей, которые незнакомы с научным объяснением этого явления.4NH3 + 3О2 = 2N2+ 6Н2О;
Аммиак - активный восстановитель. Такое свойство у него за счёт атомов азота, имеющих степень окисления "-3".
Восстановительные свойства азота наблюдаются при горении аммиака , Аммиак на воздухе не горит. Но в чистом кислороде он сгорает бледно-желтым пламенем, окисляясь до азота, так как для азота наиболее устойчивая степень окисления – 0 ( фото справа)
Если в реакции горения использовать катализаторы (платину Pt и оксид хрома Cr2O3), то получают оксид азота. Эта реакция лежит в основе красивого демонстрационного опыта ( слева ).
4NH3 + 5 O2 -> 4NO + 6H2O
Слайд 46
Оксиды азота.
Азот в различных степенях окисления образует с
кислородом пять оксидов: N2O, NO, N2O3, NO2 и N2O5.
NO
– оксид азота ( II ) и N2O-– несолеобразующие оксиды. Солеобразующие оксиды N2O3 и N2O5 из них самые неустойчивые.
Слайд 47
Оксиды азота.
Это бурый ядовитый газ с неприятным запахом.
С раствором щелочи реакция идет с образованием нитрата и
нитрита. Отметим, что оксид азота(IV) имеет и характерный резкий запах, и рыжевато-бурый цвет, оттенки которого отличаются друг от друга в зависимости от концентрации. Именно за этот цвет выбросы оксидов азота в атмосферу называют «лисьими хвостами».
Растворимость оксида азота(IV) можно считать неограниченной (вплоть до образования 60%-й HNO3).
2NO2 + Н2O = НNО3 + НNO2
Всего два из них — оксид азота(II) и оксид азота(IV) — не только устойчивы при обычных условиях, но и активно задействованы в природном и промышленном круговоротах азота
2N+4O2 + 2NaOH = NaN+5O3 + NaN+3O2 + H2O.
Слайд 48
Получение оксидов азота (II) и (IV).
Промышленный способ основан
на окислении аммиака при высокой температуре и давлении при
участии Pt, Cr2O3 (как катализаторов).4NH3 + 5 O2 -> 4NO + 6H2O
Получение NO и NO2 является одной из стадий получения азотной кислоты. NO2 используется в качестве окислителя в жидком ракетном топливе и смешанных взрывчатых веществах.
Установка для получения оксидов азота для производства азотной кислоты
Оксид азота (II) — единственный из оксидов азота, который можно получить непосредственно из атмосферного азота соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах :и тотчас же реагирует с кислородом:
Слайд 49
Получение оксидов азота (II) и (IV).
В лаборатории оксид азота
(II) обычно получают взаимодействием 30%-ной HNO3 ,с некоторыми металлами,
например, с медью(такую кислоту обычно получают добавлением равного объема воды к концентрированной азотной кислоте, поэтому часто говорят о такой кислоте как разбавленной в отношении 1:1): если кислоту взять более концентрированную , по той же реакции можно получить диоксид азота.3Cu0 + 8HN+5O3(разб.)
3Cu+2 (N+5O3 )2+ 2N+2O+ 4H2O
Реакция меди с концентрированной азотной кислотой протекает с выделением оксида азота (IV).
Cu0 + 4HN+5O3(конц.) = Cu+2 N+5O3 + 2N+4O 2+ 2H2O
Слайд 50
Оксиды фосфора
Оксид фосфора (V) Р2О5 — белый
гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых
сосудах.Образуется также при горении фосфора:
4P(т) + 5O2 = P4O10
в виде белого «дыма» – аэрозоля оксида фосфора(V)
Напротив, из оксидов фосфора самые устойчивые – солеобразующие оксиды Р2О5 и Р2О3 , этот оксид неустойчив и легко окисляется до P4O10
Слайд 52
Задание 6.
Докажите, что оксид азота (IV) является веществом с двойственной
окислительно-восстановительной функцией.
Слайд 53
Подсказка
Вспомните какие степени окисления характерны для элементов, входящих
в состав веществ-окислителей, и какие для элементов «восстановителей».
Какова степень
окисления азота в оксиде азота (IV) ? Как он будет реагировать с сильными окислителями ( например, с кислородом ) и восстановителями при нагревании или в водном растворе?
Слайд 54
Решение.
Азот в NО2 находится в промежуточной степени окисления +4, и может как повышать степень окисления (быть восстановителем), так и понижать ее
(быть окислителем).
Для NО2 наиболее характерны окислительные свойства, которые проявляются в газовой фазе при нагревании:
2NO2 + C = СO2 + 2NО
или в водном растворе:
SО2
+ NО2 + Н2О = Н2SО4 + NO.Восстановительные свойства NО2 проявляет в реакции с кислородом:
4NО2 + О2 + 2Н2О = 4НNО3.
Слайд 55
Тесты
ТЕСТ 1 . Оксиды азота состава N2O и
NO относятся к кислотным оксидам.
1. Да
2. Нет
ТЕСТ
2 . Оксиды азота (II) и (IV) реагируют только как восстановители..1. Нет
2. Да
ТЕСТ 3. При горении фосфора образуется высший оксид фосфора состава Р2О5.
1. Да
2. Нет
ТЕСТ 4. Катион аммония NH4+ образуется в результате взаимодействия аммиака и катиона водорода по донорно-акиепторному механизму.
1. Да
2. Нет
ТЕСТ 5. Аммиак в реакциях с кислородом проявляет свойства окислителя.
1.Нет
2. Да
ТЕСТ 6. Оксид азота (II) выделяется при действии концентрированной азотной кислоты (1:1) на медь .
1. Нет
2. Да
Слайд 58 Важнейшими соединениями азота и фосфора являются азотная и
ортофосфорная кислоты.
Азотная кислота — бесцветная жидкость, с резким
запахом, которая «дымится» на воздухе.Ортофосфорная кислота — бесцветное твердое вещество с температурой плавления около 42 °С, очень гигроскопичное (легко поглощает влагу из воздуха).
При хранении на свету концентрированная азотная кислота желтеет, так как частично разлагается с образованием бурого газа – диоксида азота NО2.
Растворимость азотной кислоты.неограниченная
85 % водный раствор - бесцветная сиропообразная жидкость
Расплавленная ортофосфорная кислота и ее концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
Слайд 59
Строение молекул азотной и фосфорной кислот.
Давайте разберемся
как устроена молекула азотной кислоты? Попробуем составить структурную и
электронную формулы.Согласно этим формулам атом азота содержит десять электронов на внешнем уровне, но этого не может быть, т.к. азот находится во втором периоде и максимально на внешнем слое у него может быть только восемь электронов.
Это противоречие устраняется, если предположить, что между атомом азота и одним из атомов кислорода образуется ковалентная связь по донорно-акцепторному механизму Это противоречие устраняется, если предположить, что между атомом азота и одним из атомов кислорода образуется ковалентная связь по донорно-акцепторному механизму
Структурная формула азотной кислоты
Однако опытным путем доказано, что двойная связь равномерно распределена между двумя атомами кислорода. Степень окисления азота в азотной кислоте равна +5, а валентность (обратите внимание) равна четырем, ибо имеются только четыре общие электронные пары.
Слайд 60 Фо́сфорные кисло́ты — соединения фосфора в степени окисления +5,
имеющие общую формулу P2O5·nH2O.
Например,
метафосфорная кислота НРО3,
ортофосфорная кислота H3PO4,
пирофосфорная
кислота H4P2O7Тетраэдрическая модель
Структурная формула
При взаимодействии высшего оксида фосфора с водой на холоде получается метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу, поскольку ее молекулы состоят из многих звеньев, имеющих форму тетраэдров, т.е. масса такой молекулы велика.
При кипячении раствора метафосфорных кислот связи между отдельными фосфор-кислородными тетраэдрами разрываются, и метафосфорная кислота переходит в ортофосфорную кислоту H3PO4.
Строение метафосфорных кислот.
Слайд 61 Различия химических свойств кислот Различия в строении молекул кислот
определяют различие их свойств.
Азотная кислота — сильная: в водном
растворе она полностью распадается на ионы.
HNO3 ⇄ H+ + NO3- Ортофосфорная кислота является трёхосновной кислотой, средней силы по первой ступени и слабой по второй и третьей.
Ортофосфорная кислота диссоциирует ступенчато:
H3PO4 ↔ H+ + H2PO4- (дигидроортофосфат-ион)
H2PO4- ↔ H+ + HPO42- (гидроортофосфат-ион)
HPO42- ↔ H+ + PO43- (ортофосфат-ион)
Азотная кислота и ее растворы – сильные окислители.
Слайд 62
Свойства, характерные для всех кислот.
Водный раствор кислоты изменяет
окраску индикаторов на красный
Основные и амфотерные оксиды и гидроксиды
взаимодействуют с водными растворами азотной и фосфорной кислот с образованием солей и воды.Реакции с основными оксидами.
CaO + 2HNO3 = Ca(NO3)2 + H2O
Реакции с основаниями и амфотерными гидроксидами.
Sr(OH)2 + 2HNO3 = Sr(NO3)2 + 2H2O
H3PO4(изб) + NaOH = NaH2PO4 + H2O или
H3PO4(изб) + 2NaOH = Na2HPO4 + 2H2O
Реакции с солями слабых кислот.
K2CO3 + 2HNO3 = 2KNO3 + CO2↑ + H2O
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3↓
2H3PO4+3Na2CO3 = 2Na3PO4 + 3H2O + 3CO2↑
2H3PO4+3Na2SiO3 = 2Na3PO4 + 3H2 SiO3
Азотная кислота взаимодействует с некоторыми солями, если в ходе реакции выделяется газ или выпадает осадок ( впрочем , поскольку все нитраты растворимы, к последним можно отнести только реакцию с растворимыми силикатами.В нормальных условиях ортофосфорная кислота, как и все остальные кислоты реагирует с карбонатами с выделением углекислого газа, При нагревании до температуры свыше 80°С реагирует с силикатами c выпадением осадка кремниевой кислоты..
Именно за счет образующихся катионов водорода водные растворы азотной кислоты окрашивают индикаторы лакмус, метилоранж и универсальный в красный цвет. , реагируют с карбонатами с выделением углекислого газа,
Слайд 63
Особые свойства азотной и фосфорной кислот.
Фосфорная кислота реагирует
с металлами, расположенными в ряду стандартных электродных потенциалов до
водорода, как и многие другие кислоты.металл+ H3PO4=соль+Н2↑
Водный раствор азотной кислоты с металлами взаимодействует с образованием солей, но без выделения водорода.
В зависимости от концентрации кислоты и активности металла, основным продуктом восстановления азотной кислоты может быть
нитрат аммония
азот,
оксиды азота.
Слайд 64
Взаимодействие азотной кислоты с медью
Концентрированная азотная кислота
восстанавливается до оксида азота(IV):
Cu0+4HN+5O3 (конц.)=Cu+2(NO3) 2+2N+4O2↑ +2H2O
Железо и
алюминий при действии концентрированной HN03 покрывается прочной оксидной пленкой, предохраняющей металл от дальнейшего окисления, т. е. кислота пассивирует их. Азотную кислоту можно хранить и перевозить в цистернах и других емкостях из железа и алюминия.
Продукт восстановления зависит
от положения металла в ряду напряжений,
от концентрации кислоты
условий проведения реакции.
Слайд 65
Задание 7.
В трех пробирках без этикеток находятся концентрированные растворы кислот: Н2SО4, НNО3, H3PO4.
Как с помощью
одного реактива определить, в какой пробирке какая кислота находит-ся?
Слайд 66
Подсказка
Вспомните специфические свойства концентрированных серной и азотной кислот.
Эти кислоты сильные окислители и этим отличаются от фосфорной
кислоты.
Слайд 67
Решение.
Данный реактив - малоактивный металл, например, серебро.
Концентрированная
азотная кислота растворяет серебро с выделением бурого газа:
Аg +
2НNО3(конц) = АgNО3 + NО2↑ + Н2О.Концентрированная серная кислота растворяет серебро с выделением бесцветного газа:
2Аg + 2Н2SO4(конц) = Аg2SО4 + SО2↑ + 2Н2О.
H3PO4 не реагирует с серебром, которое стоит в ряду напряжений правее водорода.
Слайд 68 Азотная кислота способна окислять и некоторые неметаллы, например
уголь, серу, фосфор:
При взаимодействии серы с 40%-ным раствором азотной
кислоты в качестве основного продукта восстановления азотной кислоты образуется оксид азота(II) S + 2HNO3 = H2SO4 + NO↑
При взаимодействии фосфора с 30%-ным раствором азотной кислоты в качестве основного продукта восстановления азотной кислоты образуется оксид азота(II)
3P + 5HNO3 + 2H2O = 3H3PO4 + NO↑
P + 5HNO3 = H3PO4 + NO2↑ + H2O
S + 6HNO3 = H2SO4 +NO2↑ + 2H2O
При взаимодействии серы иди фосфора с 60%-ным раствором азотной кислоты в качестве основного продукта восстановления азотной кислоты образуется оксид азота (IV)
Слайд 69
Тесты
ТЕСТ 5 . Азотная кислота реагирует с металлами
, стоящими в ряду напряжений после водорода.
1. Да
2.
НетТЕСТ 4 . Атом фосфора в молекуле ортофосфорной кислоты имеет степень окисления +3 .
1. Да
2. Нет
ТЕСТ 1 . Ортоосфорную кислоту можно получить взаимодействием ортофосфата кальция с серной кислотой при нагревании
1. Да
2. Нет
ТЕСТ 2. Фосфорная кислота вступает в реакцию с медью.
1. Да
2. Нет
ТЕСТ 3 . Ортофосфорная кислота является кислотой, средней силы по первой ступени диссоциации и слабой по второй и третьей.
1. Да
2. Нет
Слайд 72
Сравнение свойств нитратов и фосфатов.
НИТРАТЫ - соли азотной
кислоты HNO3, твердые хорошо растворимые в воде вещества.
Традиционное русское
название некоторых нитратов щелочных и щелочноземельных металлов и аммония - селитры аммонийная селитра NH4NO3,
калийная селитра КNO3чилийская селитра ,
кальциевая селитра Са (NO3) 2 норвежская селитра
Соли ортофосфорной кислоты называются ортофосфатами или фосфатами.
Ортофосфорная кислота образует одно-, двух- и трехзамещенные соли.
Н3РО4 + NaOH = NaH2PO4 + H2O (дигидрофосфат натрия)
H3PO4 + 2NaOH = Na2HPO4 + 2H2O (гидрофосфат натрия)
H3PO4 + 3NaOH = Na3 PO4 + 3H2O (фосфат натрия)
Средние соли, или фосфаты, например Са3(PO4)2, нерастворимы в воде, кроме фосфатов щелочных металлов; Большинство кислых солей — дигидрофосфатов, например Са(H2PO4)2, хорошо растворимы в воде; Гидрофосфаты, например Са HPO4, малорастворимы в воде (кроме гидрофосфатов натрия, калия и аммония),
Слайд 73
Сравнение химических свойств нитратов и фосфатов.
Li→R b→K→Ba→Sr→Ca→Na→Mg→Al→→Zn→Cr→Fe→Ni→Sn→Pb→(H)→Cu→Hg→Ag→Pd→Pt→Au
Соли металлов,
расположенные в ряду стандартных электродных потенциалов левее Mg (кроме
Li) при разложении образуют нитриты и кислород2KNO 3=2KNO 2+O 2
Нитраты являются достаточно сильными окислителями в твёрдом состоянии (обычно в виде расплава), но практически не обладают окислительными свойствами в растворе, в отличие от азотной кислоты.
если в расплавленную в пробирке калийную селитру бросить кусочек раскаленного древесного угля, то он энергично сгорит, взаимодействуя с выделяющимся из селитры кислородом .
Фосфаты при прокаливании не разлагаются, исключение составляет (NH4)3PO4.
Слайд 74
Разложение нитратов.
Соли металлов, расположенные в ряду стандартных электродных
потенциалов от Mg до Cu (включая Li) дают при
разложении оксид металла, NO2 и кислород.Соли металлов, расположенные в ряду стандартных электродных потенциалов после Cu образуют свободный металл, NO2 и кислород.
Разложение нитрата аммония.
Хотя бо́льшая часть нитрата аммония используется либо непосредственно как хорошее азотное удобрение, либо как полупродукт для получения прочих удобрений, это вещество в смеси с порошками алюминия и угля используют в качестве взрывчатого вещества — аммонала, который широко применяется при разработке горных пород.
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
.
2.Температура выше 270 °C, или детонация:
.
Температура ниже 270°C:
Слайд 75
Разложение нитратов.
Природные нитраты натрия и калия — были
известны в Китае в первые века новой эры; их
использовали для приготовления пороха и проведения фейерверков.Дымный, или чёрный, порох - смесь нитрата калия (калийной селитры ), серы и угля.
При горении пороха протекает реакция:
2KNO3+ЗС+S=K2S+N2+3СО2
При горении пороха протекает реакция,в результате которой выделяется большой объём газообразных веществ. С этим и связано использование пороха в военном деле: образующиеся при взрыве и расширяющиеся от тепла реакции газы выталкивают пулю из оружейного ствола.
Пиротехнический состав для стрел и пращи. Гравюра из книги В. Бирингуччо «Пиротехника». Издание 1556 г.
Слайд 76
Биологическая роль фосфатов и нитратов.
Растения потребляют элемент фосфор
из солей фосфорной кислоты в виде анионов дигидрофосфатов и
гидрофосфатов. Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Растения используют фосфор для построения семян и плодов, т.е. фактически самых важных своих частей. Также благодаря фосфорной кислоте повышается зимостойкость растений и их устойчивость к засухе и другим неблагоприятным условиям.Нитрат-ион – также неотъемлемая часть круговорота азота в природе, он в ней всегда присутствует. Растения и бактерии используют нитраты для построения белков и других необходимых органических соединений Нитрат-ион становится ядовитым только в больших количествах, нарушающих баланс других веществ.
Недостаток в почве элементов фосфора и азота практически не восполняется естественным путем. Поэтому необходимо вносить фосфорные и азотистые удобрения - фосфаты и нитраты.
Слайд 77 Удобрения — вещества, применяемые для улучшения питания растений, свойств
почвы, повышения урожаев.
Фосфорную кислоту и её соли (дигидрофосфаты, гидрофосфаты
и фосфаты) широко используют при производстве минеральных удобрений. Фосфоритная мука. - Са3(РО4)2.
Двойной суперфосфат - Са(Н2РО4)2.
Преципитат – СаНРО4 • 2Н2О
Аммофос – NН4Н2РО4 и (NН4)2НРО4
Нитраты аммония, калия, натрия и кальция применяются как удобрение
Удобрения
Слайд 78
Задание 8.
В трех пронумерованных пробирках без этикеток
находятся образцы следующих минеральных удобрений:
дигидрофосфат аммония (аммофос) ,
аммиачная селитра,
сульфат аммония.
С помощью каких реактивов можно отличить эти удобрения?
Как экспериментально доказать, что в состав этих солей входит ион аммония?
Слайд 79
Подсказка 1
Все эти соли имеют одинаковый катион-ион аммония,
но разные анионы, поэтому отличить образцы можно с помощью
качественных реакций на анионы.Вспомните качественные реакции на сульфат- и дигидрофосфат-анионы. Запишите уравнения кратких ионных реакций.
Слайд 80
Решение.
Все нитраты хорошо растворимые соли, поэтому используем
реакции на сульфат и дигидрофосфат-анионы.
В три пробирки отливаем по
2 мл исходных проб и добавляем 2-3 мл раствора хлорида бария BaCl2 – качественный реактив на содержание сульфат-ионов SO42-в растворе. В пробирке с сульфатом аммония (NH4)2SO4 выпадает осадок белого цвета BaSO4.
Наливаем в оставшиеся две исходных пробирки 2-3 мл раствора растворимой соли серебра, к примеру, нитрата серебра.
Наблюдаем выпадение осадка дигидрофосфата серебра желтого цвета в результате реакции обмена. Делаем вывод: что в этой пробирке находится раствор аммофоса . В последней пробирке – нитрат аммония.
В пробирки с веществами добавляем воды.
Качественная реакция на сульфат-анион.
BaCl2 + H2SO4 --> BaSO4 + 2HCl
Качественная реакция на PO43- - фосфат ион.
— образуется жёлтый осадок:
Н3РО4 + 3AgNO3 = Ag3PO4↓+ 3HNO3
Ba2+ + SO4 2-= BaSO4↓
Ag+ + PO43- → Ag3PO4.
Слайд 81
Подсказка 2
Как экспериментально доказать, что в состав этих
солей входит ион аммония?
Для доказательства состава соли необходимо знать
качественную реакцию на катион и анион соли. В данном случае речь идет о качественной реакции на катион аммония. Вспомните ее и запишите уравнения молекулярной и ионных реакций.
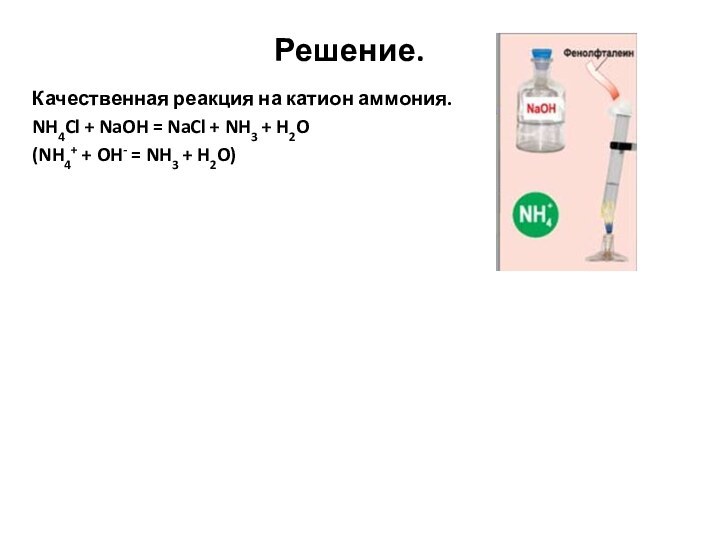
Слайд 82
Решение.
Качественная реакция на катион аммония.
NH4Cl + NaOH
= NaCl + NH3 + H2O
(NH4+ + OH- =
NH3 + H2O)Слайд 84 Часть 6. Составление уравнений реакций по схемам взаимопревращений соединений
азота и фосфора
Слайд 85
Задание 9.
Составьте уравнения химических реакций, позволяющих осуществить следующие превращения:
Р → Р2O5 → Н3РO4
→ Са3(РO4)2 → Н3РO4.
Слайд 86
Подсказка
Вспомните характерные признаки генетических рядов.
Все вещества этого
ряда должны быть образованы одним химическим элементом.
Вещества, образованные одним
и тем же элементом, должны принадлежать к различным классам или отражать разные формы его существования.Вещества, образующие генетический ряд одного элемента, должны быть связаны взаимопревращениями. По этому признаку можно различать полные и неполные генетические ряды.
Очевидно, что в задании представлен генетический ряд неметалла, которому соответствует растворимая кислота:
неметалл —> кислотный оксид —> кислота —> соль
В данном случае фосфора, связывающий простое вещество –фосфор с солями фосфорной кислоты.
Слайд 87
Решение.
При сжигании фосфора в избытке кислорода образуется оксид фосфора (V):
4Р + 5О2 = 2Р2О5 .
Оксид фосфора
(V) с избытком воды образует фосфорную кислоту:
Р2О5 + 3Н2О = 2Н3РО4.
Фосфат кальция получается из фосфорной кислоты под действием избытка известковой воды:
2Н3РО4 + 3Са(ОН)2
= Са3(РO4)2↓ + 6Н2О.Фосфорная кислота образуется из фосфата кальция под действием сильных кислот, например, серной:
Са3(РО4)2 + 3Н2SО4 = 3СаSО4↓ + 2Н3РО4.
Слайд 88
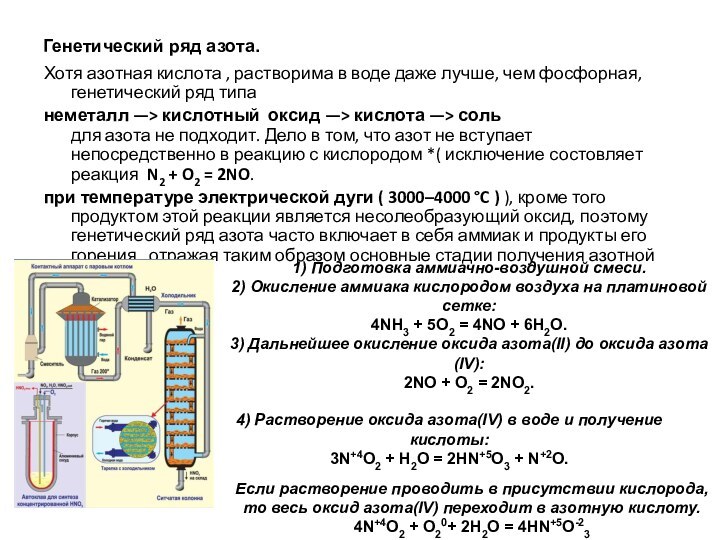
Генетический ряд азота.
Хотя азотная кислота , растворима в
воде даже лучше, чем фосфорная, генетический ряд типа
неметалл —>
кислотный оксид —> кислота —> соль
для азота не подходит. Дело в том, что азот не вступает непосредственно в реакцию с кислородом *( исключение состовляет реакция N2 + O2 = 2NO.при температуре электрической дуги ( 3000–4000 °C ) ), кроме того продуктом этой реакции является несолеобразующий оксид, поэтому генетический ряд азота часто включает в себя аммиак и продукты его горения , отражая таким образом основные стадии получения азотной кислоты.
1) Подготовка аммиачно-воздушной смеси.
2) Окисление аммиака кислородом воздуха на платиновой сетке:
4NH3 + 5O2 = 4NO + 6H2O.
3) Дальнейшее окисление оксида азота(II) до оксида азота(IV):
2NO + O2 = 2NO2.
4) Растворение оксида азота(IV) в воде и получение кислоты:
3N+4O2 + H2O = 2HN+5O3 + N+2O.
Если растворение проводить в присутствии кислорода, то весь оксид азота(IV) переходит в азотную кислоту.
4N+4O2 + O20+ 2H2O = 4HN+5O-23
Слайд 89
Задание 10.
В книге выдающегося писателя-сатирика Дж. Свифта
«Путешествие Гулливера» есть описание академии Ладаго: « В его
распоряжении были две большие комнаты, загроможденные самыми удивительными диковинами, 50 помощников работали под его руководством. Они сгущали воздух в сухое плотное вещество, извлекая из него селитру…»Напишите цепочку превращений, в результате которых из воздуха и воды можно получить селитру.
Слайд 90
Подсказка
В данном случае явно имеется в виду
получение нитратов из азота, т.е. достаточно записать уравнения
реакций, о которых мы говорили выше.
Слайд 91
Решение.
Реакция получения аммиака.
N2 + H2 =2NH3
2) Окисление
аммиака кислородом воздуха на платиновой сетке:
4NH3 + 5O2 =
4NO + 6H2O.3) Дальнейшее окисление оксида азота(II) до оксида азота ( IV):
2NO + O2 = 2NO2.
4.)Если растворение проводить в присутствии кислорода, то весь оксид азота(IV) переходит в азотную кислоту.
4N+4O2 + O20+ 2H2O = 4HN+5O-23
5. Реакция с солями слабых кислот:
K2CO3 + 2HNO3 = 2KNO3 + CO2↑ + H2O
2K+ + CO32– + 2H+ +2NO3– = 2K+ +2NO3– + CO2↑ + H2O
CO32– + 2H+ = CO2↑ + H2O
Или со щелочью
HNO3+ NaOH = NaNO3 + H2O
азот —> аммиак—> оксид азота(II) —> оксид азота ( IV) —>азотная кислота —> соль нитрат
Цепочка превращений:
Получение азотной кислоты. Гравюра из книги Г. Агриколы «О горном деле и металлургии». Издание 1557 г.
Слайд 92
Тесты
ТЕСТ 1. Удобрение аммофос является солью азотной кислоты.
1.
Да
2. Нет
ТЕСТ 2 . Количество связанного азота( нитратов)
в природных почвах и воде остается постоянным .1. Нет
2. Да
ТЕСТ 3 . Кислородом воздуха аммиак окисляется в присутствии катализаторов до оксида азота ( I ).
1. Да
2. Нет
ТЕСТ 4. В лаборатории аммиак получают из солей аммония , действуя на них твердыми щелочами.
1. Да
2. Нет
ТЕСТ 5 . Нитраты плохо растворимы в воде.
1. Нет
2. Да
ТЕСТ 6. Разнообразные вещества из генетического ряда азота можно получить окислением аммиака в зависимости от условий ведения процесса
1. Нет
2.Да





























