- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему ПРОГРЕССИРУЮЩИЕ МЫШЕЧНЫЕ ДИСТРОФИИ
Содержание
- 2. БИОХИМИЧЕСКИЕ КЛАССИФИКАЦИИ НАСЛЕДСТВЕННЫХ БОЛЕЗНЕЙ МЫШЦСарколеммные миопатии:ДистрофинопатииСаркогликанопатииДистрогликанопатииКавеолинопатии и дисферлинопатииПлектинопатияМатриксные миопатии:Мерозин-дефицитнаяЛаминопатииСаркомерные миопатии:Немалиновые миопатииТитиновые миопатииМиотилиновые миопатии
- 3. КЛАССИФИКАЦИЯ
- 6. Прогрессирующие мышечные дистрофии Это группа наследственно обусловленных
- 7. Миодистрофия Дюшенна Является наиболее распространенной формой ПМД.
- 8. ПАТОГЕНЕЗ«Ген дистрофина» (ген DYS), представляется самым большим
- 9. В патогенезе заболевания, помимо непосредственного дефекта дистрофина,
- 10. Схематическое представление расположения экзонов в гене дистрофина
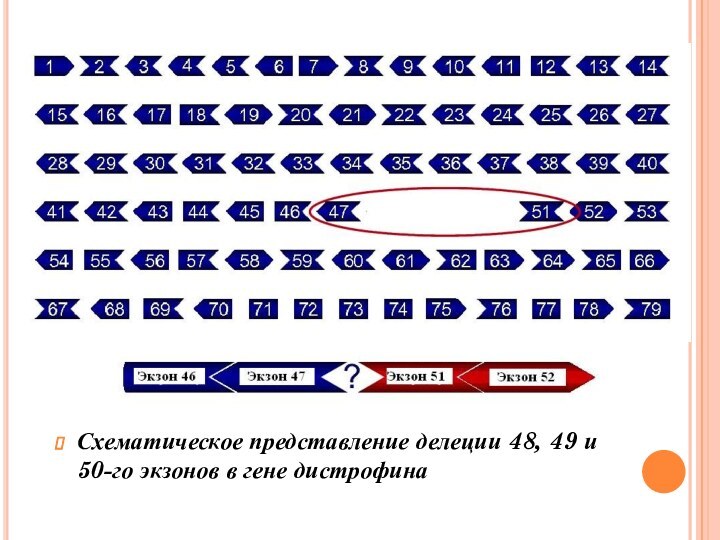
- 11. Схематическое представление делеции 48, 49 и 50-го экзонов в гене дистрофина
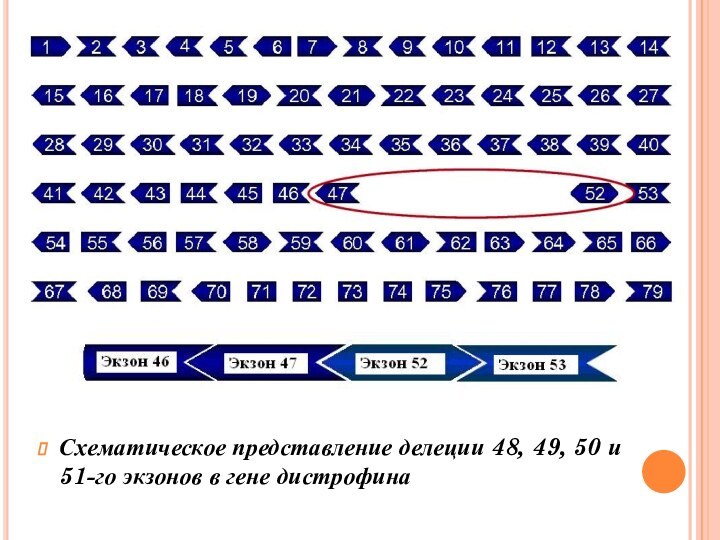
- 12. Схематическое представление делеции 48, 49, 50 и 51-го экзонов в гене дистрофина
- 13. Целесообразно выделять стадии течения миодистрофического процесса (Бадалян
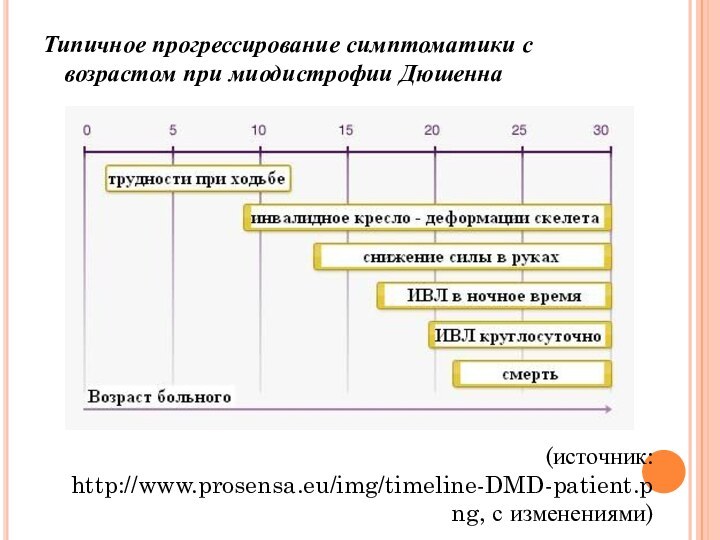
- 14. Типичное прогрессирование симптоматики с возрастом при миодистрофии Дюшенна(источник: http://www.prosensa.eu/img/timeline-DMD-patient.png, с изменениями)
- 15. ВАРИАНТЫ ТЕЧЕНИЯ 1) неблагоприятный вариант — обездвиженность
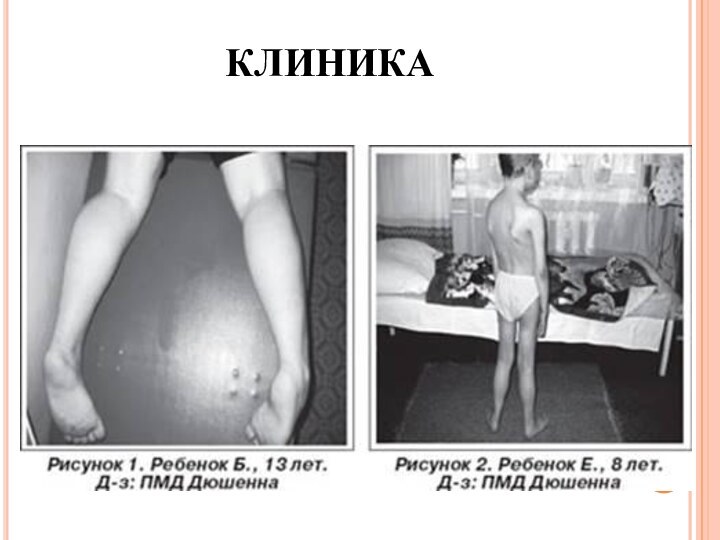
- 16. КЛИНИКА
- 17. Проявляется в возрасте 2—5 лет. Течение быстро
- 18. Псевдогипертрофия икроножных мышц создает обманчивое впечатление о
- 19. Ретракция пяточных (ахилловых) сухожилий не позволяет больному
- 20. Нарастают атрофии мышц бедра, тазового пояса, а
- 21. Одной из отличительных особенностей миодистрофии Дюшенна является
- 22. Сердечно-сосудистые расстройства клинически проявляются лабильностью пульса, артериального
- 23. Оказалось, что делеции гена дистрофина являются не
- 24. По данным А.Oldfors, начальные проявления кардиальной патологии
- 25. Изменения внешности. При слабости и атрофии мышц лица
- 26. Так же особенностями этой формы прогрессирующей мышечной
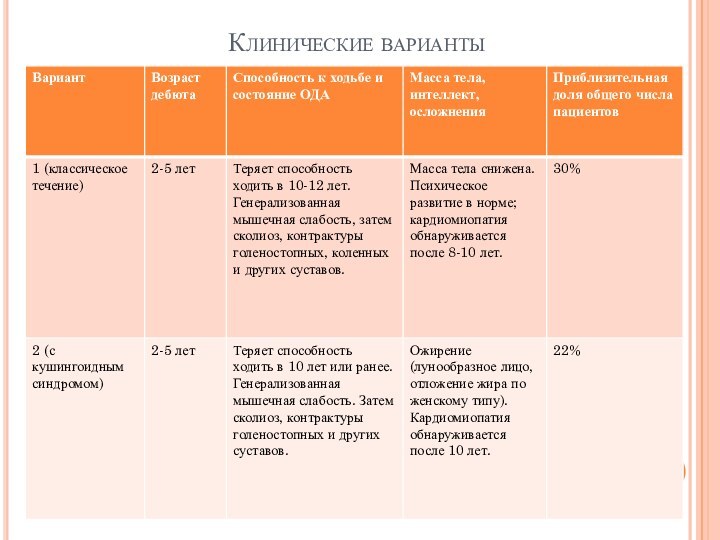
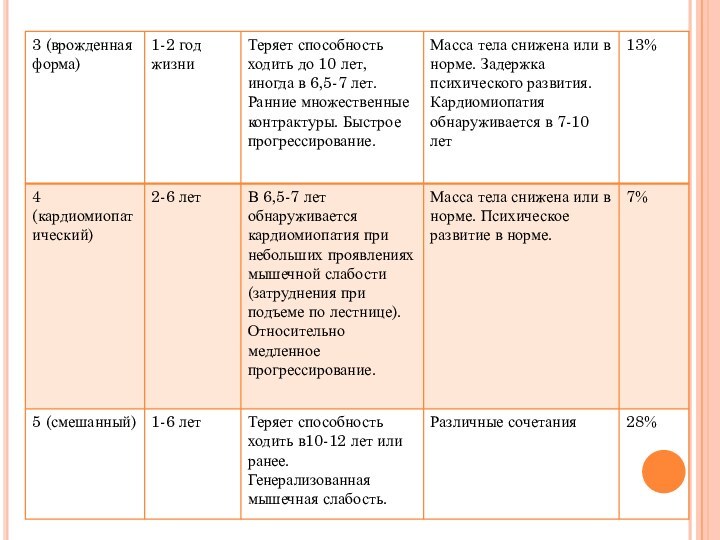
- 27. Клинические варианты
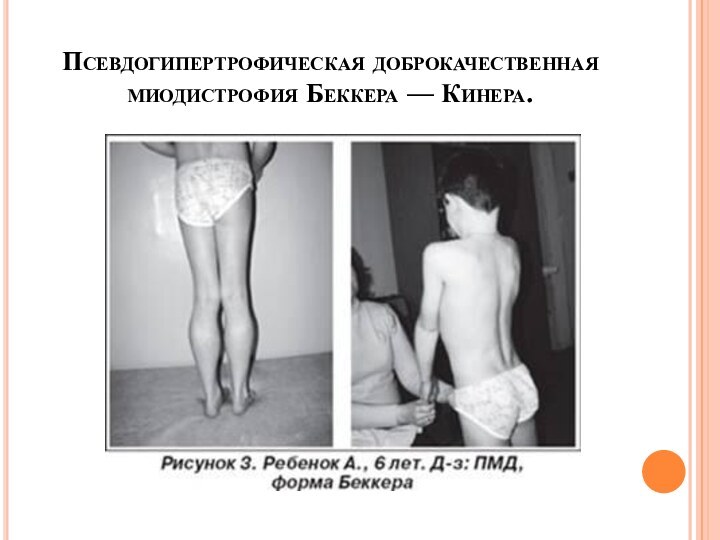
- 29. Псевдогипертрофическая доброкачественная миодистрофия Беккера — Кинера.
- 30. (Х-сцепл. рецессивн. тип)дебют от 5 до 20
- 31. Миодистрофия Роттауфа — Мортье
- 32. (Х-сцепл. рецессивн. тип)дебют в детском или юношеском
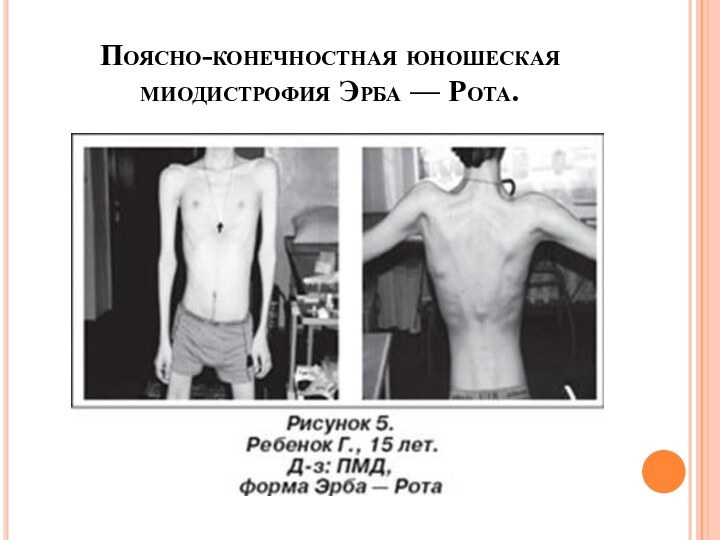
- 33. Поясно-конечностная юношеская миодистрофия Эрба — Рота.
- 34. (по аутосомно-рецессивному типу)дебют в детском или юношеском
- 35. Плече-лопаточно-лицевая миодистрофия Ландузи — Дежерина.по аутосомно-рецессивному типудебют
- 36. Лопаточно-перонеальная миодистрофия ДАВИДЕНКОВА1. аутосомно-доминантная формапроявляется чаще в
- 37. Дистальная миодистрофия Говерса
- 38. по аутосомно- доминантный тип с неполн пенетрантностью)дебют
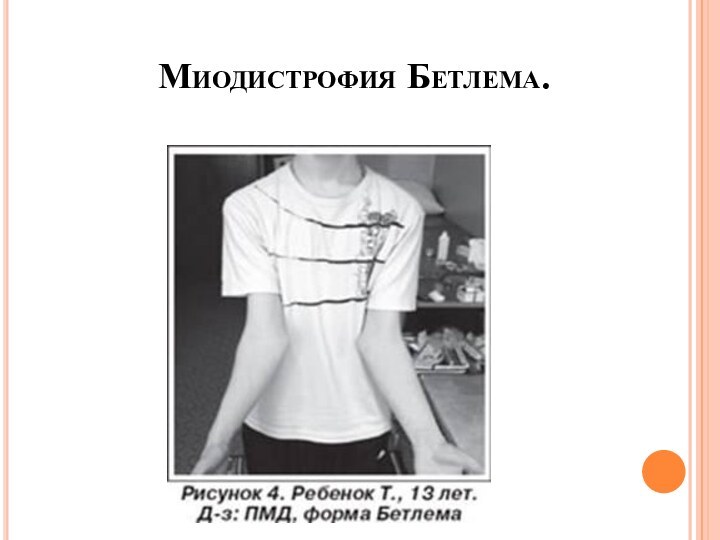
- 39. Миодистрофия Бетлема.
- 40. Дебют: раннее детство. Заболевание начинается со слабости
- 41. Диагностика миодистрофии Дюшенна.Мутационный анализ, который базируется на
- 42. Уже в ранних стадиях заболевания обнаруживают креатинурию,
- 43. Повышение уровня КФК (креатинфосфокиназы) отмечается при быстропрогрессирующих
- 44. Ранняя диагностика. У больных имеется нестабильный участок
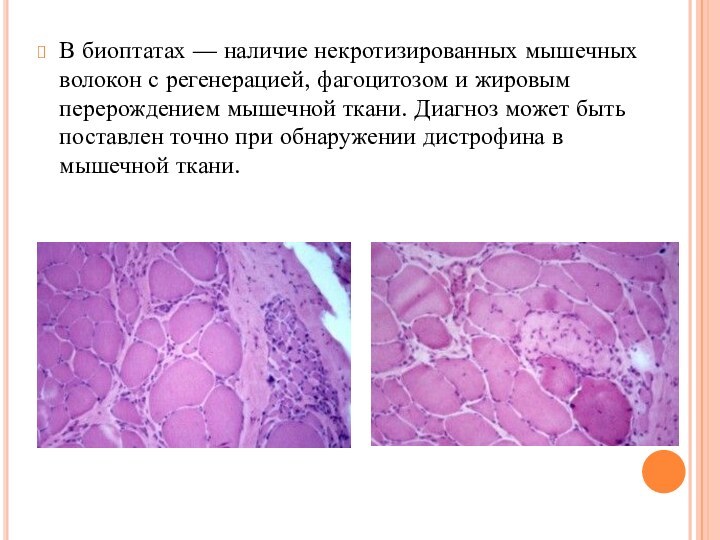
- 46. В биоптатах — наличие некротизированных мышечных волокон
- 47. Вестерн-блоттинг – современный высокочувствительный аналитический метод, используемый для
- 48. Все большую информативность приобретает метод ультразвукового исследования
- 49. ЛЕЧЕНИЕ МИОДИСТРОФИИ ДЮШЕННАПриём глюкокортикостероидов. Доказано, что если начать
- 50. В европейских и некоторых других странах используется
- 51. Приём агонистов β2-адренорецепторов. В нескольких рандомизированных исследованиях показан
- 52. В активно разрабатываемых в настоящее время генотерапевтических
- 53. Трансфекция мышечных волокон с использованием вирусных векторов.
- 54. Невирусные способы доставки кДНК гена дистрофина. Невирусные
- 55. Генная терапия на уровне первичного транскрипта гена
- 56. Активизация экспрессии утрофина – аутосомного гомолога гена
- 57. Аминогликозиды. Аминогликозидные антибиотики (в частности, гентамицин) показали свою
- 58. Пересадка стволовых клеток. Активно изучаемое направление, пока остающееся
- 59. Массаж: сила воздействия минимальна, акцент на улучшение
- 60. Скачать презентацию
- 61. Похожие презентации
БИОХИМИЧЕСКИЕ КЛАССИФИКАЦИИ НАСЛЕДСТВЕННЫХ БОЛЕЗНЕЙ МЫШЦСарколеммные миопатии:ДистрофинопатииСаркогликанопатииДистрогликанопатииКавеолинопатии и дисферлинопатииПлектинопатияМатриксные миопатии:Мерозин-дефицитнаяЛаминопатииСаркомерные миопатии:Немалиновые миопатииТитиновые миопатииМиотилиновые миопатии















































Слайд 2
БИОХИМИЧЕСКИЕ КЛАССИФИКАЦИИ НАСЛЕДСТВЕННЫХ БОЛЕЗНЕЙ МЫШЦ
Сарколеммные миопатии:
Дистрофинопатии
Саркогликанопатии
Дистрогликанопатии
Кавеолинопатии и дисферлинопатии
Плектинопатия
Матриксные
миопатии:
Слайд 6
Прогрессирующие мышечные дистрофии
Это группа наследственно обусловленных нервно-мышечных
заболеваний, характеризующихся прогрессирующей мышечной слабостью, атрофией мышц, двигательными нарушениями
[Гусев Е.И., Никифоров А.С., 2007].
Слайд 7
Миодистрофия Дюшенна
Является наиболее распространенной формой ПМД. Заболеваемость
составляет 13–33 случая на 100 000 родившихся.
Тип наследования
рецессивный, сцепленный с Х-хромосомой. Гены картированы на коротком плече Х-хромосомы, в 21-м локусе (Хр21).В основе заболевания лежит нарушение синтеза дистрофина.
Приблизительно 55-65% всех случаев миодистрофий Дюшенна обусловлены делециями гена дистрофина различной протяженности, 5-10% случаев – дупликациями части гена, у остальных больных имеют место точковые мутации.
Делеции в гене дистрофина распределяются отнюдь не равномерно по его длине, а преимущественно группируются вокруг двух областей гена, образуя так называемые «горячие точки» делеций – в 5′-области гена (экзоны 2-20) и в его дистальной части в области экзонов 44-53.
Проксимальные делеции гена чаще выявляются при семейных формах болезни, тогда как дистальные делеции обычно ассоциированы со спорадическими случаями; при выявлении проксимальной делеции гена повторный риск заболевания в семье почти на порядок выше, чем при дистальной.
При миодистрофии Дюшенна уровень дистрофина не превышает 3 % от нормального, тогда как при болезни Беккера он колеблется от 3 до 20 % .
Слайд 8
ПАТОГЕНЕЗ
«Ген дистрофина» (ген DYS), представляется самым большим из
известных на сегодня генов человека и имеет весьма сложную
молекулярную организацию.В норме в мышечном волокне дистрофин локализуется на цитоплазматической поверхности сарколеммы, являясь важной составной частью цитоскелета и обеспечивая связь между актиновыми филаментами (т.е. сократительным аппаратом мышечного волокна) и сарколеммой.
Кроме того, в небольших количествах дистрофин представлен в сердечной мышце, гладкой мускулатуре и ЦНС.
До сих пор точно не известно, почему дефицит дистрофина приводит к дистрофии мышц, однако, по-видимому, этот белок стабилизирует мышечное волокно.
При сокращении мышечного волокна происходит «скольжение» некоторых белков относительно друг друга, что требует затрат энергии. Чтобы это «скольжение» выразилось в сокращении мышечного волокна, сократительные белки должны быть фиксированы к сарколемме. Дистрофин непосредственно примыкает к ней изнутри, являясь составной частью т.н. «дистрофин-ассоциированного протеинового комплекса» (DAPC). Этот комплекс прикрепляет сократительные белки мышечного волокна к сарколемме и другим мышечным волокнам (внеклеточному матриксу) посредством других белковых комплексов.
Мышечные волокна с недостаточным содержанием дистрофина быстро разрываются. В какой-то степени этот процесс может компенсироваться за счёт образования новых мышечных волокон, но с течением времени он ослабевает, а дегенерировавшие волокна замещаются жировой и соединительной тканью.
Слайд 9 В патогенезе заболевания, помимо непосредственного дефекта дистрофина, играют
роль и иммунопатологические механизмы.
У пациентов имеет место хронический
воспалительный процесс и нарушение процессов регенерации. Реакции воспалительного каскада запускаются вскоре после рождения и обусловлены повышением содержания «воспалительных» генных кластеров в 8-10 месячном возрасте. За счёт дефекта липидного бислоя сарколеммы повышается её проницаемость, особенно при мышечном напряжении; свой вклад вносит и цитотоксичность макрофагов, лизирующих сарколемму после физических нагрузок (на мембране дистрофически изменённых волокон концентрируются антигены I класса главного комплекса гистосовместимости (HLA), что делает её более уязвимой для Т-клеточно-опосредованной атаки). При этом внутриклеточная КФК выходит в кровь, а внеклеточный кальций устремляется в миоциты.
Воспалительный каскад активирует выработку фиброзирующего цитокинового трансформирующего фактора роста (TGF-β1), вызывающего потерю мышечной ткани из-за нарушения процессов регенерации. Предполагается, что регенеративная способность мышечной ткани истощается за счёт дефицита клеток-спутников после непрерывно протекающих циклов дегенерации-регенерации.
Слайд 13 Целесообразно выделять стадии течения миодистрофического процесса (Бадалян Л.
О., 1974):
I стадия — с умеренно выраженными двигательными нарушениями
(больные могут ходить, выполнять легкую работу, слабость выявляется при нагрузке);
II стадия — с выраженными двигательными затруднениями при ходьбе, подъеме по лестнице, при выполнении физической работы;
III стадия — паралитическая: грубые контрактуры, деформации, самостоятельное передвижение невозможно.
Слайд 14
Типичное прогрессирование симптоматики с возрастом при миодистрофии Дюшенна
(источник:
http://www.prosensa.eu/img/timeline-DMD-patient.png, с изменениями)
Слайд 15
ВАРИАНТЫ ТЕЧЕНИЯ
1) неблагоприятный вариант — обездвиженность через 5—10
лет от начала болезни, быстрое нарастание степени нарушения жизнедеятельности,
тяжести инвалидности; 2) средний темп прогрессирования — через 10—15 лет имеются выраженные двигательные нарушения, прогноз в отношении возможности самообслуживания плохой; 3) медленный темп прогрессирования — через 10—15 лет от начала болезни нет выраженных двигательных нарушений, больной свободно передвигается, трудовой прогноз на ближайшие годы относительно благоприятен, возможна частичная трудовая адаптация, иногда оправдано профессиональное обучение.
Слайд 17
Проявляется в возрасте 2—5 лет.
Течение быстро прогрессирующее,
злокачественное.
Обездвиженность больных, как правило, наступает в возрасте 14—15
лет, смерть наступает в возрасте 15—18 лет, больные редко живут более 25 лет. Первые признаки заболевания проявляются в 1-3 года жизни слабостью мышц тазового пояса. Уже на 1-м году отставание детей в моторном развитии. Движения неловкие, при ходьбе дети неустойчивы, часто спотыкаются, падают.
В 2-3 года появляются мышечная слабость, патологическая мышечная утомляемость, проявляющаяся при физической нагрузке - длительной ходьбе, подъеме на лестницу, изменение походки по типу «утиной».
Вставание происходит поэтапно с активным использованием рук - «взбирание лесенкой» или «взбирание по самому себе». Типичные жалобы родителей — это ходьба детей на пальцах и частые падения. Ранние симптомы подкрадываются незаметно.
Слайд 18 Псевдогипертрофия икроножных мышц создает обманчивое впечатление о сохранности
мышечной силы и даже радует родителей. Псевдогипертрофии мышц могут
развиваться также в ягодичных, дельтовидных мышцах, мышцах живота и языка. Дети могут не привлекать внимания специалиста до тех пор, пока проксимальная мышечная слабость не станет настолько выраженной, что затруднит вставание ребенка с пола и определит утиный тип ходьбы и использование миопатических приемов "взбирания по себе" (симптом Говерса).Слайд 19 Ретракция пяточных (ахилловых) сухожилий не позволяет больному полноценно
опираться на пятки, что определяет ходьбу на пальцах.
Между 3
и 8 годами происходит нарастающее укорочение пяточных сухожилий и формируются сгибательные контрактуры в голеностопных суставах, развиваются поясничный гиперлордоз, кифосколиоз грудного отдела позвоночника. Глубокие рефлексы изменяются с различной последовательностью.
В ранних стадиях болезни исчезают коленные рефлексы, позже - рефлексы с двуглавой и трехглавой мышц.
Ахилловы рефлексы длительное время остаются сохранными.
Характерны симметричная и неуклонно прогрессирующая слабость в мышцах бедер и плечевого пояса, затрудняющая движения при подъеме, беге, прыжках, поясно-конечностная атрофия мышц, преимущественно мышц тазового пояса и бедер, истинная гипертрофия или псевдогипертрофия икроножных мышц, ранние сухожильно-связочные ретракции (укорочение сухожилий и связок), контрактуры крупных суставов.
Коленные рефлексы рано исчезают, ахилловы рефлексы сохраняются
Слайд 20 Нарастают атрофии мышц бедра, тазового пояса, а затем
плечевого пояса, спины и проксимальных отделов рук. Атрофии мышц
всегда симметричны. Нередко атрофии мышц маскируются хорошо развитой подкожной жировой клетчаткой.Изменения костной системы не ограничиваются лишь сколиозом: часто развиваются деформации грудной клетки и стоп, диффузный остеопороз.
Вначале атрофии локализуются в проксимальных группах мышц нижних конечностей - мышцах тазового пояса, бедер, а через 1-3 года быстро распространяются в восходящем направлении на проксимальные группы мышц верхних конечностей - плечевой пояс, мышцы спины. Вследствие атрофии появляются лордоз, «крыловидные» лопатки, «осиная» талия.
Слайд 21 Одной из отличительных особенностей миодистрофии Дюшенна является сочетание
данной формы с патологией костно-суставной системы и внутренних органов
(сердечно-сосудистой и нейроэндокринной систем). Костно-суставные нарушения характеризуются деформациями позвоночника, стоп, грудины. На рентгенограммах обнаруживают сужение костномозгового канала, истончение коркового слоя длинных диафизов трубчатых костейСлайд 22 Сердечно-сосудистые расстройства клинически проявляются лабильностью пульса, артериального давления,
иногда глухостью тонов и расширением границ сердца. На ЭКГ
регистрируются изменения миокарда (блокада ножек пучка Гиса и др.). Нейроэндокринные нарушения встречаются почти у половины пациентов. Чаще других даются синдром Иценко-Кушинга, адипозогенитальная дистрофия Бабинского-Фрелиха.Установлено, что при мышечной дистрофии Дюшенна сердечно-сосудистая система вовлекается в патологический процесс достаточно часто и рано. Около 73% больных с данной нозологией имеют различные проявления кардиальной патологии. Причиной сердечно– сосудистой патологии является генетически детерминированный недостаток дистрофина в кардиомиоцитах.
Слайд 23 Оказалось, что делеции гена дистрофина являются не единственной
причиной поражения мышечной ткани у пациентов с прогрессирующей мышечной
дистрофии Дюшенна. В настоящее время ученые выделяют три основных причины: дефицит дистрофина, обусловленный генетическим дефектом; дефицит дистрофин- ассоциированного гликопротеина (молекулярная масса 50 кДа) или других дистрофинассоциированных белков, наличие особого генетического варианта строения ангиотензин- конвертирующего фермента. Сердечная мышца может поражаться как вследствие всех трех причин, так и их комбинаций.Выявление маркеров вовлечения сердечной мышцы в патологический процесс позволяет ответить на исключительно важный практический вопрос – почему кардиомиопатия может наблюдаться у пациентов с легкими вариантами поражения скелетных мышц, а также возможность дебюта заболевания с кардиомиопатии.
Слайд 24 По данным А.Oldfors, начальные проявления кардиальной патологии у
больных возникают уже в раннем возрасте и прогрессируют с
годами.Низкая физическая активность пациентов с прогрессирующей мышечной дистрофии Дюшенна, относительно быстрая утрата способности к самостоятельной ходьбе, снижающая нагрузку на миокард, а также недостаточная нацеленность родителей на выявление кардиальных жалоб (основное внимание обращается прежде всего на двигательные нарушения), приводят к тому, что менее 15% детей до 14 лет, имеющих поражение мышцы сердца, активно обращаются к кардиологу.
Слайд 25 Изменения внешности. При слабости и атрофии мышц лица отмечается
отсутствие морщин на лбу (симптом «полированного лба»). Наблюдается гипомимия:
больные не могут плотно зажмурить глаза, надуть щеки, вытянуть губы в трубочку и т. д. В некоторых случаях вследствие замещения губных мышц соединительной и жировой тканью губы утолщаются (напоминают «губы тапира»).Патология системы органов дыхания. Слабость дыхательной мускулатуры и диафрагмы обусловливает уменьшение жизненной ёмкости лёгких до 20% от нормы, что приводит к эпизодам ночной гиповентиляции. Дети часто встают со страхом, связанным с ощущением удушья, и боятся спать. Существенный вклад в летальность вносит дыхательная недостаточность, которая провоцируется интеркуррентными инфекциями или аспирацией.
Слайд 26 Так же особенностями этой формы прогрессирующей мышечной дистрофии
являются сопутствующая поражению мышц умственная отсталость, снижение интеллекта, остеопороз
и истончение кортикального вещества костей, кардиомиопатия, легочно-сердечная недостаточность. У части больных обнаруживаются различные признаки эндокрпинопатии: адипозогенитальный синдром, низкорослость.В связи с дефицитом церебральных изоформ дистрофина — аподистрофинов, у 30 % больных с миодистрофией Дюшенна имеет место умственная отсталость различной степени: от пограничной интеллектуальной недостаточности до выраженной олигофрении.
Тяжесть умственной отсталости и нарушений высших когнитивных функций не коррелирует с выраженностью мышечного дефекта и стадией миодистрофического процесса.
К экзогенным факторам, усугубляющим проявления умственной отсталости, относят развивающуюся социальную дезадаптацию.
Слайд 30
(Х-сцепл. рецессивн. тип)
дебют от 5 до 20 лет
чаще 10-15 лет
течение медленно прогрессирующее
распространение мышечных дистрофий как при
миодистрофии Дюшенапоражение сердца выражены меньше
доживают до 30-60 лет, могут иметь детей,
интеллект сохранен
повышение активности КФК умеренное
называют мягкой формой миодистрофии Дюшена
качественное изменение белка дистрофина
Слайд 32
(Х-сцепл. рецессивн. тип)
дебют в детском или юношеском возрасте
(чаще 5-12 лет)
выраженные сухожильные ретракции и контрактуры
постепенно формируются
патологические позы из-за фиброза мышцдалее невозможно сгибать позвоночник
медленно прогрессируют мышечные гипотрофии
слабость мышц обычно умеренная
преобладают парезы и гипотрофии в лопаточно-плечевой обл. и дистальных отделах ног
псевдогипертрофий нет
характерна кардиомиопатия
интеллект чаще сохранен
выраженная гиперферментемия
нередко доживают до 40-50 лет, умирают от сердечной недостаточности
Слайд 34
(по аутосомно-рецессивному типу)
дебют в детском или юношеском возрасте
чаще в 14-16 лет
конечностно-поясная миодистрофия
прежде всего атрофии мышц тазового
поясаранний признак утиная походка и др миопатические феномены в дальнейшем атрофии мышц плечевого пояса, рук (форма ЛЕЙДЕНА-МЕБИУСА)
редко дебют со слабости мышц плечевого пояса (форма ЭРБА)
возможны умеренные псевдогипертрофии, формирование контрактур
при поражении межреберных мышц и диафрагмы – дыхательная недостаточность
мышцы лица чаще не страдают
нередко эндокринопатии
течение вариабельное от мягкого до быстро прогрессирующего
умеренная гиперферментемия
инвалидизация через 10-20 лет
возможна и злокачественная (псевдодюшенновская) форма, дебют в 3-5 лет
Слайд 35
Плече-лопаточно-лицевая миодистрофия Ландузи — Дежерина.
по аутосомно-рецессивному типу
дебют чаще
к 20 годам, иногда несколько позже
слабость и гипотрофия мышц
лица, особенно круговых глаз и рта, мышц плечевого поясарано губы тапира, лицо сфинкса, улыбка Джоконды,
крыловидные лопатки
далее: слабость передней зубчатой, большой грудной, нижних отделов трапецивидных мышц, широчайшей мышцы спины, двуглавой, трехглавой мышц
далее: слабость перонеальных мышц (появляется степаж)
далее: в меньшей степени проксимальные мышцы нижних конечностей
возможна умеренная псевдогипертрофия икроножных и дельтовидных мышц
сухожильные рефлексы постепенно снижаются
интеллект сохранен
течение относительно мягкое
гиперферментемия умеренная
женщины в 3 раз чаще мужчин болеют
Слайд 36
Лопаточно-перонеальная миодистрофия ДАВИДЕНКОВА
1. аутосомно-доминантная форма
проявляется чаще в детстве
иногда
во 2-3-м десятилетии жизни
слабость и прогрессирующая гипотрофия мышц плечевого
пояса и перонеальной группы
мышц с угасанием сухожильных рефлексов начиная с пяточных, степажслабость проксимальных отделов рук и плечевого пояса
возможны дистальные парестезии, гипестезии
как правило не страдают мышцы лица
течение медленно прогрессирующее
возможно развитие мышечных контрактур
повышена активность КФК в крови 2. Х-сцепленная рецессивная форма
дебют в первую декаду жизни иногда с мышечных контрактур
сначала слабость в грудных, дельтовидных мышцах, в мышцах
проксимальных отделов рук
позже: перонеальные мышцы
характерно значительное повышение КФК
характерна кардиомиопатия (чаще причина смерти)
Слайд 38
по аутосомно- доминантный тип с неполн пенетрантностью)
дебют обычно
после 20 лет чаще 40-60 лет
медленно прогрессирующее течение
начало
со слабости и гипотрофии в мышцах стоп и голенейпозже постепенно мышцы кистей и предплечий
снижаются и исчезают сухожильные и периостальные рефлексы
в поздней стадии поражаются проксимальные мышцы конечностей
чувствительность сохранна
всегда интактны мышцы лица
нет псевдогипертрофий
нехарактерны сухожильные ретракции
возможна кардиомиопатия
Слайд 40
Дебют: раннее детство.
Заболевание начинается со слабости мышц
тазового пояса, которая возникает в грудном или раннем детском
возрасте.Лицевая мускулатура остается интактной. Часто симптомы болезни настолько стертые
. Слабость прогрессирует медленно и обычно не приводит к инвалидизации и не влияет на продолжительность жизни.
Рано развиваются сгибательные контрактуры в локтевых, голеностопных и межфаланговых суставах (кроме больших пальцев).
Деформаций позвоночника не наблюдается
Ретракция пяточных сухожилий является причиной ходьбы на пальцах
Сухожильные рефлексы нормальны или снижены.
Кардиомиопатия нехарактерна
. Течение: доброкачественное, стационарное.
Слайд 41
Диагностика миодистрофии Дюшенна.
Мутационный анализ, который базируется на оценке
полиморфизма длины рестрикционных фрагментов, в настоящее время является общепринятым
для диагностики болезней Дюшенна выявления носительства гена и пренатальной диагностики.Анализ содержания дистрофина в мышцах с использованием иммуногистохимической реакции на дистрофии помогает отличить миодистрофию Дюшенна от формы Беккера и дает возможность прогнозировать тип клинического течения.
Слайд 42 Уже в ранних стадиях заболевания обнаруживают креатинурию, гипераминоацидурию,
повышение альдолаз, трансаминаз (особенно аланиновой) и специфического фермента мышечной
ткани — креатинфосфокиназы.Нарушения всех видов обмена веществ (углеводного, жирового, белкового), гипераминоацидурия, гиперферментурия, пентозурия, креатинурия могут наблюдаться и при других формах нервно-мышечных заболеваний.
Однако при миодистрофии Дюшенна биохимические изменения выражены в большей степени, что является дополнительным критерием при оценке тяжести заболевания.
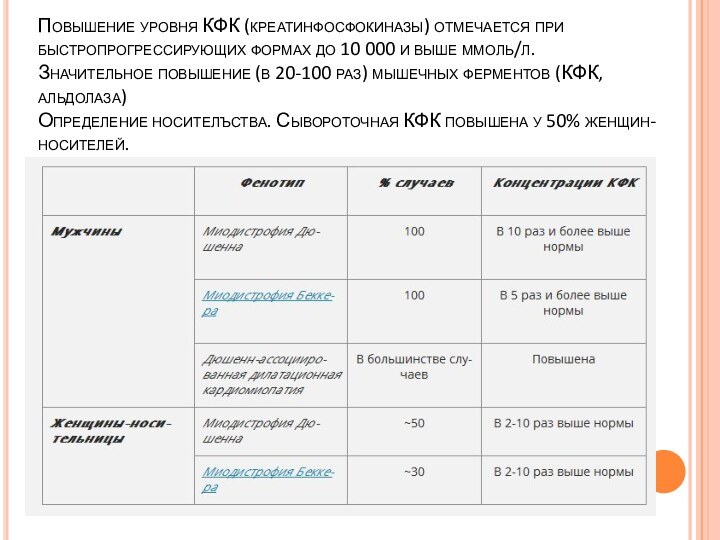
Слайд 43 Повышение уровня КФК (креатинфосфокиназы) отмечается при быстропрогрессирующих формах
до 10 000 и выше ммоль/л. Значительное повышение (в 20-100
раз) мышечных ферментов (КФК, альдолаза) Определение носителъства. Сывороточная КФК повышена у 50% женщин-носителей.Слайд 44 Ранняя диагностика. У больных имеется нестабильный участок ДНК
с повышенным количеством CTG-триплетных повторов в хромосомном локусе 19ql3.3.
На ЭМГ – первично-мышечные изменения (1 неспецифический низкоамплитудный ритм). Позволяет отдифференцировать первично-мышечное поражение от нейрогенного. При первом выявляются быстро рекрутируемые, короткие по длительности полифазные низкоамплитудные потенциалы двигательных единиц. По мере прогрессирования заболевания интерференционный паттерн ЭНМГ становится редуцированным за счёт снижения рекрутирования, и в конце концов регистрируется биоэлектрическое «молчание» мышцы. Данные ЭНМГ не являются специфичными и одинаковы при любой форме первично-мышечного поражения. Поэтому на практике ЭНМГ в диагностике миодистрофии Дюшенна используется достаточно редко.
Слайд 46 В биоптатах — наличие некротизированных мышечных волокон с
регенерацией, фагоцитозом и жировым перерождением мышечной ткани. Диагноз может
быть поставлен точно при обнаружении дистрофина в мышечной ткани.Слайд 47 Вестерн-блоттинг – современный высокочувствительный аналитический метод, используемый для определения
специфичных белков в сложных смесях с помощью антител.
Метод
основан на комбинации гель-электрофореза и иммунохимической реакции «антиген-антитело». Визуализация исследуемого белка достигается путем проведения соответствующей биохимической реакции с образованием продукта, который определяется колориметрическим, хемилюминесцентным, флюоресцентным методами детекции.
Количество белка может быть оценено с помощью денситометрии. Высокая степень разрешения достигается за счет электрофоретического разделения белков и специфичности моноклональных антител.
В оптимально отработанных условиях вестерн-блоттингом можно обнаруживать антиген в количествах менее 1нг.
Метод применяется для верификации положительных результатов иммуногистохимического исследования. При миодистрофии Дюшенна количество дистрофина составляет 0-5% от нормы.
Слайд 48 Все большую информативность приобретает метод ультразвукового исследования (УЗИ)
мышц. Определяется однородность мышечной ткани с равномерным уплотнением и
значительным увеличением уровня эхогенности, что характеризует разрастание соединительной ткани. Мышцы плохо дифференцированны, уменьшены в размере, в 60–80 % случаев выявляется жировая инфильтрация. Отсутствует характерный рисунок исчерченности, что свидетельствует о деструктурированности ткани. Сокращения мышц при активном напряжении визуализируются слабо.
Слайд 49
ЛЕЧЕНИЕ МИОДИСТРОФИИ ДЮШЕННА
Приём глюкокортикостероидов. Доказано, что если начать глюкокортикостероидную
пероральную терапию в то время, когда становится заметной остановка
физического развития ребёнка (как правило, в возрасте 4-6 лет), происходит заметная задержка прогрессирования утраты мышечной массы, нарастание мышечной силы и улучшение функционального состояния пациента. Если же глюкокортикостероиды назначить, когда ребёнок уже утратил способность к передвижению, эффективность их близка к нулю. При этом объяснить действие этой группы препаратов лишь иммуносупрессией невозможно, т.к. назначение иммунодепрессанта азатиоприна больным с миодистрофией Дюшенна, как показали исследования, не сопровождается каким-либо лечебным эффектом.Оптимальным режимом терапии преднизолоном считается ежедневный приём per os в дозе 0,75 мг/кг/сут (но не более 40 мг/сут) до появления значимых побочных эффектов, после чего производится постепенное снижение дозы до 0,5 мг/кг/сут, а в случае сохранения серьёзных побочных эффектов – до 0,3 мг/кг/сут. Альтернативной схемой является приём в тех же дозах через день или «интермиттирующий» приём (10 дней приёма, 10-20 дней перерыв). Лицам, у которых на фоне ежедневного приёма преднизолона развивается ожирение и поведенческие расстройства, можно рекомендовать переход на приём в дозе 5 мг/кг два дня в неделю (например, по пятницам и субботам). Положительный эффект (нарастание мышечной силы) отмечается уже к 10-му дню от начала лечения.
Слайд 50 В европейских и некоторых других странах используется синтетическое
прозводное преднизолона – дефлазакорт (производится в Великобритании, Испании, Индии, Бразилии, Панаме
и Гондурасе). Показано, что он в меньшей степени вызывает побочные эффекты, особенно что касается ожирения, однако, при его применении чаще развивается бессимптомная катаракта. Дозировка дефлазакорта – 0,9 мг/кг/сут (но не более 39 мг/сут).Многие специалисты рекомендуют оставлять пациента на поддерживающей дозе глюкокортикостероидов и после того, как он пересел в инвалидную коляску: это позволяет дольше сохранить силу в руках, замедлить прогрессирование кардиореспираторных нарушений и развитие сколиотической деформации позвоночника.
К основным побочным эффектам длительной глюкокортикостероидной терапии относятся: поведенческие расстройства, задержка роста, ожирение, остеопороз, нарушение толерантности к глюкозе, иммуносупрессия, надпочечниковая недостаточность, диспепсия, пептические язвы, катаракта, кожные проявления. С большинством из них можно бороться, не снижая дозы препарата.
Слайд 51 Приём агонистов β2-адренорецепторов. В нескольких рандомизированных исследованиях показан положительный
эффект β2-агонистов на мышечную силу, однако, на течение заболевания
они влияния не оказывают. Эти вещества используются для лечения бронхиальной астмы и включают такие препараты, как сальбутамол, формотерол и др.Приём других лекарственных препаратов. Возможно, некоторый положительный эффект на течение заболевания оказывают аминокислоты, карнитин, коэнзим-Q10, рыбий жир, экстракт зелёного чая и витамин Е.
Приём кардиотропных препаратов. Около 2/3 больных миодистрофией Дюшенна испытывают те или иные кардиологические проблемы и, пожалуй, самая существенная из них – развитие дилатационной кардиомиопатии. При появлении у больного её эхокардиографических (или клинических) признаков назначаются ингибиторы АПФ; если через 3 месяца лечения улучшения не происходит, добавляют β-адреноблокаторы (карведилол или метопролол). В случае прогруссирующего течения присоединяют диуретики, препараты наперстянки.
Слайд 52 В активно разрабатываемых в настоящее время генотерапевтических подходах
можно выделить несколько направлений: 1) коррекция дефекта путем введения
нормальных копий комплементарной ДНК (кДНК) гена дистрофина в составе рекомбинантных вирусных частиц или посредством невирусных способов доставки; 2) коррекция мутаций на уровне геномной копии гена или на его первичном РНК-транскрипте; 3) активация в мышечных волокнах и клетках репрессированного в ходе онтогенеза аутосомного гомолога гена дистрофина – гена утрофина.Слайд 53 Трансфекция мышечных волокон с использованием вирусных векторов. Эксперименты
проводились как с ретровирусными векторами, несущими укороченную кДНК «мини»-гена
DYS, так и с аденовирусными векторами, способными нести полноразмерную кДНК этого гена. В экспериментах на мышах удалось продемонстрировать достаточно эффективную и долговременную трансфекцию скелетных и сердечной мышц после внутривенного введения рекомбинантного аденовируса с кДНК гена дистрофина. Была так же продемонстрирована принципиальная возможность трансфекции и синтеза дистрофина в мышцах диафрагмы mdx-мышей (лабораторная популяция мышей с дефектами гена DYS) с использованием полноразмерной кДНК гена дистрофина человека. Кроме нормализации синтеза дистрофина, удалось показать, что сверхэкспрессия этого гена (уровень белка в 50 раз выше нормы) не оказывает вредных побочных эффектов. Вместе с тем, использование вирусных носителей, особенно в экспериментах in vivo, наталкивается на существенные методические трудности. К ним относятся – недостаточная пакующая способность у ретровирусов, необходимость наличия клеток-хелперов. Наибольшим серьезным препятствием к использованию вирусных векторов для доставки генетических конструкций является выраженный иммунный ответ на вирусные антигены. Несмотря на огромный объем работ по модификации генома вируса носителя, сокращения размера вирусного генома до минимально возможного размера, иммунный ответ тем не менее сохраняется и делает бессмысленными повторные введения генных конструкций. Тем не менее работы по совершенствованию вирусных способов доставки не прекращаются. Наиболее перспективно введение гена дистрофина новорожденным мышам. Было продемонстрировано, что в результате трансфекции мышат аденовирусным вектором и компактизацией ДНК полилизином pK8, экспрессия дистрофина регистрировалась в течении почти 1 года.
Слайд 54
Невирусные способы доставки кДНК гена дистрофина.
Невирусные способы
доставки включают баллистическую трансфекцию, методы электропорации (электрошока), введение генетических
конструкций в составе липосом или упакованных с помощью олигопептидов, молекулярных коньюгатов, полимерных носителей. Эти носители в значительной мере лишены недостатков присущих вирусным векторам, однако, способность к трансформации у большинства из них ниже, чем у вирусных векторов. Первые эксперименты по доставке «голой» плазмидной ДНК с кДНК гена дистрофина человека показали возможность трансфекции и появление дистрофин-положительных мышечных волокон у mdx-мышей.Наиболее продвинутыми на сегодняшний день являются исследования по доставке гена дистрофина методом электропорации или с носителем на основе полимерной формы декстрана. В последнем случае для доставки гена дистрофина использовали декстран, обеспечивающий самособирающийся ДНК полимерный комплекс. Отсутствие токсичности и иммунного ответа, диссеминация по различным группам мышц и достаточно длительная (более двух месяцев) экспрессия показали перспективность данной системы доставки для проведения клинических испытаний.
Еще более обнадёживающие результаты получены в экспериментах на мышах, крысах, кроликах и обезьянах по доставке генетических конструкций в мышцы с помощью электропорации. Восьмикратный электрический импульс (200 V/cm2, 20 мсек, 17 Гц), через 30 секунд после введения плазмид с геном β-галактозидазы LacZ приводил к синтезу β-галактозидазы в 76% мышечных волокон, а с использованием электрошока только в 8%.
Слайд 55 Генная терапия на уровне первичного транскрипта гена дистрофина.
Из этих методов особое внимание привлекает техника направленной утраты
экзона, несущего мутантный стоп-кодон, разработанная в лаборатории Джорджа Диксона в Великобритании. Работа выполнялась in vitro на миобластах mdx-мышей mdx с нонсенс-мутацией в 23 экзоне гена дистрофина. В условиях in vitro было показано что уже через 6 часов после трансфекции специфическими олигонуклеотидами (антисенс-олигонуклеотидами) удаление мутантного 23 экзона происходило в 50% мРНК и в 100% мРНК через 24 часа. Перспективность данного подхода заключается в том, что миобласты начинают синтезировать полноразмерный белок дистрофина, хотя и дефектный по одному функционально несущественному экзону. Будучи пересаженными больному модифицированные миобласты смогут восстанавливать функцию и предотвращать гибель пораженных мышечных волокон.Несмотря на теоретическую обоснованность метода до внедрения его в клиническую практику пока ещё далеко. В недавно проведённых клинических испытаниях на 12 пациентах с еженедельным подкожным введением АОН, направленного на экзон 51 (PRO051), был показан рост экспрессии дистрофина у 10, а также улучшение функциональных показателей ходьбы через 3 месяца у 8 из них.
Слайд 56 Активизация экспрессии утрофина – аутосомного гомолога гена дистрофина.
Суть метода заключается в попытке дерепрессии аутосомного гомолога дистрофина
— гена утрофина, продукт экспрессии которого мог бы быть способен компенсировать недостаток дистрофина во всех группах мышц. В эмбриогенезе человека приблизительно до семи недель развития дистрофин не экспрессируется и его функцию в мышцах выполняет белок утрофин. В промежутке между седьмой и 19 неделями развития экспрессируются оба белка и после 19 недели происходит замещение мышечного утрофина на дистрофин. После 19 недели эмбрионального развития утрофин обнаруживается только в области нервно-мышечных контактов. Белок утрофин, имея аутосомную локализацию разительно напоминает дистрофин своими N- и С- концевыми доменами, играющими решающую роль в функции дистрофина, тогда как функционально малозначимый домен центрального стержня присутствует в утрофине в сильно укороченном варианте. Уже получены данные свидетельствующие о том, что трансфекция mdx мышей in vivo геном утрофина приводит к экспрессии утрофина в скелетной мускулатуре и диафрагме. Результаты экспериментов указывают на принципиальную возможность коррекции дефектов в мышечных волокнах лишенных дистрофина с помощью утрофина. Основное внимание последних лет в этом направлении сосредоточено на анализе промоторной области гена утрофина, а также механизмов его регуляции. К настоящему времени идентифицирован промотор В гена утрофина, воздействуя на который можно включать и изменять уровень экспрессии этого гена. Слайд 57 Аминогликозиды. Аминогликозидные антибиотики (в частности, гентамицин) показали свою эффективность
в угнетении стоп-кодонов (с появлением которых связано около 15%
мутаций при миодистрофии Дюшенна) в культуре клеток in vitro. Тем не менее, попытки введеиня гентамици на в дозах 7,5 мг/кг/сут пациентам не привели к достоверному клиническому эффекту.Аталурен (PTC124). Пероральный препарат, не относящийся к группе антибиотиков, который стимулирует рибосомальное считывание нонсенс-мутаций (стоп-кодонов) у mdx-мышей. Клинические испытания низких доз (10-20 мг/кг/сут) аталурена на сохранивших способность к ходьбе пациентах с миодистрофией Дюшенна показали улучшение двигательных функций по сравнению с группой плацебо.
Оксандролон. Анаболический стероид, обладающий минимальным андрогенным и вторичным эстрогеноподобным эффектом, малотоксичный для печени, оказывающий мощное стимулирующее действие на синтез миозина в скелетной мускулатуре и тем самым способствующий наращиванию мышечной массы. Многие исследователи рекомендуют краткосрочный курс терапии оксандролоном (не более 20 мг/сут в течение 3 месяцев) до начала преднизолонотерапии – это ускоряет рост и замедляет прогрессирование мышечной слабости.
Иммунодепрессанты. Попытки применения азатиоприна успехом не увенчались. Имеются данные о некотором улучшении функции у детей, в течение 8 месяцев получавших терапию циклоспорином, однако, из-за возможности развития циклоспорин-индуцируемой миопатии целесообразность этого метода лечения остаётся спорной.
Слайд 58 Пересадка стволовых клеток. Активно изучаемое направление, пока остающееся в
рамках клинического эксперимента. Изоляция и трансплантация клеток-спутников (миосателлитоцитов) в
экспериментах на mdx-мышах показала многообещающие результаты. То же касается и пересадки мезенхимальных стволовых клеток.Пересадка миобластов. Её эффективность при миодистрофии Дюшенна не доказана.
Креатин. Приём креатина моногидрата в дозе 5г/сут не показал статистически достоверного клинического эффекта, несмотря на свою неплохую переносимость и доказанный эффект снижения уровня миостатина, поэтому данный препарат нельзя рекомендовать в качестве обязательного для применения при миодистрофии Дюшенна.
Ингибиторы гистон-деацетилаз. Препараты этой группы (трихостатин А, вальпроевая кислота, фенилбутират) показали свою эффективность на mdx-мышах, стимулируя экспрессию фоллистатина – ингибитора миостатина.
Ингибиторы (антагонисты) миостатина. Миостатин – белок, который подавляет рост и дифференцировку мышечной ткани. Образуется в мышцах животных, затем выделяется в кровь, оказывая свое действие на мышцы за счет связывания с рецепторами ACVR2B (activin type II receptor). В экспериментах на mdx-мышах введение ингибиторов миостатина привело к росту мышечной массы, снижению уровня КФК сыворотки и улучшению гистологической картины. Однако, клинические испытания препарата MYO-029 (стамулумаба) были завершены уже на фазе I/II из-за отсутствия статистически достоверного эффекта. Кроме того, остаётся неясным, выгодно ли долгосрочное лечение мышечной дистрофии с использованием ингибиторов миостатина, поскольку истощение стволовых клеток мышц может ухудшить течение болезни на более поздних стадиях.
Слайд 59 Массаж: сила воздействия минимальна, акцент на улучшение трофики
кожных покровов и сохранных мышц
Дозированная лечебная физкультура с
элементами stretch-гимнастики.При начальных проявлениях контрактур, ретракции сухожилий: фиксацию конечности в положении достигнутой коррекции контрактуры суставов, шины, валики для профилактики контрактур, фиксацию конечностей в физиологическом положении на ночь с использованием туторов; с целью адаптации передвижения с оптимальной коррекцией деформаций используются стельки, ортопедическая обувь, надколенники.
При доброкачественных формах миодистрофий в стадии компенсации возможно проведение оперативного вмешательства, направленного на предупреждение и избавление контрактур, сухожильных ретракций, коррекцию деформаций





























