- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Сера, селен, теллур.
Содержание
- 2. Сера, селен и теллур – это элементы главной подгруппы VI группы, члены семейства халькогенов.
- 3. СераСера принадлежит к числу веществ, известных человечеству
- 4. ТеллурВ одной из областей Австрии, которая называлась
- 5. селенСелен является одним из элементов, который человек знал
- 6. ПолучениеМетод окисления сероводорода до элементарной серы был
- 7. Соду затем выщелачивают водой, а водную суспензию
- 8. Селеновая кислота при нагревании с соляной кислотой
- 9. Для выделения Te из шламов используют их
- 10. Для осаждения теллура через раствор пропускают воздух
- 11. Физические свойства
- 12. химические свойстваНа воздухе сера горит, образуя сернистый ангидрид —
- 13. Расплав серы реагирует с хлором, при этом
- 14. Из сложных веществ следует отметить прежде всего
- 15. При 100–160°C окисляется водой: Te+2H2O= TeO2+2H2 При кипячении в
- 16. Разбавленная HNO3 окисляет Te до теллуристой кислоты H2TeO3: 3Te+4HNO3+H2O=3H2TeO3+4NO. Сильные
- 17. При нагревании на воздухе сгорает с образованием
- 18. При кипячении в щелочных растворах селен диспропорционирует: 3Se
- 19. Если селен кипятят в щелочном растворе, через
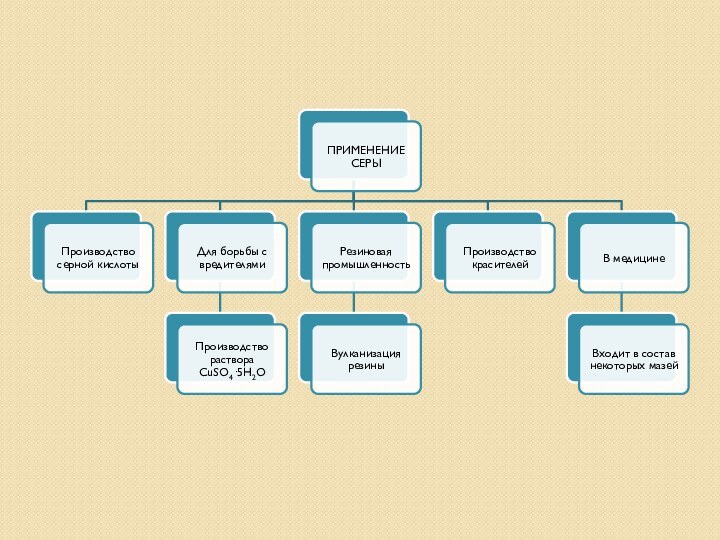
- 21. Основное применение Te и его соединений —
- 22. Аморфный Se входит в состав светочувствительных слоев
- 23. Скачать презентацию
- 24. Похожие презентации
Сера, селен и теллур – это элементы главной подгруппы VI группы, члены семейства халькогенов.






















Слайд 2
Сера, селен и теллур – это элементы главной
подгруппы VI группы, члены семейства халькогенов.
Слайд 3
Сера
Сера принадлежит к числу веществ, известных человечеству испокон
веков. Ещё древние греки и римляне нашли ей разнообразное
практическое применение. Куски самородной серы использовались для совершения обряда изгнания злых духов.
Слайд 4
Теллур
В одной из областей Австрии, которая называлась Семигорьем,
в XVIII веке была открыта странная руда голубовато- белого
цвета.
Слайд 5
селен
Селен является одним из элементов, который человек знал еще
до его официального открытия. Этот химический элемент очень хорошо
маскировался другими химическими элементами, которые по своим характеристикам были похожи на селен. Основными элементами маскирующими его были сера и теллур.
Слайд 6
Получение
Метод окисления сероводорода до элементарной серы был впервые
разработан в Великобритании, где значительные количества серы научились получать
из остающегося после получении соды Na2CO3 по методу французского химика Н. Леблана сульфида кальция CaS. Метод Леблана основан на восстановлении сульфата натрия углем в присутствии известняка CaCO3.Na2SO4 + 2C = Na2S + 2CO2;
Na2S + CaCO3 = Na2CO3 + CaS
Слайд 7 Соду затем выщелачивают водой, а водную суспензию плохо
растворимого сульфида кальция обрабатывают диоксидом углерода
CaS + CO2 + H2O
= CaCO3 + H2S Образующийся сероводород H2S в смеси с воздухом пропускают в печи над слоем катализатора. При этом за счет неполного окисления сероводорода образуется сера
2H2S + O2 = 2H2O +2S
Слайд 8 Селеновая кислота при нагревании с соляной кислотой восстанавливается
до селенистой кислоты. Затем через полученный раствор селенистой кислоты
пропускают сернистый газ SO2H2SeO3 + 2SO2 + H2O = Se + 2H2SO4
Для очистки селен далее сжигают в кислороде, насыщенном парами дымящей азотной кислоты HNO3. При этом сублимируется чистый диоксид селена SeO2. Из раствора SeO2в воде после добавления соляной кислоты селен опять осаждают, пропуская через раствор сернистый газ.
Слайд 9 Для выделения Te из шламов используют их спекание
с содой с последующим выщелачиванием. Те переходит в щелочной
раствор, из которого при нейтрализации он осаждается в виде TeO2Na2TeO3+2HC=TeO2+2NaCl.
Для очистки теллура от S и Se используют его способность под действием восстановителя (Al) в щелочной среде переходить в растворимый дителлурид динатрия Na2Te2
6Te+2Al+8NaOH=3Na2Te2+2Na[Al(OH)4].
Слайд 10
Для осаждения теллура через раствор пропускают воздух или
кислород:
2Na2Te2+2H2O+O2=4Te+4NaOH.
Для получения теллура особой чистоты его хлорируют:
Te+2Cl2=TeCl4.
Образующийся тетрахлорид очищают
дистилляцей или ректификацией. Затем тетрахлорид гидролизуют водой: TeCl4+2H2O=TeO2Ї+4HCl,
а образовавшийся ТеО2 восстанавливают водородом:
TeO2+4H2=Te+2H2O.
Слайд 12
химические свойства
На воздухе сера горит, образуя сернистый ангидрид — бесцветный
газ с резким запахом:
S + O2 → SO2
Восстановительные свойства серы
проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только со фтором:S + 3F2 → SF6
Слайд 13 Расплав серы реагирует с хлором, при этом возможно
образование двух низших хлоридов
2S + Cl2 → S2Cl2
S +
Cl2 → SCl2При нагревании сера также реагирует с фосфором, образуя смесь сульфидов фосфора, среди которых — высший сульфид P2S5:
5S + 2P → P2S2
Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием:
S + H2 → H2S (сероводород)
C + 2S → CS2 (сероуглерод)
Слайд 14 Из сложных веществ следует отметить прежде всего реакцию
серы с расплавленной щелочью , в которой сера диспропорционирует
аналогично хлору:3S + 6KOH → K2SO3 + 2K2S + 3H2O
С концентрированными кислотами-окислителями сера реагирует только при длительном нагревании:
S+ 6HNO3 (конц) → H2SO4 + 6NO2↑ + 2H2O
S+ 2 H2SO4 (конц) → 3SO2↑ + 2H2O
Слайд 15
При 100–160°C окисляется водой:
Te+2H2O= TeO2+2H2
При кипячении в щелочных
растворах теллур диспропорционирует с образованием теллурида и теллурита:
8Te+6KOH=2K2Te+ K2TeO3+3H2O.
Слайд 16
Разбавленная HNO3 окисляет Te до теллуристой кислоты H2TeO3:
3Te+4HNO3+H2O=3H2TeO3+4NO.
Сильные окислители
(HClO3, KMnO4) окисляют Te до слабой теллуровой кислоты H6TeO6:
Te+HClO3+3H2O=HCl+H6TeO6.
Соединения
теллура (+2) неустойчивы и склонны к диспропорционированию:
2TeCl2=TeCl4+Te. Слайд 17 При нагревании на воздухе сгорает с образованием бесцветного
кристаллического SeO2:
Se +O2 = SeO2.
С водой взаимодействует при нагревании:
3Se +
3H2O = 2H2Se + H2SeO3. Селен реагирует при нагревании с азотной кислотой, с образованием селенистой кислоты H2SeO3:
3Se + 4HNO3 + H2O = 3H2SeO3 + 4NO.
Слайд 18
При кипячении в щелочных растворах селен диспропорционирует:
3Se +
6KOH = K2SeO3 + 2K2Se + 3H2O.
Если селен кипятят в
щелочном растворе, через который пропускают воздух или кислород, то образуются красно-коричневые растворы, содержащие полиселениды: K2Se + 3Se = K2Se4
Слайд 19 Если селен кипятят в щелочном растворе, через который
пропускают воздух или кислород, то образуются красно-коричневые растворы, содержащие
полиселениды:K2Se + 3Se = K2Se4
Селен взамодействует с сульфидами и полисульфидами с образованием тиоселенидов. При нагревании
селена с растворами Na2SO3 и KCN протекают реакции:
Na2SO3 + Se = Na2SSeO3;
KCN + Se = KSeCN.
Сильные окислители (озон О3, фтор F2) окисляют селен до Se+6:
Se + O3 = SeO3,
Se + 3F2 = SeF6.





























