- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Щелочные металлы
Содержание
- 2. Щелочны́е мета́ллы — это элементы 1-й группы периодической
- 3. Общая характеристика щелочных металловВ Периодической системе они
- 5. Все металлы этой подгруппы имеют серебристо-белый цвет
- 7. 3. Взаимодействие с другими веществами. Щелочные металлы
- 8. Получение щелочных металлов1. Для
- 9. Соединения щелочных металлов1. ГидроксидыДля
- 10. Скачать презентацию
- 11. Похожие презентации



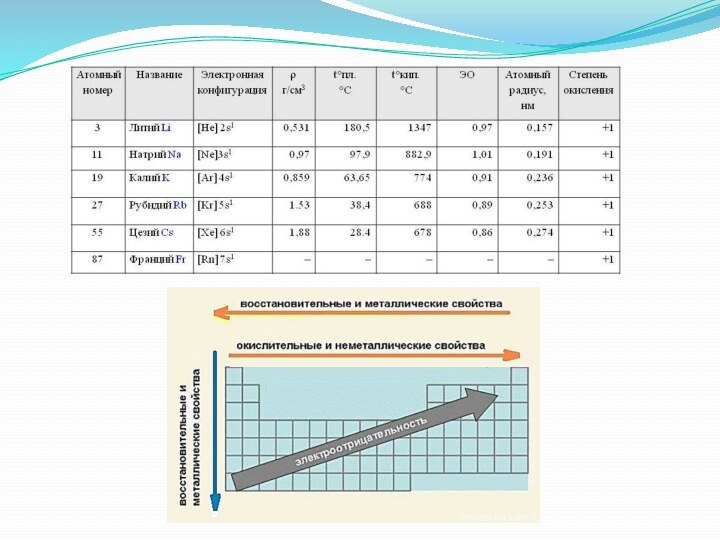






Слайд 3
Общая характеристика щелочных металлов
В Периодической системе они следуют
сразу за инертными газами, поэтому особенность строения атомов щелочных
металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1. Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства. В большинстве соединений щелочные металлы присутствуют в виде однозарядных катионов.Слайд 5 Все металлы этой подгруппы имеют серебристо-белый цвет (кроме
серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем.
Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Слайд 6
Химические свойства щелочных металлов
1. Взаимодействие с водой. Важное свойство щелочных металлов —
их высокая активность по отношению к воде. Наиболее спокойно (без взрыва)
реагирует с водой литий:При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв.
Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком
металла в отсутствие кислорода:
Слайд 7 3. Взаимодействие с другими веществами. Щелочные металлы реагируют
со многими неметаллами. При нагревании они соединяются с водородом
с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов:4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
Слайд 8
Получение щелочных металлов
1. Для получения щелочных металлов
используют в основном электролиз расплавов их галогенидов, чаще всего —
хлоридов, образующих природные минералы:катод: Li+ + e → Li
анод: 2Cl− — 2e → Cl2
2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:
катод: Na+ + e → Na
анод: 4OH− — 4e → 2H2O + O2
3. Щелочной металл может быть восстановлен из соответствующего хлорида или бромида кальцием, магнием, кремнием и др. восстановителями при нагревании под вакуумом до 600-900 °C:
Слайд 9
Соединения щелочных металлов
1. Гидроксиды
Для получения гидроксидов щелочных
металлов в основном используют электролитические методы. Наиболее крупнотоннажным является
производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:катод:
анод:
Гидроксиды щелочных металлов при нагревании возгоняются без разложения, за исключением гидроксида лития, который так же, как гидроксиды металлов главной подгруппы II группы, при прокаливании разлагается на оксид и воду:
1. Соли
Важным продуктом, содержащим щелочной металл, является сода Na2CO3. Основное количество соды во всём мире производят по методу Сольве, предложенному ещё в начале XX века. Суть метода состоит в следующем: водный раствор NaCl, к которому добавлен аммиак, насыщают углекислым газом при температуре 26 — 30 °C. При этом образуется малорастворимый гидрокарбонат натрия, называемый питьевой содой:





























