Слайд 2
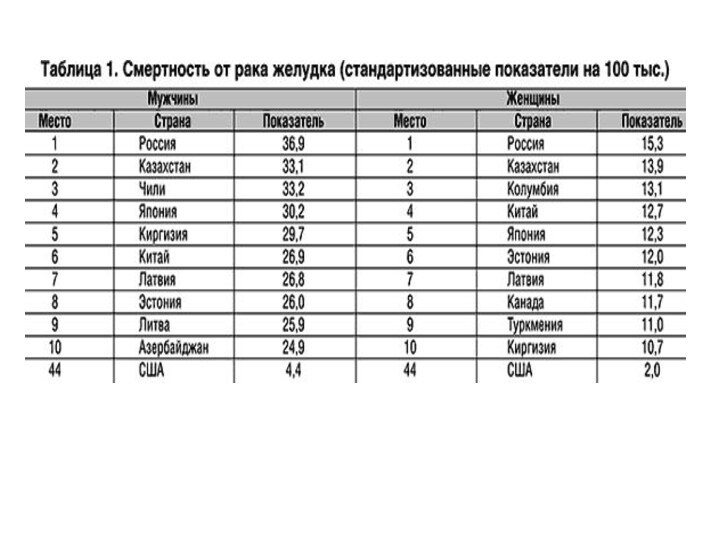
Заболеваемость и смертность рака желудка
Во многих странах
рак желудка – самая частая злокачественная опухоль.
На
долю рака желудка приходится около 15,5% от всех злокачественных новообразований и 20,8% умерших от злокачественных новообразований.
В РК ежегодно первично регистрируется ЗО желудка от 2650 до 2700 больных (8,8%). Рак желудка стабильно занимает 4-ое ранговое место. Среди мужского населения рак желудка занимает 2-ое место( 12%), а среди женщин – 4-ое(6,2%).
Смертность от рака желудка
20,8% смертности от всех ЗО в мире.
По РК – 12,7%.
Слайд 7
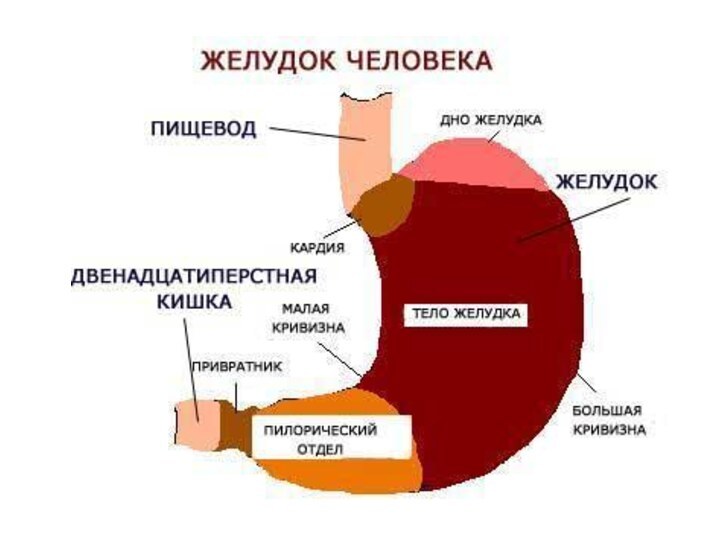
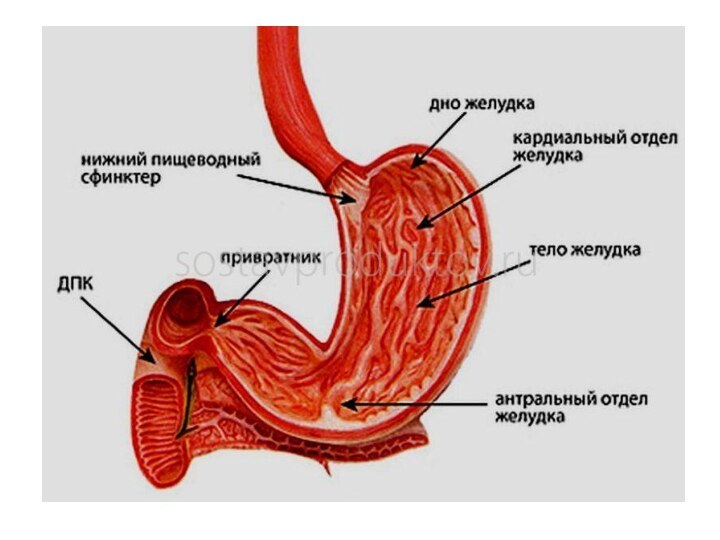
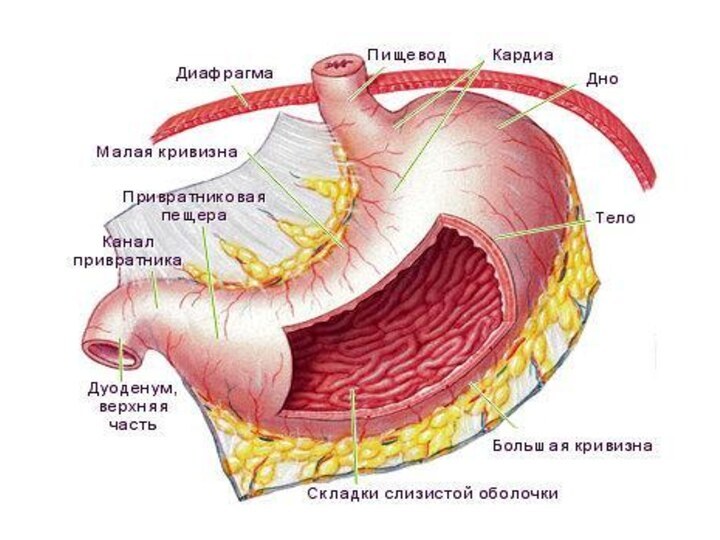
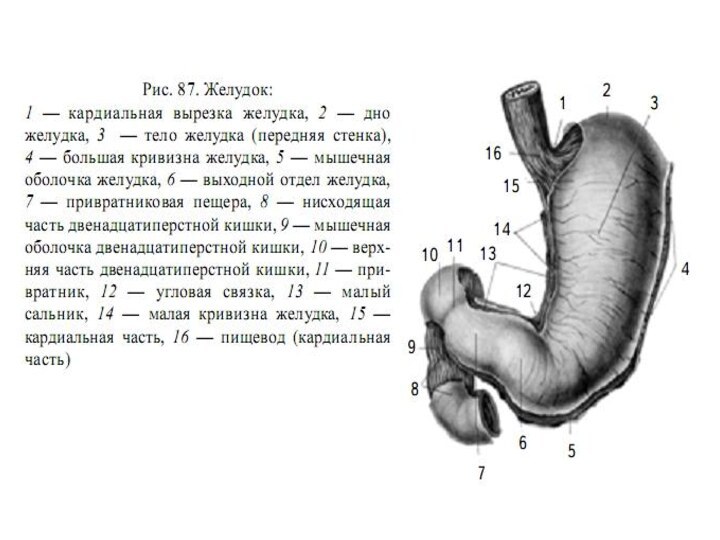
Оболочки желудка.
Стенка желудка состоит из трех оболочек:
наружной
– брюшины (серозная оболочка)
средней – мышечной
внутренней –
слизистой.
Слайд 8
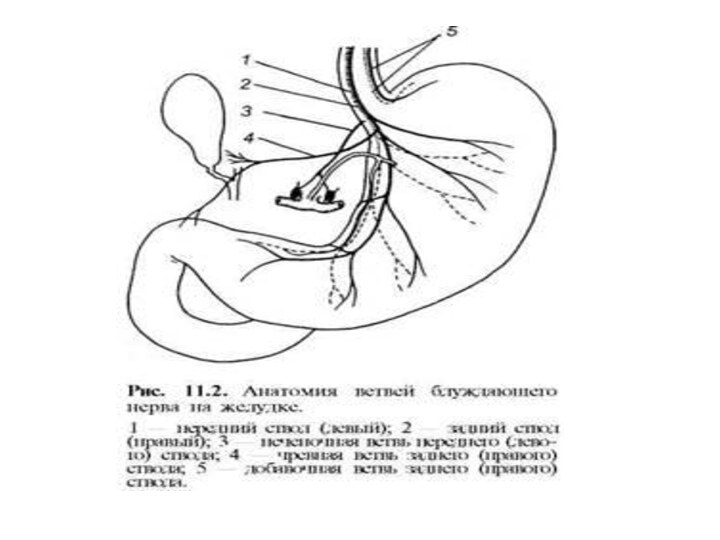
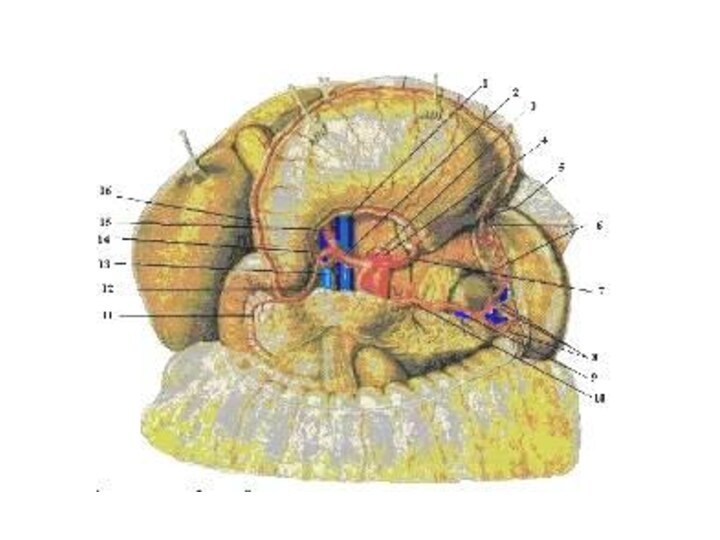
Иннервация и кровоснабжение желудка.
Иннервация: ветви n. vagus и
truncus sympathies.
Слайд 10
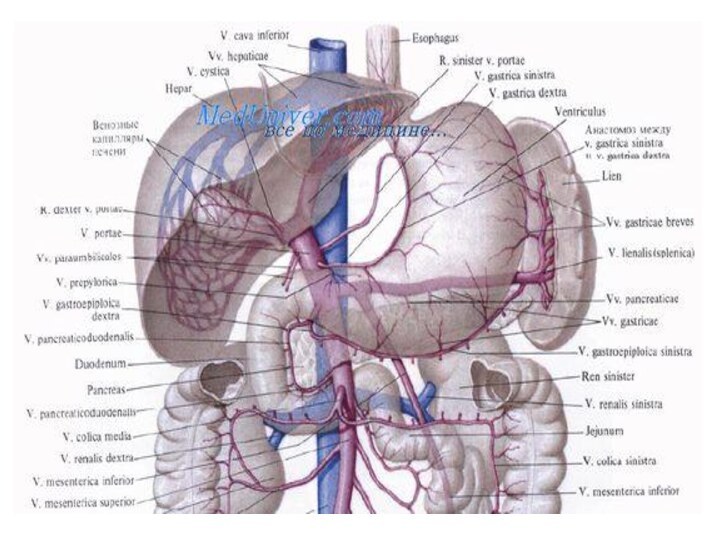
Кровоснабжение:
- со стороны малой кривизны –a.
gastrica dextra (из a. hepatica propria) и a. gastrica
sinistra (из truncus celiacus)
- со стороны большой кривизны –аа. gastroepiploicae dextra (из a. gastroduodenalis) и a. gastroepiploica sinistra (из a. lienalis)
- в области дна подходят аа. gasiricae breves (от a. lienalis).
Слайд 14
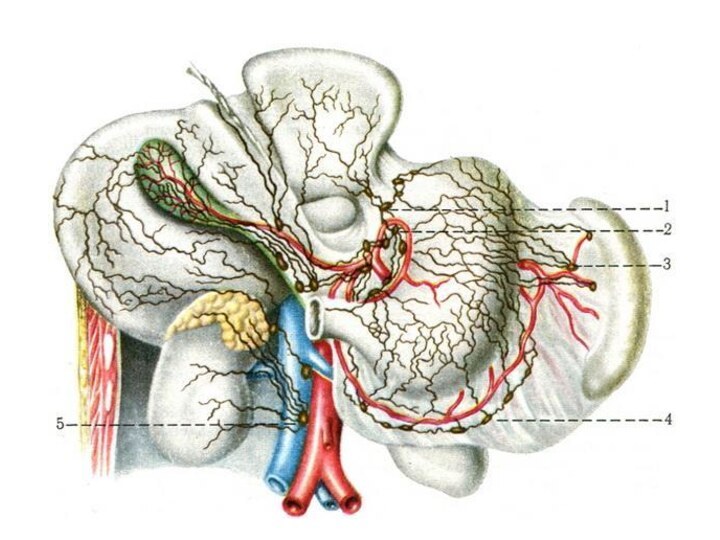
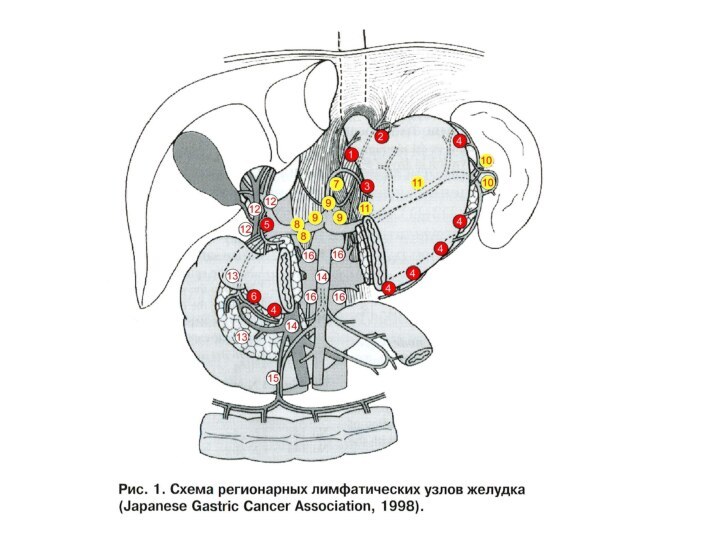
Лимфатические сосуды от кардиальной части, а также от
прилегающих отделов передней и задней стенок и правой половины
дна желудка подходят к кардиальным узлам (anulus lymphaticus cardiust) от малой кривизны и прилегающей к ней участком стенок в nodi lymphatici gastrici sinistri; от привратниковой части – в nodi lymphatici gastrici dextri, hepatici и pylorici;
Слайд 16
Функций желудок
1.Ведущая - переваривание белков до пептонов
в кислой среде.
2. Механическая. В желудке происходит депонирование
пищи (задержка на 2-3 час) и изоляция ее от других отделов благодаря сфинктерам с обеих сторон. В желудке происходит перемешивание и перетирание пищи до полужидкой консистенции (химус). Периодическая эвакуация пищи в 12 п.к.
3. Экзокринная секреторная функция.
Желудочный сок:
· ферменты в основном секретируются главными клетками желез: пепсиноген (расщепляет белки до пептонов), химозин (створаживает молоко), липаза (переваривание жиров), лизоцим (расщепление оболочек бактерий).
Слайд 17
Функций желудок
4. Эндокринная, гормон-секретирующая функция - образование
гормонов (серотонин, гистамин, гастрин, соматостатин, простагландины), участвующих в регуляции
секреторной и двигательной активности.
5. Метаболическая. Происходит всасывание воды, моносахаридов, солей, спиртов, некоторых лекарственных веществ.
6. Экскреторная. Через стенку выводятся аммиак, мочевина.
7. Участвует в регуляции водно-солевого обмена и рН крови.
Слайд 19
Классификации рака желудка
По локализации:
антральный отдел – 60-70%.
по малой
кривизне – 10-15%.
кардиальный отдел – 8-10%.
на передней и задней
стенках желудка – 2-5%.
по большой кривизне – 1%.
на дне желудка – 1%.
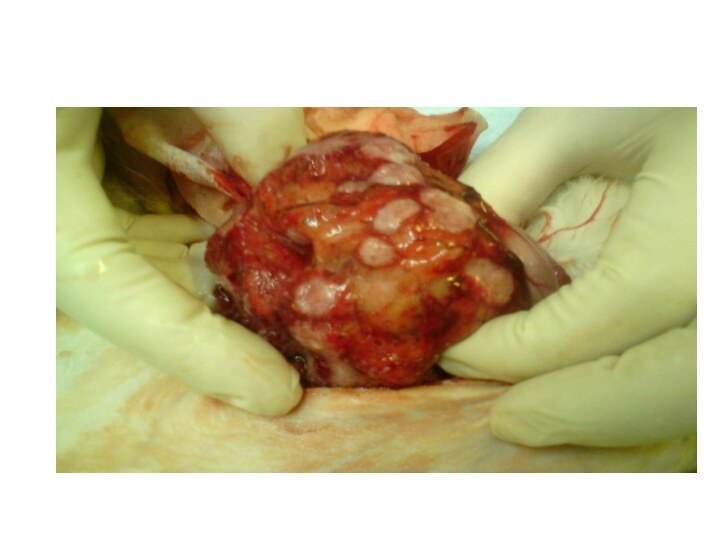
По внешнему виду:
полипозный (грибовидный).
блюдцеобразный.
диффузный.
язвенно-инфильтративный.
По гистологической структуре:
недифференцированный. Мелко- и крупноклеточный рак.
дифференцированный. Железистый рак (аденокарцинома), фиброзный рак (скирр), смешанные и редкие формы.
Слайд 24
Этиология рака желудка
Развитие рака желудка может быть обусловлено
многими причинами, более вероятна мультифакториальная его этиология. Можно предположить,
что развитие злокачественной опухоли желудка включает гистологические изменения, начинающиеся от атрофии слизистой оболочки желудка с последующим развитием метаплазии, дисплазии и злокачественных изменений.
Слайд 25
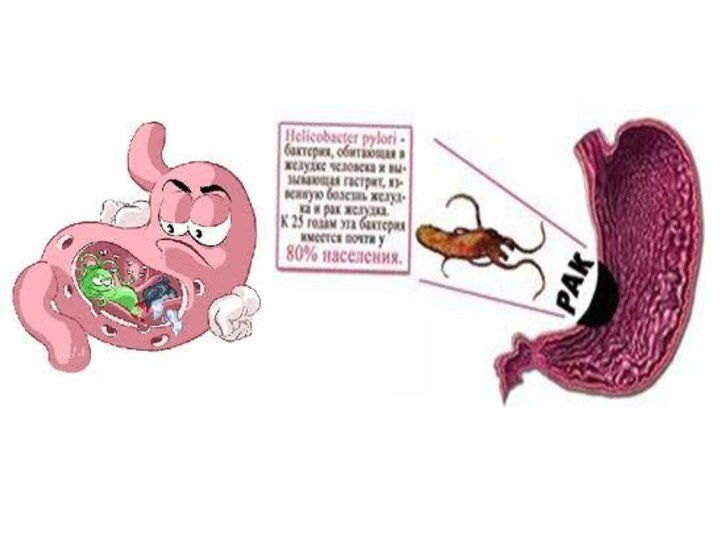
Роль HP в этиологии язвенной болезни желудка была
доказана, включение антибиотиков в схемы противоязвенной терапии было настолько
успешным, что в развитых странах практически полностью отказались от хирургического лечения язвенной болезни
В 1926 году датчанин Johannes Andreas Grib Fibiger, директор Института патологической анатомии получил Нобелевскую премию за открытие инфекционной природы рак желудка.
Инфекционный фактор
Слайд 27
Генетические факторы
Генетические факторы играют значимую роль в
возникновении рака желудка. Примеры генетического наследования заболевания наблюдались веками,
наиболее показательной в этом отношении является семья Бонапартов: Наполеон, его отец Чарльз, дед Джозеф, а также несколько потомков Наполеона умерли от рака желудка. Пациенты с наследственным неполипозным колоректальным
раком (синдром Линча II), аутосомно-доминантным заболеванием с высокой степенью пенетрантности, имеют крайне высокий риск развития рака желудка. Кроме того, риск развития заболевания у ближайших родственников больных раком желудка в 2-3 раза выше. В пользу генетических факторов говорит и высокая частота рака желудка, в основном диффузного типа, у пациентов с группой крови А(П).
Слайд 28
Классификация TNMСтадии рака желудка устанавливают по классификации TNM.
T (tumor) - опухоль (ее размеры), N (nodulus) -
узлы (наличие метастазов в лимфатических узлах), M (metastasis) - наличие отдаленных метастазов.
Опухоль T1 проникает в стенку до подслизистой основы.
Опухоль T2 проникает до субсерозной оболочки.
Опухоль T3 прорастает серозную оболочку.
Опухоль T4 распространяется на прилежащие структуры.
N0 – нет признаков метастатического поражения лимфатических узлов.
N1 – имеются метастазы в перигастральные лимфатические узлы.
N2 – имеются метастазы в регионарные лимфатические узлы.
M0 – метастазы отсутствуют.
M1 – имеются отдаленные метастазы.
Стадия I: T1N0, T1N1, T2N0, все – M0.
Стадия II: T1N2, T2N1,T3N0 , все – M0.
Стадия III: T2N2, T3N1,T4N0, все – M0.
Стадия IV: T4N0M0, любые варианты с M1.
Слайд 29
гистологической классификацией рака желудка, предложенной Lauren в 1953

г., различают
1. Интестинальный (эпидемический) тип рака желудка, характеризующийся экспансивным
ростом и сохранением железистой структуры, менее инвазивным ростом и наличием четких контуров опухоли, часто ассоциирующийся с атрофическим гастритом. Интестинальный тип рак желудка по Lauren соответствует типу 1 или II рака желудка по Borrmann; развитие его связано с воздействием факторов окружающей среды, он обладает более благоприятным прогнозом, наследственность не влияет на возникновение этого типа опухоли.
2. Диффузный, или инфильтративный, тип (эндемический), состоящий из кластеров низкодифференцированных клеток и характеризующийся отсутствием четких контуров опухоли. Диффузный тип рака желудка менее ассоциирован с воздействием факторов окружающей среды или рациона питания и чаще встречается в молодом возрасте. Возникновение диффузного типа рака желудка коррелирует с генетическими факторами, группой крови, наследственностью.
Для описания макроскопических параметров опухоли исследователи применяют различные схемы классификации рака желудка.
Слайд 30
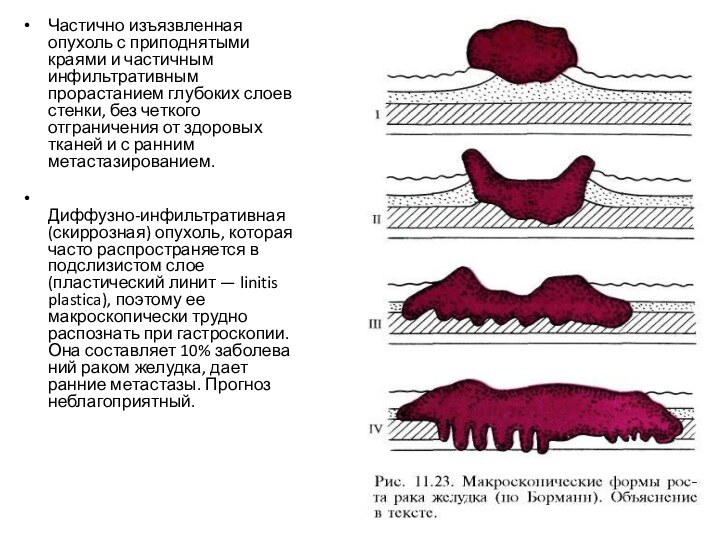
В соответствии с рекомендацией Борманн (1926) по макроскопическому
виду выделяет четыре группы рака желудка (рис. 11.23).
Полипоидная —
солитарная, хорошо отграниченная карцинома без изъязвления. Прогноз относительно благоприятный. Встречается в 5% случаев.
Изъязвленная карцинома ("рак-язва") с блюдцеобразно приподнятыми, четко очерченными краями, макроскопически трудно отличимая от доброкачественной язвы. Обладает менее экспансивным ростом, составляет 35% всех заболеваний раком желудка.
Слайд 31
Частично изъязвленная опухоль с приподнятыми краями и частичным
инфильтративным прорастанием глубоких слоев стенки, без четкого отграничения от
здоровых тканей и с ранним метастазированием.
Диффузно-инфильтративная (скиррозная) опухоль, которая часто распространяется в подслизистом слое (пластический линит — linitis plastica), поэтому ее макроскопически трудно распознать при гастроскопии. Она составляет 10% заболеваний раком желудка, дает ранние метастазы. Прогноз неблагоприятный.
Слайд 32
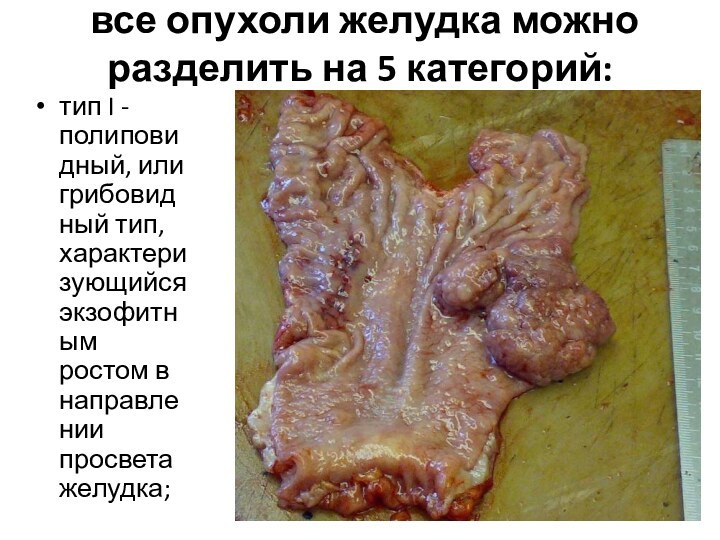
все опухоли желудка можно разделить на 5
категорий:
тип I - полиповидный, или грибовидный тип, характеризующийся экзофитным
ростом в направлении просвета желудка;
Слайд 33
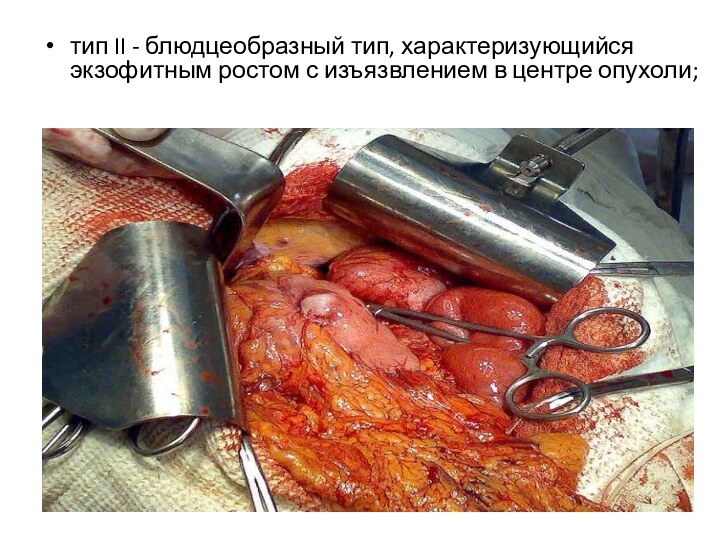
тип II - блюдцеобразный тип, характеризующийся экзофитным ростом
с изъязвлением в центре опухоли;
Слайд 34
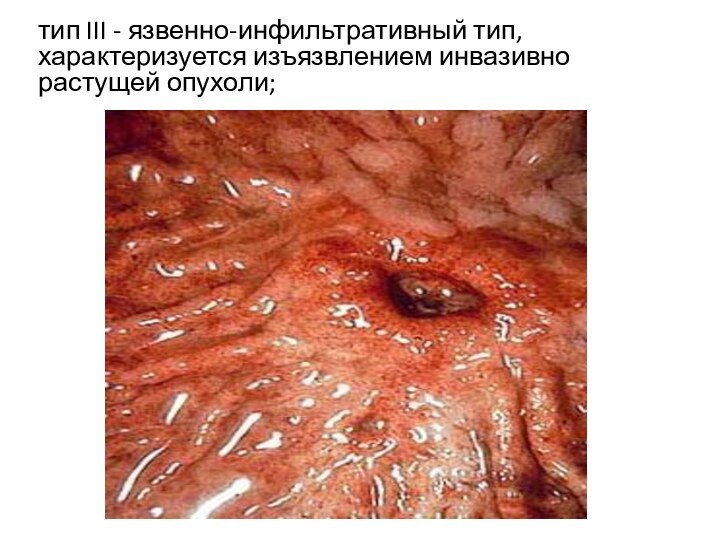
тип III - язвенно-инфильтративный тип, характеризуется изъязвлением инвазивно
растущей опухоли;
Слайд 35
тип IV - диффузно-инфильтративный тип (linitis plastica), характеризующийся
диффузным поражением стенок желудка, с минимальным поражением слизистой оболочки
и диффузным поражением остальных слоев стенки желудка. Опухоль длительное время протекает малосимптомно, что приводит к тому, что абсолютное большинство пациентов поступает в клинику в запущенном состоянии;
тип V - неклассифицируемый рак, характеризующийся сочетанием признаков других вышеперечисленных типов опухоли
Гистологические формы рака желудка
В 95% случаев случаев
аденокарцинома
Плоскоклеточный рак
Лимфома.
гастроинтестинальные стромальные опухоли (ГИСО) и нейроэндокринные опухоли.
Слайд 37
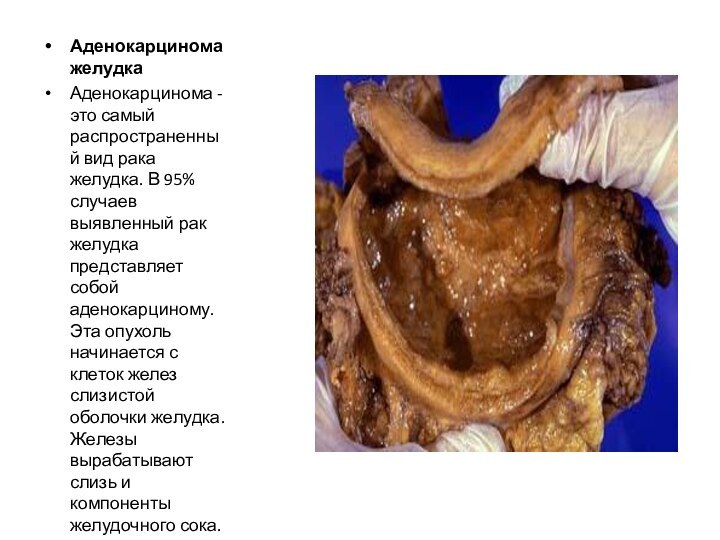
Аденокарцинома желудка
Аденокарцинома - это самый распространенный вид рака
желудка. В 95% случаев выявленный рак желудка представляет собой
аденокарциному. Эта опухоль начинается с клеток желез слизистой оболочки желудка. Железы вырабатывают слизь и компоненты желудочного сока.
Слайд 38
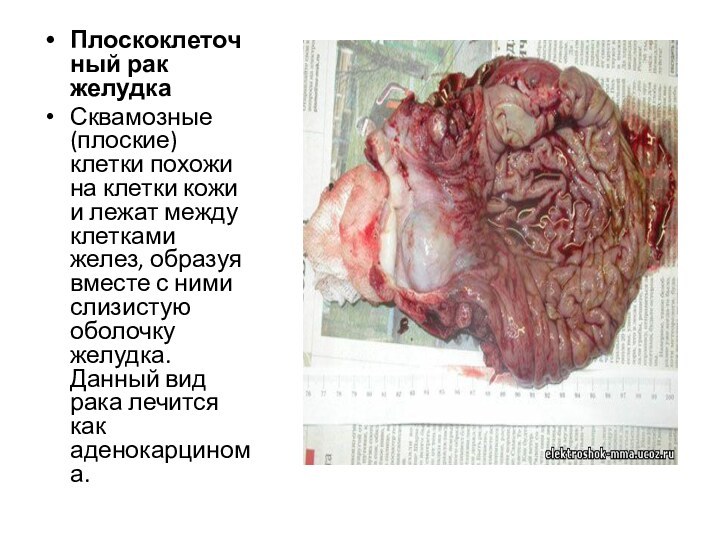
Плоскоклеточный рак желудка
Сквамозные (плоские) клетки похожи на клетки
кожи и лежат между клетками желез, образуя вместе с
ними слизистую оболочку желудка. Данный вид рака лечится как аденокарцинома.
Слайд 39
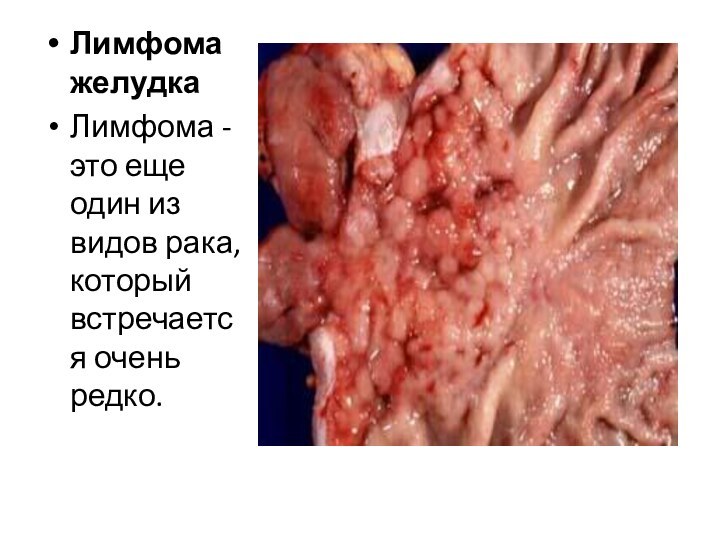
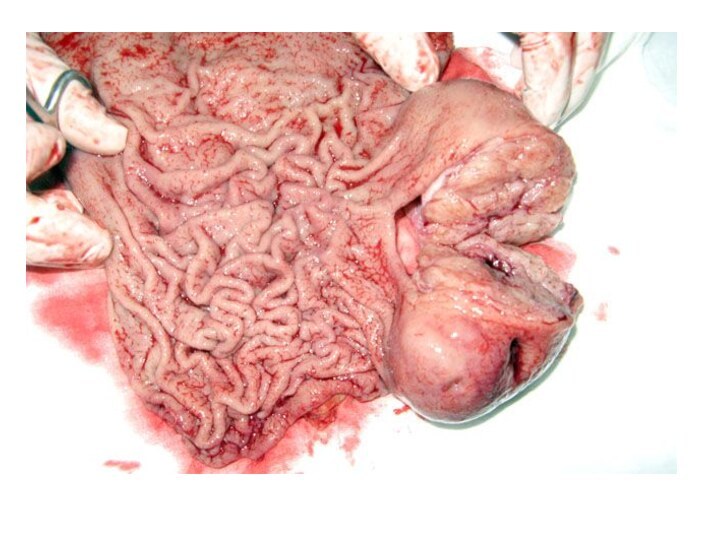
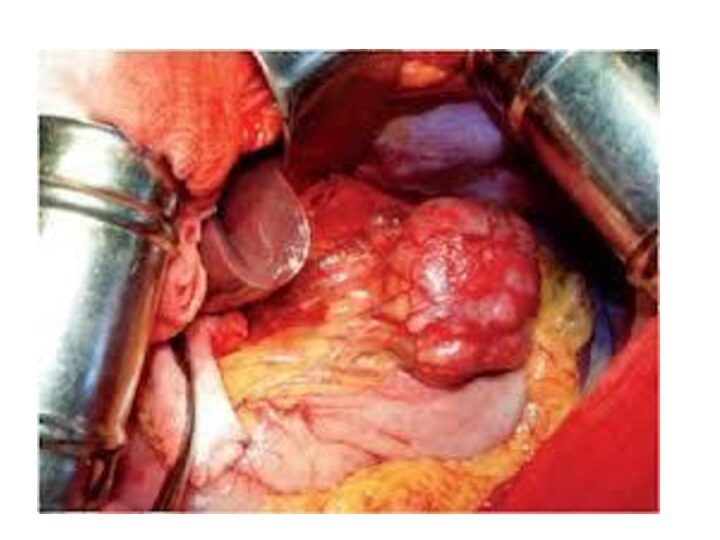
Лимфома желудка
Лимфома - это еще один из видов
рака, который встречается очень редко.
Слайд 40
Гастроинтестинальная стромальная опухоль, или саркома (ГИСО)
Саркомой называется злокачественная
опухоль, которая поражает соединительные или защитные ткани организма. Гастроинтестинальной
стромальной саркомой называется опухоль, которая начинается с мышечного слоя желудка. Она крайне редка.
Слайд 42
РАК ЖЕЛУДКА – ТИПЫ РОСТА
Экзофтиный тип: то есть, когда
опухоль растет в просвет органа. Этот тип роста рака
включает такие формы, как полиповидный (наиболее благоприятный в плане прогноза, но и самый редкий), блюдцеобразный (наиболее характерный тип роста рака желудка), бляшковидный и другие.
Слайд 44
Эндофитный тип: то есть, когда опухоль прорастает стенку органа.
Для этого типа характерны такие формы роста, инфильтративно-язвенный, диффузно-фиброзный
и другие.
Слайд 45
Смешанный тип.
В 60 % случаев рак поражает пилороантральный
отдел – то есть конечные отделы желудка, в 20
% - малую кривизну и в 10 % - кардиальный отдел (начальный отдел желудка).
Слайд 46
Клиника рака желудка
На ранних стадиях признаки
рака желудка могут быть достаточно размытыми и нечеткими.
К ним относится:
Нарушение пищеварения, изжога, отрыжка
Чувство раннего насыщения
Кровотечение; утомляемость и одышка на фоне кровопотери
Образование тромбов
Боль или неприятные ощущения в области желудка
Тошнота и рвота
Затруднение глотания
Потеря аппетита, похудание (обычно являются симптомами более распространенного рака)
Слайд 47
ощущение «распирания живота» или незначительная боль в
конце приема пищи это характерна для антрального отдела желудка.
Опухоль
кардиального отдела желудка у 60% пациентов может проявиться дисфагией, что свидетельствует об обструкции более 80% просвета абдоминального отдела пищевода или кардии.
Слайд 48
Диагностика рака желудка
Лабораторные исследования
железодефицитная микроцитарная гипохромная анемия. Даже
при раннем раке у 20% больных отмечается снижение уровня
гемоглобина.
Среди биохимических показателей можно отметить незначительное повышение уровня активности лактатдегидрогеназы и щелочной фосфотазы и снижение уровня альбумина, некоторых фракций белков, железа и ферритина в сыворотке крови.
Проба на скрытую кровь в кале может быть отрицательной примерно у половины больных с распространенным раком желудка. Вместе с тем, положительная бензидиновая проба может быть характерна для пациентов с патологией в любом отделе ЖКТ: пептические язвы, эрозии, гингивит, рефлюкс-эзофагит, геморрагический гастрит, гемобилия, колит, полипы толстой кишки, колоректальный рак, геморроидальные узлы.
Слайд 49
Лабораторные исследования
Анализ кала на скрытую кровь может давать
ложноположительный результат, особенно если больной накануне употреблял в пищу
бифштексы с кровью, репу, брокколи и редис. У людей старше 40 лет положительный результат служит показанием для исследования толстой кишки (колоноскопия либо ректороманоскопия + ирригоскопия с двойным контрастированием).
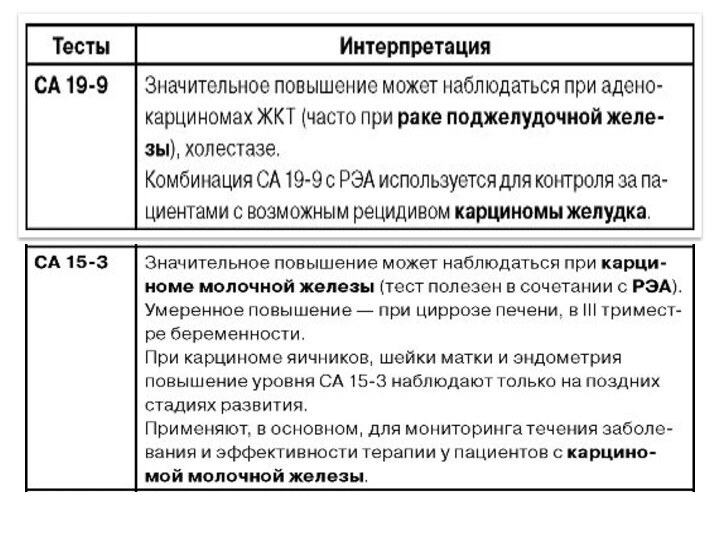
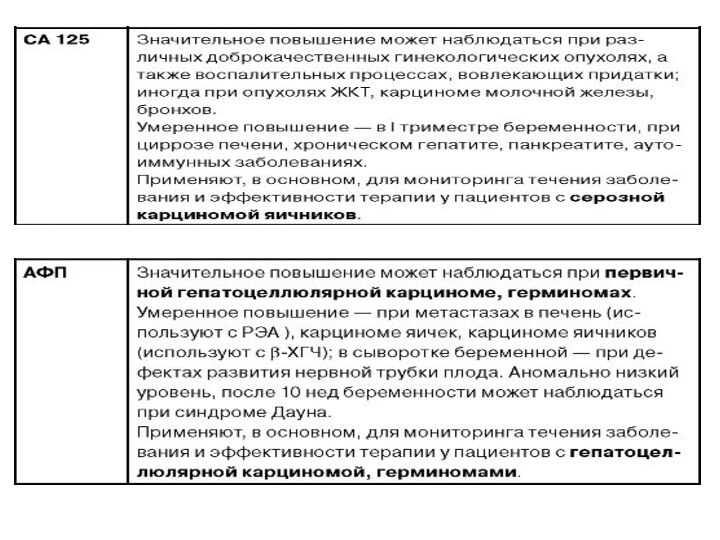
Уровень опухолевых маркеров не повышается при раннем раке желудка. Наиболее характерными для распространенного рака желудка являются СА19-9, СА50, СА72-4, СА546 и РЭА. Высоко- и умеренно дифференцированные опухоли характеризуются повышением уровня как минимум 2-3 маркеров, в то время как у пациентов с низко- и недифференцированными опухолями желудка уровень маркеров не повышается. Многофакторный анализ свидетельствует о том, что опухолевые маркеры являются независимыми факторами прогноза и по своей значимости уступают лишь критериям Т, N и М.
Слайд 52
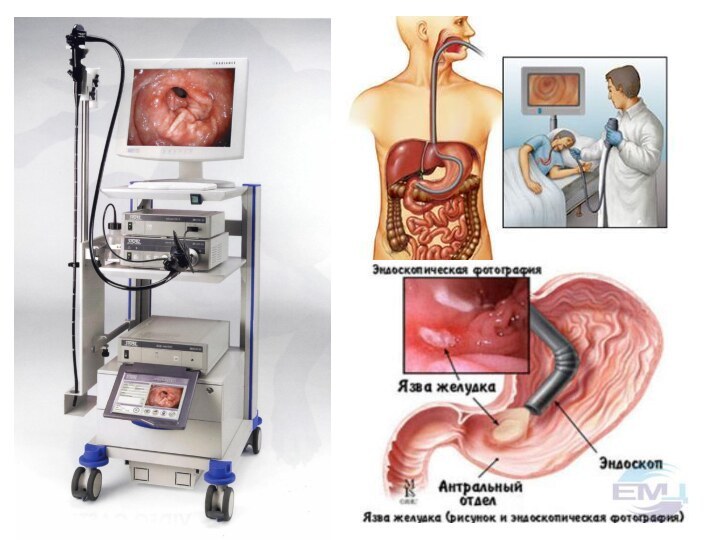
Эндоскопическое исследование
направлено на решение следующих двух задач: скрининг
для выявления больных с неопухолевыми патологическими изменениями слизистой оболочки
и формирования групп риска;
выявление раннего рака желудка.
Слайд 54
Биопсия – забор ткани для морфологического исследования.
Если исследование показывают, что у пациента рак желудка, необходимо дальнейшее
обследования для определения распространенности опухоли, тогда проводится эндоскопическое ультразвуковое исследования, ПЭТ-КТ или МРТ.
Слайд 56
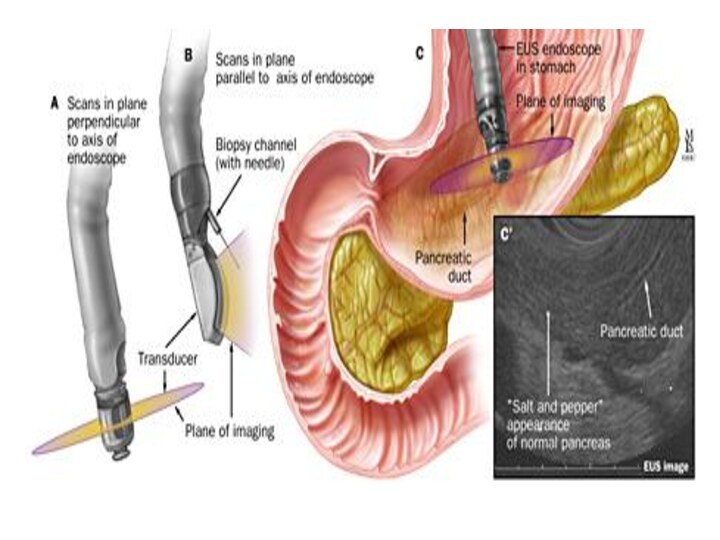
Эндоскопическое ультразвуковое исследование
Прямой контакт ультразвукового датчика
со стенкой желудка позволяет получить высокую степень разрешения при
визуализации слоев стенки органа. Это делает эндосонографию идеальным методом для оценки глубины инвазии
Слайд 58
Эндосонография
Одной из приоритетных задач эндосонографии в последнее время
становится оценка эффекта проведенной неоадъювантной терапии, так как в
лечении рака желудка все большую роль играет комбинированное лечение. Исследование, выполненное до начала лечения, не обладает прогностической значимостью в отношении возможного эффекта химио- либо химиолучевого лечения. Восстановление структурности стенки желудка, установленное на основании эндоскопического УЗИ, очевидно, является признаком полного эффекта у больного после проведения неоадъювантного лечения, однако в некоторых случаях данные эндосонографии достаточно трудно интерпретировать вследствие развития в первичной опухоли или на ее месте воспалительных и фибротических изменений.
Слайд 60
Рентгенологическое исследование
Рентгенологическое исследование с использованием в качестве контраста
взвеси сульфата бария преследует две главных задачи: скрининг рака
желудка и определение распространенности (глубины инвазии и протяженности) злокачественного процесса.
Слайд 62
Компьютерная томография
Более полная картина поражения других групп лимфоузлов,
так же как и других вовлеченных органов, осуществляется с
помощью компьютерной томографии.У 50% оперированных больных находят во время лапаротомии большую степень поражения, чем это предсказывалось при компьютерной томографии.
Слайд 64
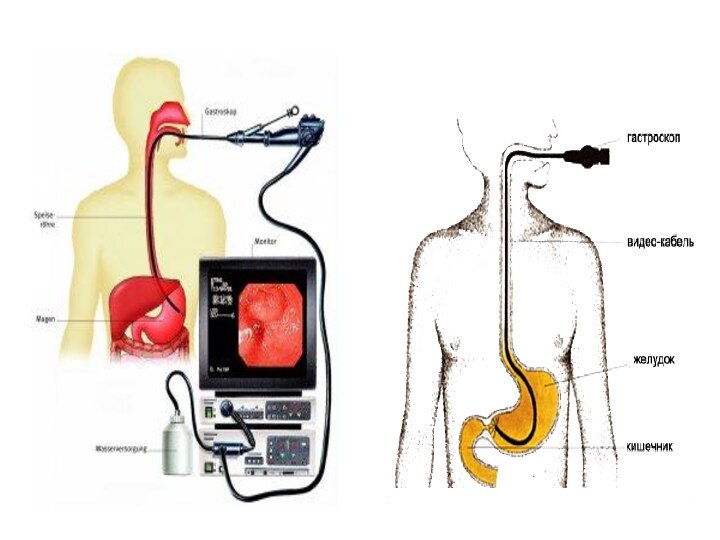
Гастроскопия
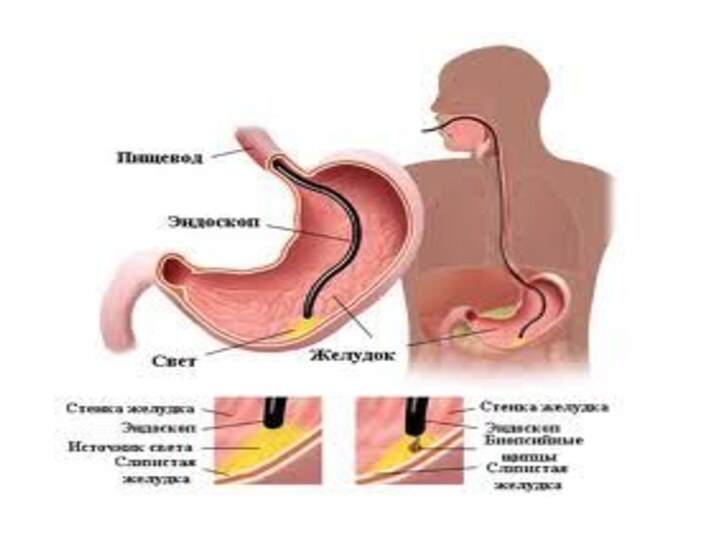
Гастроскопия позволяет повысить точность диагностики до 95%. Этот инвазивный
метод дает возможность видеть опухоль в желудке, выполнить ее биопсию из
подозрительных участков (от 4 до 10 образцов) и смывную и аспирационную цитологию .Специальная техника эндоскопии с прижизненной окраской слизистой (например, 0,1% индигокармином) выявляет миллиметровые опухолевые очаги.
Слайд 66
Ультразвуковая компьютерная томография
Ультразвуковая компьютерная томография органов брюшной полости,
забрюшинного пространства и шейно-надключичных зон позволяет выявить метастатическое поражение
лимфатических узлов в соответствующих анатомических областях, а также отдаленные метастазы в печени и почках.
Слайд 68
Эндоскопическая ультразонография (EUS)
Эндоскопическая ультразонография (EUS) определяет глубину инвазии и характеристику
параметра Т даже у больных со стенозом. У 80%
больных с помощью EUS можно охарактеризовать состояние перигастральных лимфоузлов. Метод объединяет возможности эндоскопии и ультразвуковой томографии.
Слайд 69
ПЭТ-КТ
При ПЭТ-КТ компьютерная томография совмещается с позитронно-эмиссионным сканированием.
ПЭТ-сканер выявляет участки аномальной активности раковых клеток с помощью
введения в организм небольшого количества радиоактивной глюкозы. В некоторых случаях это помогает выявить опухоли верхних отделов желудка.
Слайд 70
Лечение рака желудка
При адекватном лечении раннего рака желудка
выживаемость может превышать 90%. Частота поражения регионарных лимфатических узлов
при TI с инвазией в пределах слизистой оболочки составляет около 4%, с инвазией подслизистого слоя - 23% и коррелирует с такими факторами, как форма роста, наличие изъязвления, размер, степень дифференцировки опухоли. Поэтому при высокодифференцированной опухоли размерами менее 3 см в наибольшем измерении и без признаков изъязвления возможна ее эндоскопическая резекция.
Слайд 71
Хирургическое лечение
Хирургический метод остается основным в лечении рака

желудка. Согласно рекомендациям ESMO (2005 г.), хирургическое лечение рекомендовано
при следующей распространенности опухолевого процесса по системе TNM: Tis-T3N0-N2M0 и T4N0M0. При раке желудка выполняются гастрэктомия или резекции желудка различного объема с удалением связочного аппарата и регионарных лимфатических узлов. Субтотальная проксимальная резекция желудка проводится при экзофитном раке проксимального отдела желудка, не распространяющегося за пределы кардии. Показанием к субтотальной дистальной резекции желудка является экзофитная опухоль дистального отдела желудка, не распространяющаяся проксимальнее угла желудка. При инфильтративных опухолях различной локализации, тотальном поражении, экзофитной опухоли тела желудка показана гастрэктомия. С целью достижения радикальности хирургического вмешательства при типе I и II по Боррманну необходимо отступать более чем на 3 см от проксимального края опухоли, при типе III и IV - на 6 см.
Слайд 72
ЛИМФОДИССЕКЦИИ
При раке желудка показано удаление лимфатических узлов.
По объему
различают следующие виды лимфодиссекции:
D0 — лимфоузлы не удаляются;
D1 — резекция узлов,
расположенных вдоль малой и большой кривизны, супра- и инфрапилорических, малого и большого сальников;
D2 — удаление вышеуказанных узлов и узлов второго уровня;
D3 — то же + резекция лимфоузлов по ходу чревного ствола;
D4 — включает удаление тех же узлов, что при D3, с удалением парааортальных узлов;
Dn — резекция всех регионарных лимфатических узлов, удаление пораженных опухолью желудка органов.
Радикальность операции обеспечивают варианты D2-D4
Слайд 73
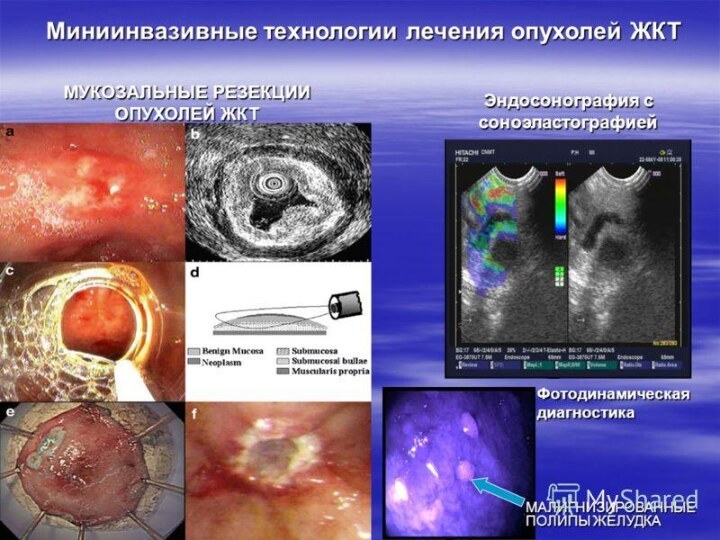
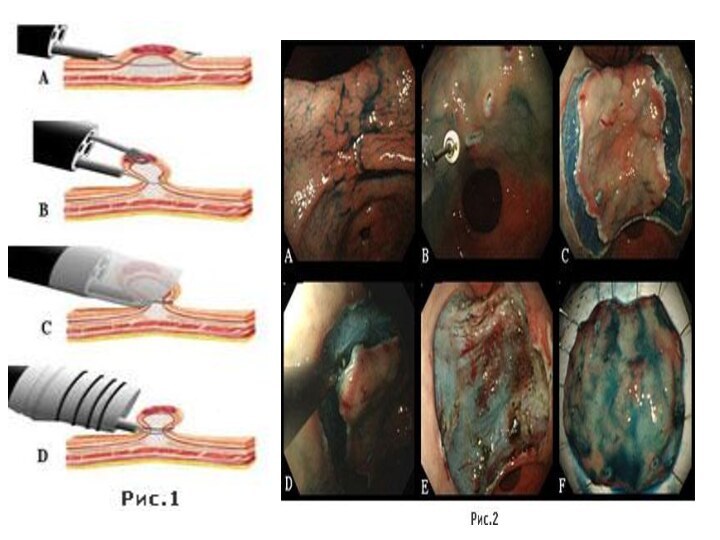
ЭНДОСКОПИЧЕСКАЯ ХИРУРГИЯ ОПУХОЛЕЙ ЖЕЛУДКА
(Наблюдение д.м.н. О.А.Малиховой с соавт.)
Рис.
1. ЭТАПЫ ЭНДОСКОПИЧЕСКОЙ МУКОЗЭКТОМИИ С ИСПОЛЬЗОВАНИЕМ ДВУХКАНАЛЬНОГО ЭНДОСКОПА.
А) Подведение
эндоскопической петли к опухоли.
В-С) Захват и подтягивание опухоли.
D) Затягивание коагуляционной пели, коагуляция опухоли.
Рис. 2. ЭНДОСКОПИЧЕСКАЯ РЕЗЕКЦИЯ СЛИЗИСТОЙ С ДИССЕКЦИЕЙ ПОДСЛИЗИСТОГО СЛОЯ.
А) Эндофото патологического очага (окраска индигокармином).
В) Маркировка краев резекции. Применение ножа с керамическим наконечником (IT-knife; от Intra Tumor). Отдаление линии резекции от опухоли – более 0,5-0,7 см.
С) Рассечение слизистой оболочки.
D) Этап диссекции подслизистого слоя.
E) Вид пострезекционной язвы желудка. Дно язвы – мышечный слой стенки желудка (срок заживления 1,0-1,5 мес).
F) Удаленный препарат (резецированный участок слизистой оболочки).
Слайд 75
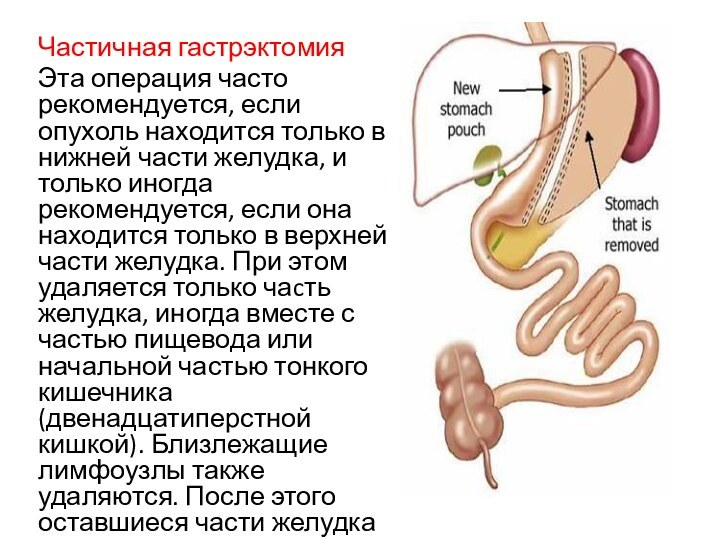
Частичная гастрэктомия
Эта операция часто рекомендуется, если опухоль находится
только в нижней части желудка, и только иногда рекомендуется,
если она находится только в верхней части желудка. При этом удаляется только чаcть желудка, иногда вместе с частью пищевода или начальной частью тонкого кишечника (двенадцатиперстной кишкой). Близлежащие лимфоузлы также удаляются. После этого оставшиеся части желудка соединяются
Слайд 76
Полная гастрэктомия
Эта операция проводится, если рак распространился по
всему желудку, также она рекомендуется, если опухоль находится в
верхней части желудка, рядом с пищеводом. Она подразумевает полное удаление желудка и близлежащих лимфоузлов, а также может включать удаление селезенки, части пищевода, кишечника, поджелудочной железы и других близлежащих органов.
Слайд 77
Хирургическое лечение
Опубликованные данные не позволяют утверждать преимущество одного
объема хирургического вмешательства над другим. Объем лимфодиссекции является предметом
спора до сегодняшнего дня. Лимфодиссекция D2 является стандартным объемом при выполнении хирургического вмешательства по поводу рака желудка в соответствии с рекомендациями JCGC. В проведенных в Японии клинических исследованиях выявлено улучшение выживаемости при отсутствии увеличения частоты осложнений и смертности пациентов, подвергшихся гастрэктомии с лимфодиссекцией D2.
Слайд 78
В онкологии лучевая терапия может
использоваться в качестве основного метода лечения, но обычно применяется
в составе комбинированного лечения, т.е. в сочетании с химиотерапией и/или хирургическим лечением. Так, различают адъювантную (вспомогательную) лучевую терапию – после хирургического удаления опухоли, и неоадъювантную – предшествующую хирургической операции.
В подавляющем большинстве случаев лучевая терапия производится дистанционно, то есть источник излучения находится на некотором расстоянии от тела больного. Однако в некоторых случаях можно вводить источник излучения прямо в область, которую необходимо облучить, или рядом с ней; такой метод лечения называется брахитерапией и часто связан с меньшими побочными эффектами при высокой эффективности.
Слайд 79
Контактная лучевая терапия
Контактное воздействие производится при непосредственном приложении

источника излучения к ткани опухоли, производится интраоперативно или при
поверхностно расположенных новообразованиях. В связи с этим данный метод, пусть и менее вредный для окружающих тканей, используется значительно реже. При внутритканевом (интрастециальном) методе в ткани, содержащие опухолевый очаг, вводятся закрытые источники в виде проволок, игл, капсул, сборок из шариков. Такие источники бывают как временной, так и постоянной имплантации.
Дистанционная лучевая терапия
При дистанционном воздействии между очагом воздействия и источником излучения могут лежать здоровые ткани. Чем их больше, тем сложнее доставить необходимую дозу излучения к очагу, и тем больше побочных эффектов терапии. Но, несмотря на наличие серьёзных побочных эффектов, этот метод наиболее распространён. Это обусловлено тем, что он наиболее универсален и доступен в использовании.
Перспективным является метод протонной терапии, в настоящее время в мире ведётся активное исследование эффективности и безопасности данной методики.
Слайд 80
Радионуклидная терапия
В данном методе радионуклид (как самостоятельный агент

или в составе радиофармпрепарата) накапливается избирательно в тканях, содержащих
опухолевый очаг. При этом используются открытые источники, растворы которых непосредственно вводятся в организм через рот, в полость, опухоль или сосуд. Примером способности некоторых радионуклидов накапливаться преимущественно в определённых тканях могут служить: йод — в щитовидной железе, фосфор — в костном мозге и др.
Количество полученного облучения называется дозой и измеряется в греях (Гр). Рекомендуемая доза при лучевой терапии рассчитывается в зависимости от многих факторов, прежде всего от типа и распространенности опухоли. Больной получает эту дозу не за один, а за целый ряд сеансов, при этом требуемая суммарная доза набирается в ходе всего курса лучевой терапии (например, за несколько недель). Это называется фракционированием. При гиперфракционировании дневная доза дополнительно разбивается на меньшие дозы, получаемые в ходе отдельных сеансов.
Слайд 81
Как правило, при лучевой терапии в качестве ионизирующего
излучения используются рентгеновские или гамма-лучи. Но можно использовать и
облучение пучками частиц. Наиболее известным из таких методов является протонное облучение, использование которого в ряде случаев предпочтительнее благодаря более точной локализации воздействия.
Особый тип облучения, отличающийся от традиционной лучевой терапии, – стереотаксическая радиохирургия, то есть однократное высокоточное и «концентрированное» облучение опухоли с минимальным повреждением окружающих тканей. Этот подход применяется, например, для удаления небольших опухолей центральной нервной системы (технологии «гамма-нож», «кибернож» и др.).
Кибер-нож (англ. CyberKnife) — радиохирургическая система производства компании Accuray, предназначенная для лечения доброкачественных и злокачественных опухолей. Разработана в 1992 году профессором нейрохирургии и радиационной онкологии Стенфордского университета (США) Джоном Адлером
Слайд 82
По заявлению производителя, в настоящее время в мире
установлено около 250 установок кибер-ножа, более 100 000 пациентов получили
лечение. Большинство из этих установок находится в клиниках США, на втором месте — Япония. В меньшей степени — в странах Европы и Азии. Этот метод лечения не является экспериментальным и оплачивается крупными представителями рынка медицинского страхования.
В системе CyberKnife используется высокоэнергетический линейный ускоритель, закрепленный на роботизированной “руке”, имеющей 6 степеней свободы, что позволяет лечить опухолевые клетки с более чем 1800 позиций. Во время процедуры пациент удобно лежит на столе, в это же время сам КиберНож перемещается вокруг пациента, доставляя излучение к опухоли под различными углами.
Слайд 83
Технология КиберНожа модели CyberKnife G4 позволяет очень точно (погрешности менее
0,2 мм) и безопасно для больного доставлять необходимую дозу
облучения к опухоли, не повреждая окружающие здоровые органы. В системе CyberKnife используется высокоэнергетический линейный ускоритель, закрепленный на роботизированной “руке”, имеющей 6 степеней свободы, что позволяет лечить опухолевые клетки с более чем 1800 позиций. Во время процедуры пациент удобно лежит на столе, в это же время сам КиберНож перемещается вокруг пациента, доставляя излучение к опухоли под различными углами.
Кибер нож
Слайд 85
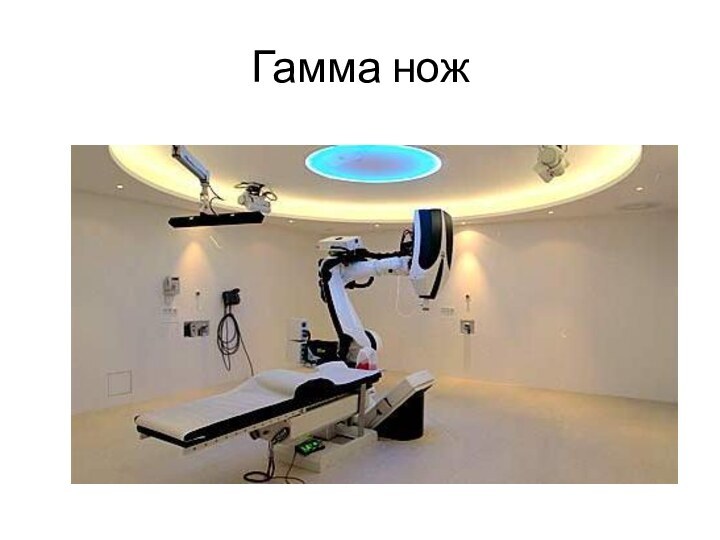
Гамма-нож — установка для стереотаксической радиохирургии патологий головного мозга.
Источниками ионизирующего излучения в Гамма-ноже являются

201 источник 60Co с начальной активностью около 30 Ки (1.1 ТБк)
каждый. Источники фиксированно расположены в защитном кожухе по диаметру полусферы. Дозовое распределение порождаемое источниками близко к сферическому. Диаметр изодозовой сферы определяется вторичным сменным коллимационным шлемом из вольфрама.
Гамма-нож считается «золотым стандартом» в радиохирургии и соответственно на него распространяются все её ограничения — малые размеры патологического очага, отсроченность результата и др., и её преимущества — одномоментность (по сравнению с радиотерапией), отcутствие хирургических рисков, высокая степень конформности
По сравнению с радиохирургией с использованием линейных ускорителей Гамма-нож имеет несколько большую пространственную точность (лучше 0.5 мм), меньшую равномерность дозы внутри мишени (наиболее распространено облучение 50 % изодозой, тогда как на линейных ускорителях используются изодозы 80-90 %). Кроме того, линейные ускорители (в отличие от Гамма-ножа) позволяют лечить кроме головного мозга также и патологии позвоночника (последняя модель Гамма-ножа — Perfexion позволяет лечить также и верхние отделы шеи).
Гамма нож
Слайд 87
Фракционирование
Суммарная доза фракционируют (распространение во времени) в течение
нескольких важных причин. Фракционирование позволяет нормальное время клетки для
восстановления, в то время как клетки опухоли, как правило, менее эффективны в ремонте между фракциями. Фракционирование позволяет опухолевым клеткам, которые были в относительно радио-стойкие фазе клеточного цикла, в течение одного цикла лечения в чувствительной фазе цикла до следующего фракция дается. Кроме того, опухолевые клетки, которые были хронически или острой гипоксической (и, следовательно, более радиорезистентных) может reoxygenate между фракциями, улучшение убить опухолевые клетки. Фракционирование режимы индивидуального между различными центрами лучевой терапии и даже между отдельными врачами.
Слайд 88
. В Северной Америке, Австралии и Европе, типичный
график фракционирования для взрослых составляет от 1,8 до 2
Гр в день, пять дней в неделю. В северной Великобритании, фракции чаще 2,67 до 2,75 Гр в день, что уменьшает нагрузку на ресурсы распылены в Национальную службу здравоохранения. В некоторых типов рака, продление часть графика на слишком долго может позволить опухоль начала заселения, и для этих видов злокачественных новообразований, в том числе головы и шеи и рака шейки матки ячейки плоскоклеточный, лучевая терапия, предпочтительно завершена в течение определенного количества время. Для детей, типичный размер доли может быть от 1,5 до 1,8 Гр в день, а меньших размеров фракции связана со снижением частоты и тяжести с поздним началом побочных эффектов в нормальных тканях.
Слайд 89
Химиотерапия
Химиотерапия в самостоятельном варианте лечения применяется у больных

диссеминированным раком желудка. Основными химиопрепаратами при этом заболевании являются
фторурацил, цисплагин, митомицин и таксаны. По данным литературы, частота объективных эффектов при проведении химиотерапии названными препаратами колеблется от 17 до 30%. Применение химиотерапии, по данным рандомизированных исследований, позволяет продлить жизнь больным с отдаленными метастазами до 12 мес.
При использовании комбинированной химиотерапии эффективность лечения выше. Наиболее часто применяемыми схемами являются PF (цисплатин и фторурацил), ELF (фторурацил, кальция фолинат и лейковорин), FAMTX (фторурацил, доксорубицин, кальции фолинат и метотрексат), PEF (цисплатин, этопозид и фторурацил).
В последнее время получило признание применение таксанов, иринотекана, капецитабина. Применение доцетаксела и цисплатина оказалось эффективным у 37% больных раком желудка.
Виды химиотерапии при раке желудка:
– неоадъювантная химиотерапия;
– адъювантная химиотерапия;
– паллиативная химиотерапия.
Слайд 90
Неоадъювантная химиотерапия
Необходимость химиотерапии на первом этапе комбинированного лечения
рака желудка подтверждена исследованиями на аутопсийном материале, в которых
показано, что уже на ранних этапах рак этой локализации часто приобретет системный характер. Современные исследования по изучению Эффективности лапароскопии и ПЭТ в оценке распространенности опухоли подтверждают этот тезис. Неоадъювантное лечение приводит к уменьшению основной массы опухоли у большинства больных, повышению резектабельности, уменьшает риск интраоперационного обсеменения раны опухолевыми клетками. Кроме того, гистологическое исследование удаленного препарата дает возможность объективно оценить эффект проведенного до операции лечения. Существуют несколько теоретических и экспериментальных обоснований применения химиотерапии именно на предоперационном этапе лечения больных раком желудка.
Слайд 91
Адъювантная химиотерапия
Метастатическое поражение лимфатических узлов является прогностически неблагоприятным

фактором у пациентов, получивших радикальное хирургическое лечение, что дает
основание для попыток улучшения выживаемости у пациентов высокого риска путем использования адъювантной химиотерапии. В литературе опубликовано большое количество клинических испытаний по применению химиотерапии в послеоперационном периоде. Завершенные на сегодняшний день исследования, посвященные изучению роли адъювантной химиотерапии после оперативного лечения, не позволяют сделать окончательных выводов о ее эффективности. Лишь в нескольких из них удалось добиться улучшения результатов лечения в группе с комбинированным лечением по сравнению с больными, которым было проведено только хирургическое лечение. Вместе с тем, мета-анализ всех клинических исследований показывает незначительное, но явное улучшение выживаемости в основной группе больных. Для подтверждения этих данных необходимо проведение тщательно спланированных клинических исследований с использованием новых эффективных препаратов. Наиболее часто применяемыми препаратами являются митомицин, фторурацил, антрациклины. Чаще используется сочетание двух и более препаратов.
Слайд 92
Возможные схемы химиотерапии при раке желудка (наиболее распространенные)
Монотерапия
5-фторурацил 800
мг/м2 24-часовая в/венная инфузия 1–5 день.
Повтор каждый 21 день.
Капецитабин
2500 мг/м2 внутрь 2 раза в день с 1 по 14 день.
Повтор каждый 21 день.
Паклитаксел 135–250 мг/м2 в 1 день.
Повтор каждый 21 день.
Доцетаксел 75–100 мг/м2 в/в кап. в 1 день.
Повтор каждый 21 день.
Полихимиотерапия
ECF
Эпирубицин 50 мг/м2 в 1 день.
5-фторурацил 200 мг/м2 с 1 по 21 дни, постоянная инфузия.
Цисплатин 60 мг/м2 в 1 день.
Повтор каждый 21 день.
ECX
Эпирубицин 50 мг/м2 в 1 день.
Капецитабин 625 мг/м2 2 раза в день с 1 по 21 дни.
Цисплатин 60 мг/м2 в 1 день.
Повтор каждый 21 день.
Слайд 93
Лучевая терапия
Как самостоятельный метод лучевая терапия проводится в
случае локорегионарного рецидива рака желудка после хирургического лечения либо
как дополнительное лечение при наличии опухолевых клеток по линии резекции хирургического препарата. Применение лучевой терапии в адъювантном режиме до настоящего времени остается экспериментальным направлением в лечении рака желудка. Более широкое распространение получило применение лучевой терапии в сочетании с химиотерапией в адъювантном и неоадъювантном режимах. Несмотря на предварительные благоприятные результаты, оно не может быть рекомендовано к широкому применению в предоперационном или послеоперационном лечении.
Слайд 94
Прогноз и выживаемость
Как и при многих других видах
рака, исход и эффективность лечения рака желудка в настоящее
время зависит от стадии заболевания[7].
В большинстве случаев рак желудка выявляется только на поздних стадиях и является уже распространённым, в этом случае общая 5-летняя выживаемость составляет лишь 15 %. Если человек прожил первые 5 лет, то дальнейшая выживаемость повышается — 10-летняя выживаемость составляет 11 %, что лишь на 4 % ниже 5-летней выживаемости.
Для лиц молодого возраста показатели выживаемости выше, чем у пожилых людей. У пациентов младше 50 лет пятилетняя выживаемость составляет 16-22 %, в то время как среди пациентов старше 70 лет этот показатель равен 5-12 %.
Слайд 95
Первая стадия
У пациентов с раком желудка I стадии
высок шанс на полное выздоровление. Пятилетняя выживаемость составляет 80 %,
из них 70 % полностью выздоравливают. На I стадии рак желудка выявляется очень редко и как правило случайно.
Вторая стадия
У пациентов с раком желудка II стадии пятилетняя выживаемость составляет 56 %, из них 48-50 % полностью выздоравливают. На момент диагностики только шесть случаев рака из ста (6 %) имеют вторую стадию.
Слайд 96
Третья стадия
У пациентов с раком желудка III стадии
пятилетняя выживаемость составляет 38 %, из них около 26 % полностью
выздоравливают. У пациентов с раком желудка стадии III b (метастазы) пятилетняя выживаемость составляет лишь 15 %, из них выздоравливают лишь 10 %. На III стадии выявление рака желудка встречается довольно часто.
Четвёртая стадия
У пациентов с раком желудка IV стадии пятилетняя выживаемость обычно не превышает 5 %, а 10-летняя выживаемость составляет 2,3 %. Из них только 1,4 % полностью выздоравливают. На IV стадии выявление рака желудка происходит у 80 % пациентов и является самым распространённым.