- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Презентации по биологии на тему Белки
Содержание
- 2. Задачи урока:Дать понятия о белках- природных полимеров.Объяснить
- 3. Цели:Знать состав белков , уровни организации белковой
- 4. Новые понятия«протеины»«»денатурация»«ренатурация»
- 5. Вопросы для обсуждения:
- 6. Белки— высокомолекулярные органические вещества, состоящие из соединённых
- 7. История изучения. Белки были выделены в
- 8. Свойства.Размер белка может измеряться в числе аминокислот
- 9. Денатурация. Резкое изменение условий, например, нагревание
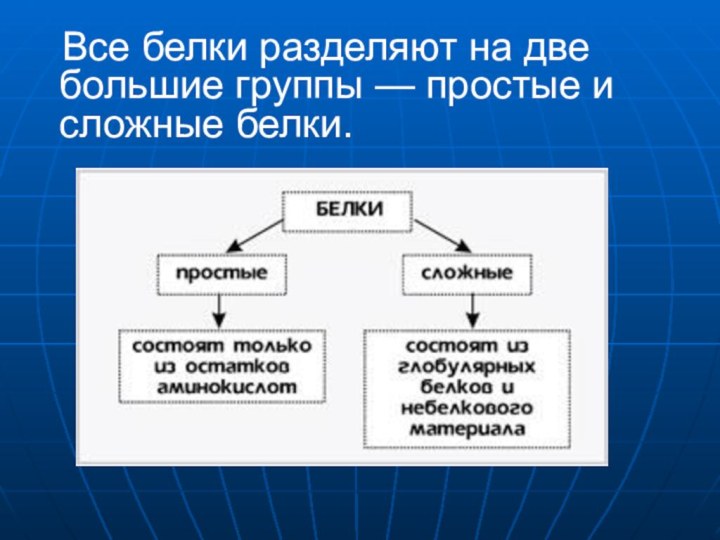
- 10. Все белки разделяют на две большие группы — простые и сложные белки.
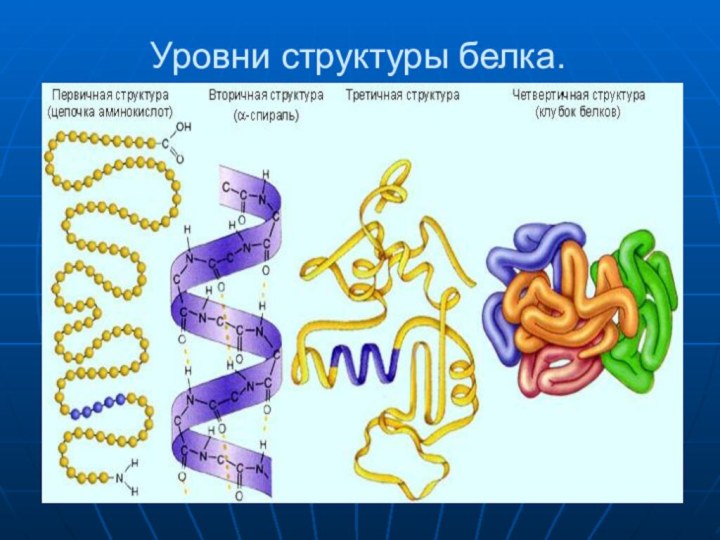
- 11. Уровни структуры белка.
- 12. Первичная структура — последовательность аминокислот
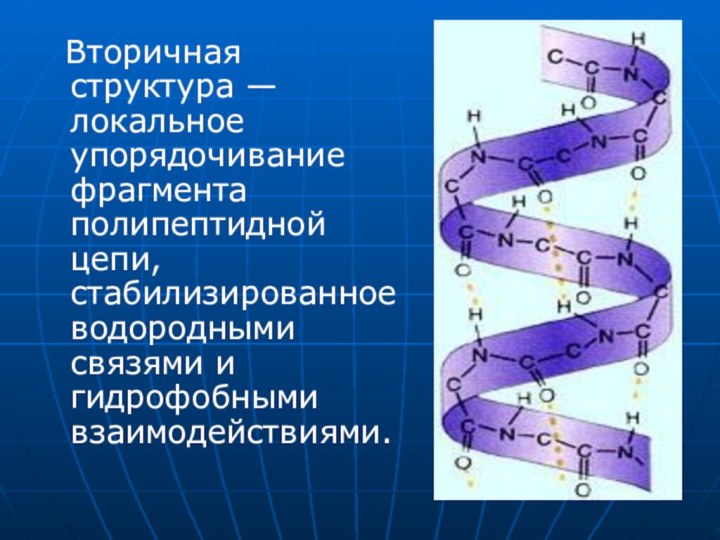
- 13. Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями.
- 14. Третичная структура — пространственное строение
- 15. Четверичная структура — субъединичная структура белка.
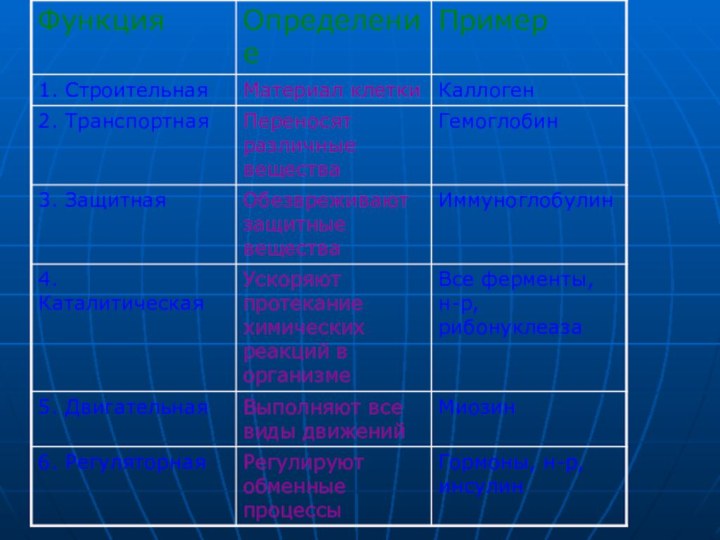
- 16. Функции белков.
- 19. Логический брифинг:
- 20. Скачать презентацию
- 21. Похожие презентации
Задачи урока:Дать понятия о белках- природных полимеров.Объяснить строение макромолекул белка.Углубить знания о связи строения молекул вещества и их функции на примере белков.
















Слайд 2
Задачи урока:
Дать понятия о белках- природных полимеров.
Объяснить строение
макромолекул белка.
их функции на примере белков.
Слайд 3
Цели:
Знать состав белков , уровни организации белковой молекулы,
свойства и функции белков.
Уметь проводить реакции , подтверждающие свойства
белков , качественные реакции на белки.Объяснять функции белков в организме.
Слайд 6 Белки— высокомолекулярные органические вещества, состоящие из соединённых в
цепочку пептидной связью аминокислот. В живых организмах аминокислотный состав
белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс.
Слайд 7
История изучения.
Белки были выделены в отдельный
класс биологических молекул в XVIII веке в результате работ
французского химика Антуана Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот. В то время были исследованы такие белки, как альбумин («яичный белок»), фибрин (белок из крови) и глютен из зерна пшеницы.
Слайд 8
Свойства.
Размер белка может измеряться в числе аминокислот или
в дальтонах , чаще в килодальтонах. Самый большой из
известных в настоящее время белков — титин.Сравнительный размер белков. Слева направо: Антитело, гемоглобин, инсулин, аденилаткиназа и глютаминсинтетаза.