Слайд 2
С полным основанием можно утверждать,
что белки –
самые важные из всех веществ,
входящих в состав организмов
животных
и растений.
Л. Полинг
Слайд 3
Цель:
Продолжить изучение органических
веществ клетки. Рассмотреть
химический
состав, строение и свойства белков
Слайд 4
План изучения нового материала:
1. Белки – органические
вещества, биополимеры.
2. Аминокислотный состав белков.
3.
Химический состав и строение аминокислот.
4. Принцип объединения аминокислотных звеньев в полипептидную молекулу.
5. Пространственные структуры белка.
6. Денатурация и ренатурация белка.
Слайд 5
Молекула белка – макромолекула ( греч. «Макрос»
- большой, гигантский), обладает большой молекулярной массой
Сравните: молекулярная
масса спирта – 46
уксусной кислоты – 60
альбумина (одного из белков яйца) – 36000
гемоглобина – 152000
миозина (белок мышц) – 500000
Слайд 6
В клетке бактерий кишечной палочки - 5 тыс.
молекул органических соединений, из них – 3 тыс. -
белки.
В организме человека более 5 мил. белков
В клетке 10-20% сырой массы и 50-80% от сухой массы клетки составляют белки
белки называют протеинами – это название подчёркивает первостепенную роль этих веществ (греч. «протео» - занимаю первое место)
Без белков невозможно представить движение. способность расти, сократимость, размножение
Слайд 7
Содержание белка в некоторых тканях
(после обезвоживания органа):
Мышцы – 80%;
Почки – 72%;
Кожа – 63%;
Печень – 57%;
Мозг – 45%;
Жировая ткань, кости, зубы – 14 – 28%;
Семена растений – 10 – 15 %;
Стебли, корни, листья – 3% - 5%
Плоды – 1-2%
Слайд 8
Химический состав
В белке следующие химические элементы: С, Н,
О, N, S, P, Fe.
Железо в
гемоглобине крови, фосфор в казеине молока….
Массовая доля элементов:
С – 50% - 55%;
О – 19% - 24%;
Н – 6,5% - 7,3%;
N – 15% – 19%;
S – 0,3% - 2,5%;
P – 0,1% - 2%
Слайд 9
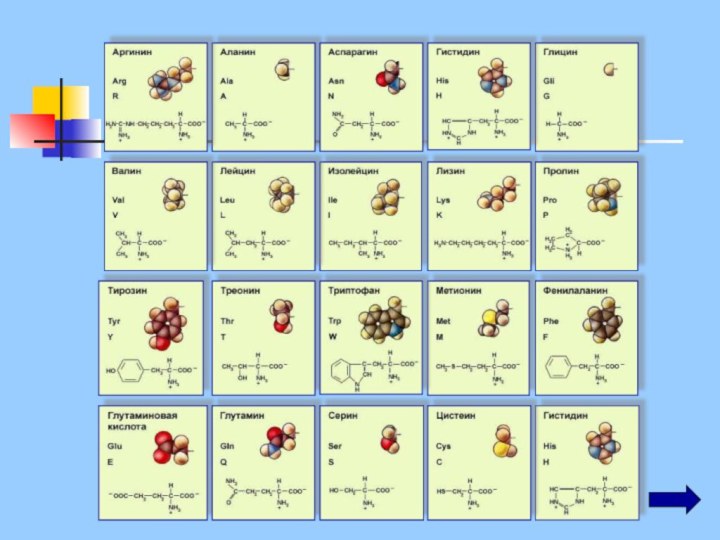
Белки – это нерегулярные полимеры, мономерами которых являются
аминокислоты
в природе существует около 100 α-аминокислот,
в
организме встречается 25
в каждом белке 20, из них может быть образовано 2 432 902 008 176 640 000 комбинаций (~2*1018)
заменимые аминокислоты - они могут синтезироваться в организме
незаменимые - в организме не образуются, их получают с пищей (лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, тирозин, метионин)
Слайд 10
Состав и классификация белков
По составу различают:
протеины, состоящие только
аминокислот,
протеиды – содержащие небелковую часть,
простые белки – состоят из
аминокислот,
сложные – могут включать углеводы (гликопротеиды), жиры (липопротеиды), нуклеиновые кислоты (нуклеопротеиды)
полноценные – содержат весь набор аминокислот
неполноценные – какие-то аминокислоты в них отсутствуют
Слайд 12
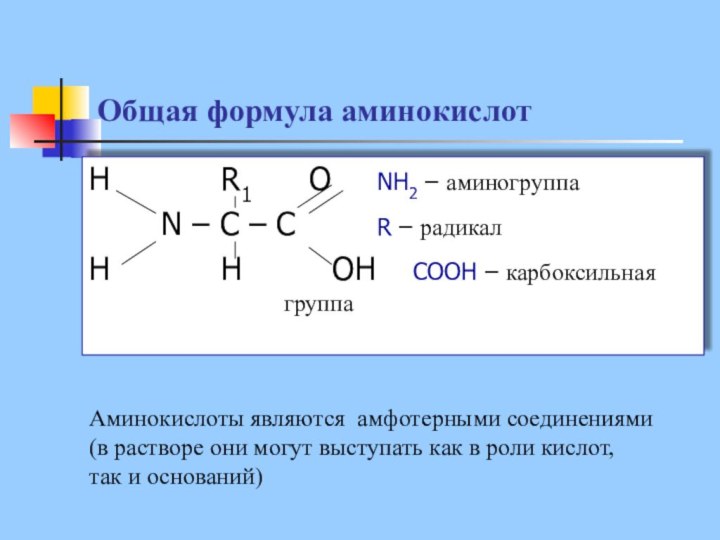
Общая формула аминокислот
H R1 O NH2
– аминогруппа
N – C – C R – радикал
H
H OH COOH – карбоксильная группа
Аминокислоты являются амфотерными соединениями
(в растворе они могут выступать как в роли кислот,
так и оснований)
Слайд 13
Классификация:
моноаминокарбоновые,
моноаминодикарбоновые,
диаминокарбоновые,
моноаминотрикарбоновые.
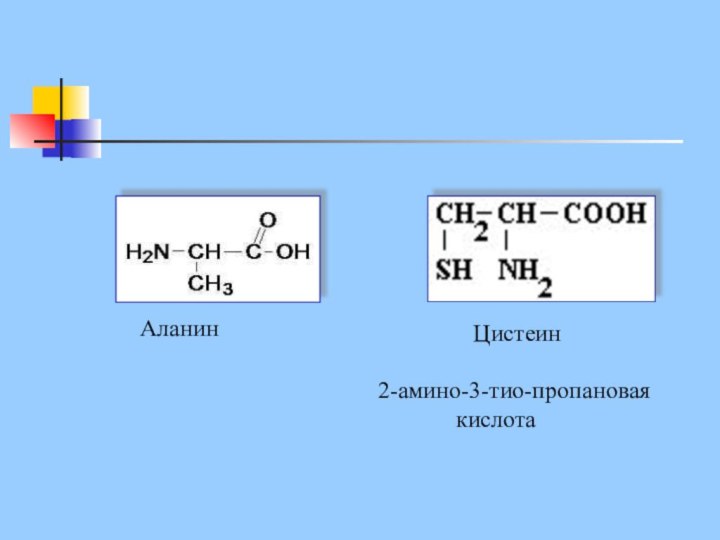
Цистеин
2-амино-3-тио-пропановая кислота
Слайд 15
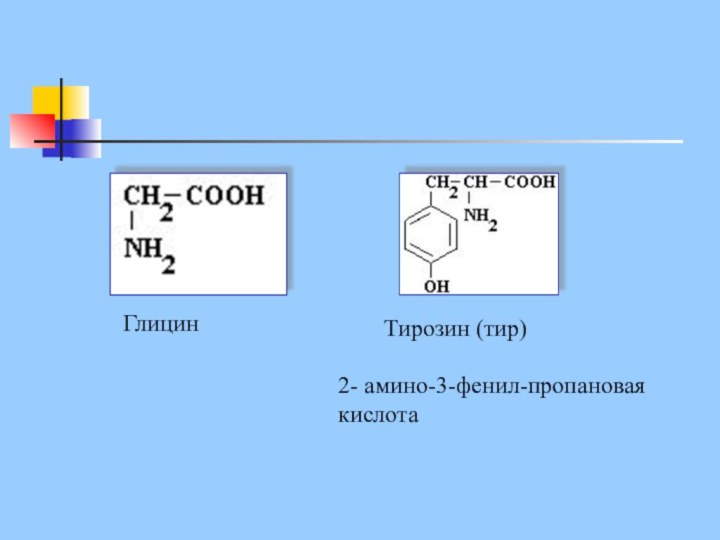
Глицин
Тирозин (тир)
2- амино-3-фенил-пропановая
кислота
–
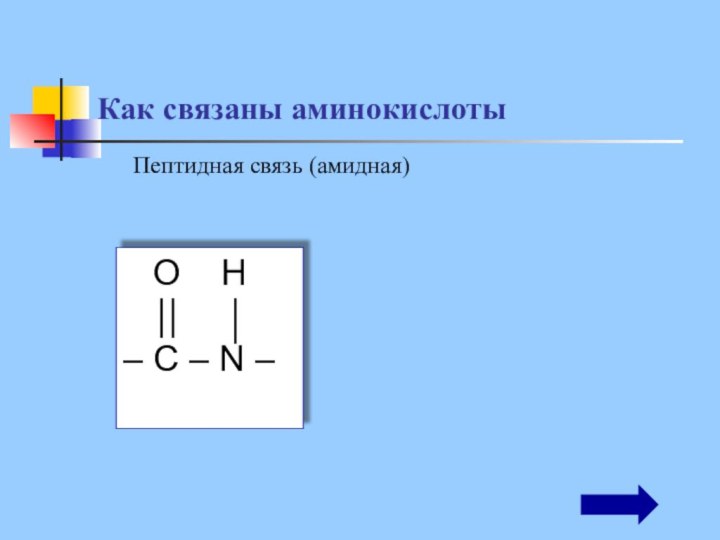
Как связаны аминокислоты
Пептидная связь
(амидная)
Слайд 17
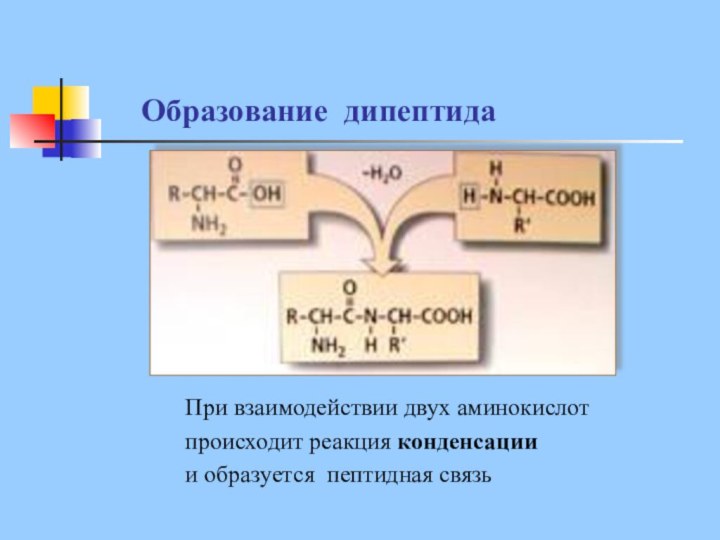
Образование дипептида
При взаимодействии двух аминокислот
происходит реакция конденсации
и образуется пептидная связь
Слайд 18
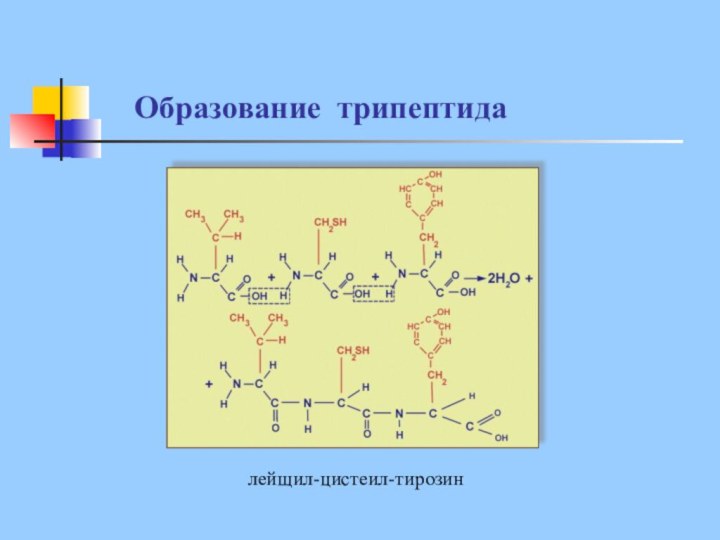
Образование трипептида
лейщил-цистеил-тирозин
H
О Н CH2OH O H О
Н2N - CH2 - C - - - N - CH - C - N - - - CH - C - N - CH - C
CH3 СН2SH OН
Глицил-аланил-серил-цистеин
Слайд 20
Уровни организации белка
Размер каждой аминокислоты около 0,3
нм,
Белок, состоящий из многих аминокислотных остатков, должен представлять
собой длинную нить
Размеры молекул белков гораздо меньше
Макромолекулы белков имеют форму компактных шариков (глобул) или вытянутых структур (фибрилл)
Полипептидная цепь каким-то образом сплетена, образуя клубок или пучок нитей
Она свёртывается упорядоченно, для каждого белка определённым образом
Слайд 21
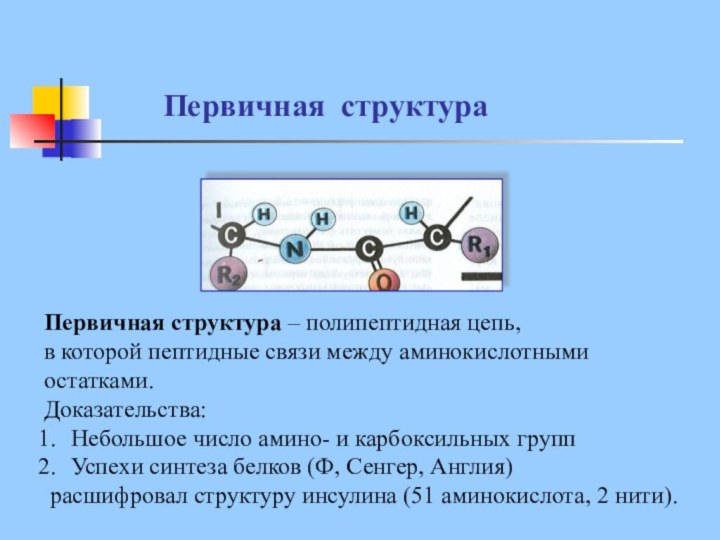
Первичная структура
Первичная структура – полипептидная цепь,
в которой
пептидные связи между аминокислотными
остатками.
Доказательства:
Небольшое число амино- и карбоксильных
групп
Успехи синтеза белков (Ф, Сенгер, Англия)
расшифровал структуру инсулина (51 аминокислота, 2 нити).
Слайд 22
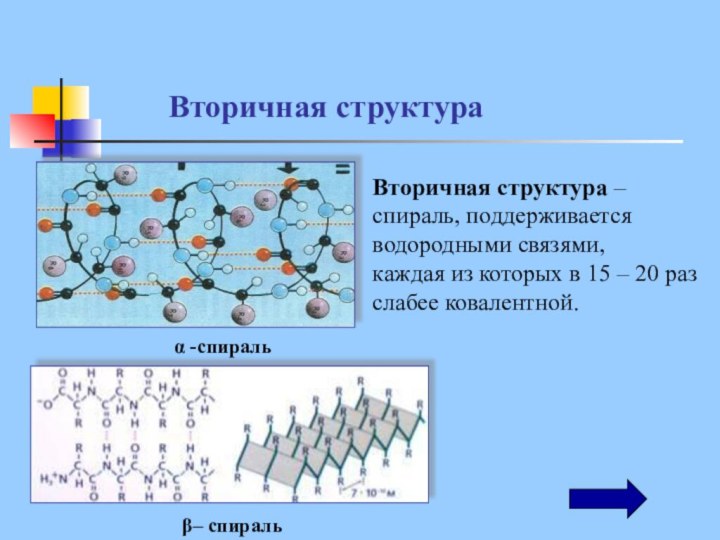
Вторичная структура –
спираль, поддерживается
водородными связями,
каждая из
которых в 15 – 20 раз слабее ковалентной.
β– спираль
α -спираль
Вторичная структура
Слайд 23
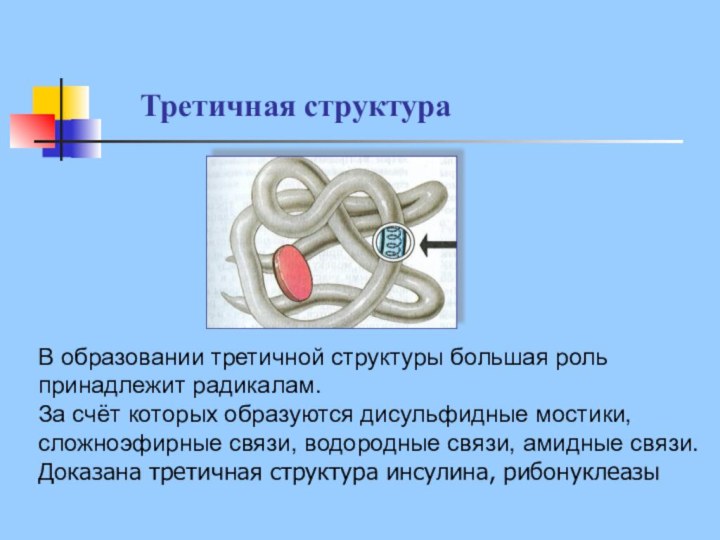
В образовании третичной структуры большая роль
принадлежит радикалам.
За счёт которых образуются дисульфидные мостики,
сложноэфирные связи, водородные
связи, амидные связи.
Доказана третичная структура инсулина, рибонуклеазы
Третичная структура
Слайд 24
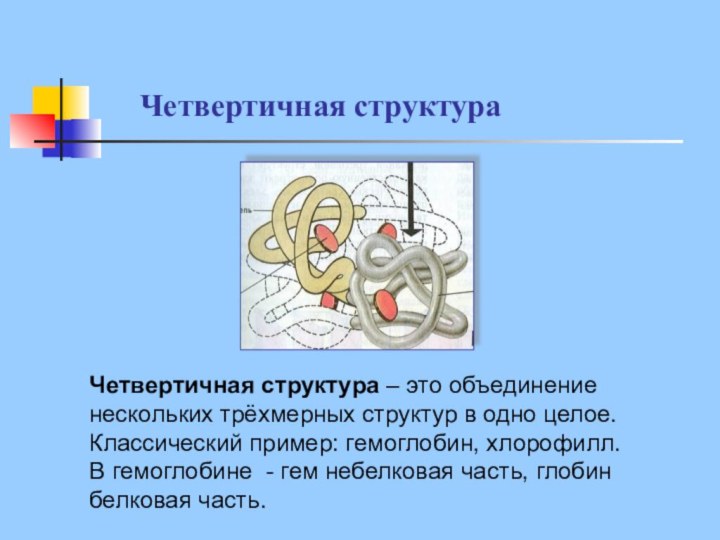
Четвертичная структура
Четвертичная структура – это объединение нескольких трёхмерных
структур в одно целое.
Классический пример: гемоглобин, хлорофилл.
В
гемоглобине - гем небелковая часть, глобин белковая часть.
Слайд 25
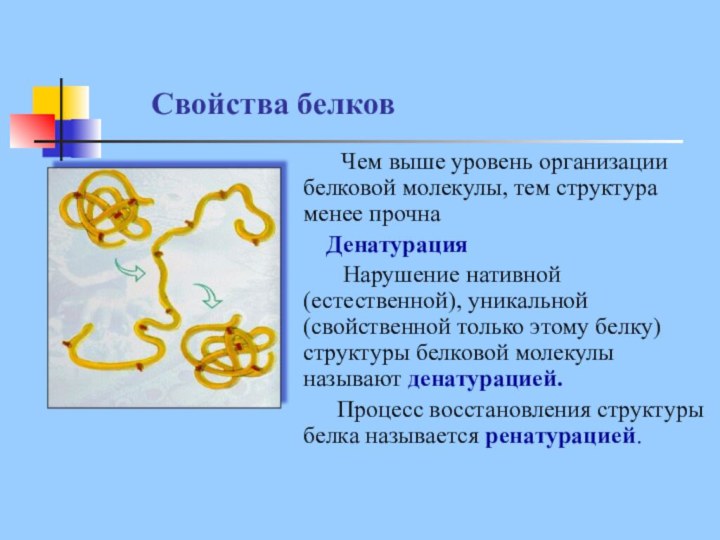
Свойства белков
Чем выше уровень организации белковой
молекулы, тем структура менее прочна
Денатурация
Нарушение нативной
(естественной), уникальной (свойственной только этому белку) структуры белковой молекулы называют денатурацией.
Процесс восстановления структуры белка называется ренатурацией.
Слайд 26
Свойства белков
Растворимость белков
Гидролиз белков
Цветные реакции белков: биуретовая, ксантопртеиновая
Амфотерный
характер белковых молекул (амфотерность белков)
Слайд 27
Выводы по уроку:
белки – это высокомолекулярные органические соединения,
биополимеры, состоящие из мономеров
α -аминокислот
аминокислоты
соединяются в полипептидную цепочку за счёт пептидной связи
аминокислоты заменимые и незаменимые
белки могут быть простыми и сложными
четыре структуры белка (первичная, вторичная, третичная и четвертичная)
денатурация – это утрата белковой молекулой своей структурной организации, обеспечивающей функциональные свойства белка
ренатурация - процесс восстановления структуры белка