- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Белки, их строение и функции
Содержание
- 2. Классификация белков по составуПростые белки (неконъюгированные). Состоят
- 3. Классификация по простетическим группам гемапротеины (простетическая группа
- 4. Классификация по выполняемым функциямФерментыТранспортная через мембрану(пермиаза, K/Na-АТФаза,
- 5. Уровни структурной организации белковПервичная структура – это
- 6. α-спиральПоллинг и Кори предложили модель α-спирали. Конфигурация
- 7. Ограничения на существование α-спирали.на участке не может
- 8. β-конформацииБыла изучена на фиброине. Поллинг и Кори
- 9. Домен − участок полипептидной цепи, способный к
- 10. Третичная структура белкаЭто способ укладки доменов и
- 11. Классификация по пространственной структуреФибриллярные. Для них характерна
- 12. Третичная структура белка
- 13. Четвертичная структура белкаХарактерна для олигомерных белков (состоят
- 14. Скачать презентацию
- 15. Похожие презентации
Классификация белков по составуПростые белки (неконъюгированные). Состоят только из аминокислот. α,β-керотин, фиброин, коллаген, эластин Сложные белки (конъюгированные). Содержат небелковые группы: гем, ионы металлов, нуклеиновые кислоты, липиды, сахара, флавины.













Слайд 2
Классификация белков по составу
Простые белки (неконъюгированные). Состоят только
из аминокислот.
небелковые группы: гем, ионы металлов, нуклеиновые кислоты, липиды, сахара, флавины.
Слайд 3
Классификация по простетическим группам
гемапротеины (простетическая группа −
гем). Гемоглобин, цитохром.;
металлопротеины (простетическая группа − металл(Mg, Mn, Fe)).
Ферритин, алкогольдегидрогеназа;липопротеины (простетическая группа − липид). β-липопротеин крови;
гликопротеины (простетическая группа − углеводная часть). Рецепторы, γ-глобулины;
фосфопротеины (простетическая группа − фосфатная группа).казеин;
нуклеопротеины (простетическая группа − нуклеиновый кислотный остаток). Рибонуклеопротеины;
флавопротеины (простетическая группа − флавин). Сукцинатдегидрогеназа.
Слайд 4
Классификация по выполняемым функциям
Ферменты
Транспортная
через мембрану(пермиаза, K/Na-АТФаза, ферритин);
транспорт
внутри целого организма(гемоглобин, альбумины);
Защитная
защитные покровы(α-керотин);
антитела и яды.
Запасные
и пищевые (альбумин, казеин);
Сократительная и двигательная
(актин, миозин, флагеллин);
Структурная
Участвуют в формировании организма(коллаген, эластин, каротин);
Регуляторная
гормональной природы;
рецепторы.
Прочие. Одной из таких функций являются белки осмогенез они регулируют концентрацию солей внутри клетки.
Слайд 5
Уровни структурной организации белков
Первичная структура – это линейная
цепь аминокислот, связанных между собой пептидной связью.
Вторичная структура
– это способ укладки элементов первичной структуры в пространстве с образованием простейших структур: α-спираль, β-конформации, неупорядоченный клубок.
Слайд 6
α-спираль
Поллинг и Кори предложили модель α-спирали. Конфигурация имеет
винтовую симметрию. Витки спирали регулярны. Спираль образована за счет
внутримолекулярных водородных связей, обусловленных взаимодействием функциональных групп, входящих в состав пептидной связи. Спираль стабилизируется за счет внутрицепочечных водородных связей СО и NH группы 4-го за ним аминокислотного остатка. При расчете денной модели было показано, что расстояние между спиралями равно 0,54 нм.
Слайд 7
Ограничения на существование α-спирали.
на участке не может быть
остатков аминокислот, имеющих большие углеводородные радикалы;
не может быть много
заряженных аминокислот;не может быть остатков пролина.
Примером может являться α-керотин (основные аминокислоты являются глицин, аланин, цистеин). Цистеин участвует в формировании цистина за счет образования -S-S- связей.
Слайд 8
β-конформации
Была изучена на фиброине. Поллинг и Кори показали
модель β-складчатости. β-конформация стабилизируется за счет образования межцепочечных водородных
связей. Расстояние между соседними полипептидными связями 0,7 нм. полипептидные цепи при β-конформации укладываются либо параллельно, либо антипараллельно. Ограничения те же, что и при α-спирали.Слайд 9 Домен − участок полипептидной цепи, способный к быстрому
и самопроизвольному формированию устойчивой пространственной структуры. Таким свойством обладают
структурные домены.Функциональные домены − участок полипептидной цепи, способный выполнять некую функцию даже в отсутствии остальной части полипептидной цепи.
Типы доменов:
4α-спираль; ββ-сэндвич; αβ-баррель; αβ-седло.
Слайд 10
Третичная структура белка
Это способ укладки доменов и элементов
вторичной структуры в пространстве. образуется за счет межмолекулярных взаимодействий
отдельных аминокислотных остатков.Структура стабилизируется за счет:
водородные связи формируются между аминокислотными остатками имеющими полярные группы(ОН, NH2,…);
вандервальсовы связи или гидрофобные взаимодействия образуются между ароматическими аминокислотами и аминокислотами, имеющими большое количество углеводородных радикалов;
цистеиновые мостики или S-S связи образуются за счет димеризации 2х молекул цистеина в молекулу цистина;
электростатические взаимодействия образующиеся за счет взаимодействия заряженных аминокислот.
Слайд 11
Классификация по пространственной структуре
Фибриллярные. Для них характерна линейная
структура. Плохо растворимы в воде, обычно в их состав
входят большое количество гидрофобных аминокислот.Глобулярные. Для них характерна сложная пространственная трехмерная структура. Имеют гидрофобное ядро и гидрофильную поверхность. Как правило, хорошо растворимы в воде.
Нпр., яичный альбумин.
Слайд 13
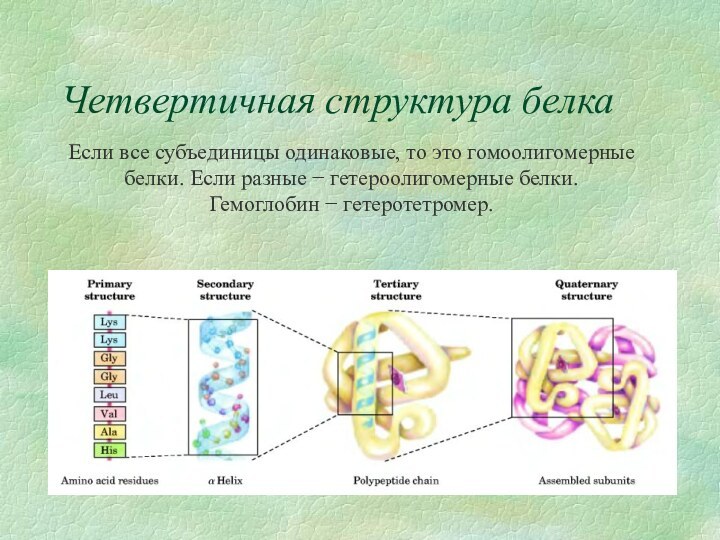
Четвертичная структура белка
Характерна для олигомерных белков (состоят из
нескольких полипептидных цепей). это способ укладки отдельных полипептидных цепей
относительно друг друга.Структура стабилизируется за счет:
гидрофобные взаимодействия
электростатические взаимодействия
образование ковалентных связей
водородные связи
ван-дер-ваальсовы силы.
Пример: гемоглобин(α2β2), т.е. 2 α-субъединицы и 2 β-субъединицы