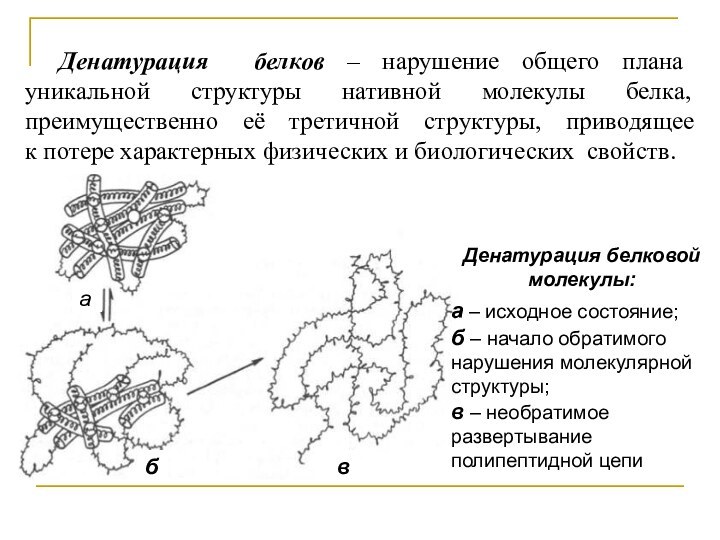
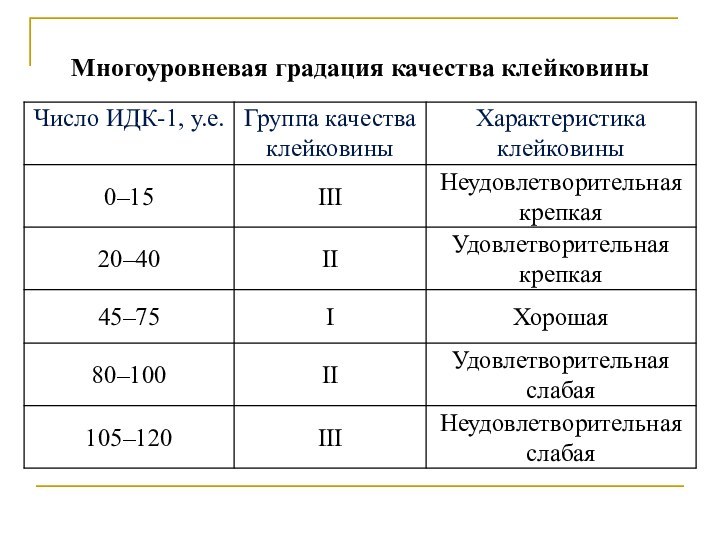
нативной молекулы белка, преимущественно её третичной структуры, приводящее к
потере характерных физических и биологических свойств.Денатурация белковой молекулы:
а – исходное состояние;
б – начало обратимого нарушения молекулярной структуры;
в – необратимое развертывание полипептидной цепи
а
б
в