Слайд 2
Катаболизм органических веществ в тканях сопровождается потреблением кислорода

и выделением СО2. Этот процесс называют тканевым дыханием. Кислород
в этом процессе используется как акцептор водорода от окисляемых (дегидрируемых) веществ (субстратов), в результате чего синтезируется вода. Процесс окисления можно представить следующим уравнением: SH2 + 1/2O2 → S + H2O.
Различные окисляемые органические вещества (S-субстраты) представляют собой метаболиты катаболизма, их дегидрирование является экзергоническим процессом. Энергия, освобождающаяся в ходе реакций окисления, либо полностью рассеивается в виде тепла, либо частично тратится на фосфорилирование АДФ с образованием АТФ. Организм превращает около 40% энергии, выделяющейся при окислении, в энергию макроэргических связей АТФ. Большинство организмов в биосфере использует этот способ или очень сходный с ним (в качестве терминального акцептора водорода может быть не кислород, а другое соединение) как основной источник энергии, необходимый для синтеза внутриклеточной АТФ. Таким путем клетка превращает химическую энергию питательных веществ, поступивших извне, в энергию, утилизируемую на разные виды работы.
Реакция дегидрирования и способ превращения выделившейся энергии путем синтеза АТФ — это энергетически сопряженные реакции. Синтез АТФ из АДФ и Pi за счет биологического окисления называется окислительным фосфорилированием.
Слайд 3
рис. 1. Окислительное фосфорилирование
Слайд 4
Цепь переноса электронов — ЦПЭ
Указанное выше уравнение

для окислительно-восстановительной реакции представляет собой обобщенную форму, так как
изображает процесс окисления субстратов как прямое дегидрирование, причем кислород выступает в роли непосредственного акцептора водорода. На самом деле кислород получает электроны иным образом. Существуют промежуточные переносчики при транспорте электронов от исходного донора электронов SH2 к терминальному акцептору — О2. Полный процесс представляет собой цепь последовательных окислительно-восстановительных реакций, в ходе которых происходит взаимодействие между переносчиками. Каждый промежуточный переносчик вначале выступает в роли акцептора электронов и протонов и из окисленного состояния переходит в восстановленную форму. Затем он передает электрон следующему переносчику и снова возвращается в окисленное состояние. На последней стадии переносчик передает электроны кислороду, который затем восстанавливается до воды. Совокупность последовательных окислительно-восстановительных реакций называется цепью переноса (транспорта) электронов, или дыхательной цепью.
Слайд 5
Рис.2. Митохондриальная цепь переноса электронов:
I, III и IV
— высокомолекулярные комплексы, расположенные во внутренней мембране митохондрий; комплекс
II — сукцинатдегидрогеназа, в отличие от других FAD-зависимых дегидрогеназ локализована во внутренней мембране митохондрий, но на рисунке не представлена. Цитохром с — низкомолекулярный гемсодержащий белок, обладающий подвижностью в липидном слое мембраны митохондрий. Белки FeS содержат негеминовое железо и входят в состав ферментных комплексов I, II и III. Кофермент Q — небелковый компонент ЦПЭ. Места действия ингибиторов ЦПЭ показаны жирными стрелками: I — ротенон, барбитураты; 2 — антимицин; 3 — цианиды, СО, H2S
Слайд 6
Цепь переноса электронов — ЦПЭ
Промежуточными переносчиками в дыхательной
цепи у высших организмов являются коферменты: NAD+ (никотинамид-адениндинуклеотид), FAD и
FMN (флавинадениндинуклеотид и флавинмононуклеотид), кофермент Q (CoQ), семейство гемсодержащих белков — цитохромов (обозначаемых как цитохромы b, c1, c, a, a3) и белки, содержащие негеминовое железо. Все участники этой цепи организованы в четыре окислительно-восстановительных комплекса (рис. 5), связанные убихиноном (CoQ) и цитохромом c.
Слайд 7
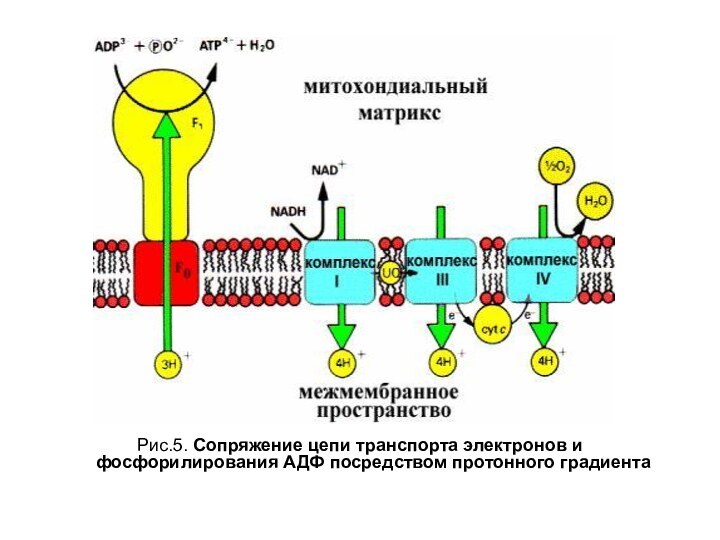
Рис.5. Сопряжение цепи транспорта электронов и фосфорилирования АДФ
посредством протонного градиента
Слайд 8
Процесс начинается с переноса протонов и электронов от
окисляемого субстрата на коферменты NAD+ или FAD. Это определяется тем,
является ли дегидрогеназа, катализирующая первую стадию, NAD-зависимойили FADзависимой. NAD-зависимая дегидрогеназа катализирует реакции окисления непосредственно субстрата (первичная дегидрогеназа). NAD+ является коферментом и выполняет роль акцептора водорода (рис. 3). FAD-зависимая дегидрогеназа также выполняет функцию первичной дегидрогеназы. Кофермент FAD является акцептором водорода от субстрата. Если процесс начинается с NAD+, то следующим переносчиком будет NADH-дегидрогеназа, коферментом которой является FMN.
Слайд 9
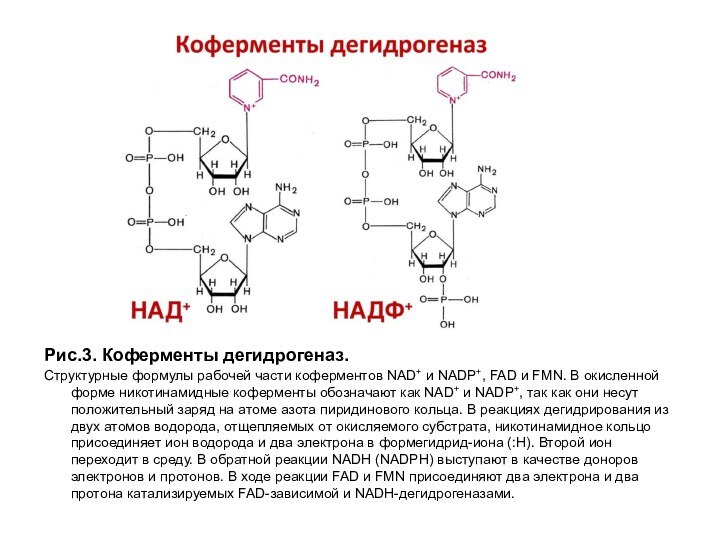
Рис.3. Коферменты дегидрогеназ.
Структурные формулы рабочей части коферментов NAD+ и
NADP+, FAD и FMN. В окисленной форме никотинамидные коферменты
обозначают как NAD+ и NADP+, так как они несут положительный заряд на атоме азота пиридинового кольца. В реакциях дегидрирования из двух атомов водорода, отщепляемых от окисляемого субстрата, никотинамидное кольцо присоединяет ион водорода и два электрона в формегидрид-иона (:Н). Второй ион переходит в среду. В обратной реакции NADН (NADPН) выступают в качестве доноров электронов и протонов. В ходе реакции FAD и FMN присоединяют два электрона и два протона катализируемых FAD-зависимой и NADН-дегидрогеназами.
Слайд 10
Рис.3. Коферменты дегидрогеназ.
Структурные формулы рабочей части коферментов NAD+ и
NADP+, FAD и FMN. В окисленной форме никотинамидные коферменты
обозначают как NAD+ и NADP+, так как они несут положительный заряд на атоме азота пиридинового кольца. В реакциях дегидрирования из двух атомов водорода, отщепляемых от окисляемого субстрата, никотинамидное кольцо присоединяет ион водорода и два электрона в формегидрид-иона (:Н). Второй ион переходит в среду. В обратной реакции NADН (NADPН) выступают в качестве доноров электронов и протонов. В ходе реакции FAD и FMN присоединяют два электрона и два протона катализируемых FAD-зависимой и NADН-дегидрогеназами.
Слайд 11
Тип участвующей дегидрогеназы зависит от природы субстрата. Но
каким бы ни был исходный субстрат, электроны и протоны
от флавинов переносятся к коферменту Q, а дальше пути электронов и протонов расходятся. Электроны с помощью системы цитохромов достигают кислорода, который затем, присоединяя протоны, превращается в воду. Чтобы разобраться в системе транспорта электронов, необходимо познакомиться с отдельными ее участниками.
Символ 2Н+ означает два протона, обычно переносимые в виде гидрида иона. В этом случае вместо терминов «донор электронов» и «акцептор электронов» иногда используют термины «донор или акцептор водорода».
Слайд 12
NADH-дегидрогеназа катализирует окисление NADH и восстановление убихинона (CoQ).
Переносчиком водорода является кофермент — FMN (комплекс I на
рис. 5). Строение FMN представлено на рис. 3. В процессе реакции водород сначала присоединяется к FMN, соединенному с ферментом, а затем протоны поступают в межмембранное пространство, а электроны с помощью FeS-белков передаются на убихинон. Флавиновые коферменты (FAD и FMN) содержат производные витамина B2 и прочно связаны с ферментом, поэтому ферменты, в состав которых они входят, называются флавопротеинами. Акцептором электронов от комплекса I является убихинон (кофермент Q, рис. 4) — производное изопрена, его название возникло из-за повсеместной распространенности в природе.
Слайд 13
Рис.4. Структура убихинона (кофермента Q).
n — число изопреноидных
звеньев. Убихинон может принимать один электрон и превращаться в
семихинон или два электрона и полностью восстанавливаться в гидрохинон (убихинол)
Слайд 14
Получая 2e из матрикса митохондрий, он восстанавливается в убихинол.
Кофермент Q действует как переносчик электронов на цитохромы. Цитохромы
— это гемопротеины, содержащие в качестве простетической группы гем, прочно связанный с белковой частью. Атом железа в геме может менять валентность, присоединяя или отдавая электроны:
Слайд 15
Вдыхательной цепи цитохромы служат переносчиками электронов и располагаются
соответственно величине окислительно-восстановительного потенциала следующим образом: b, c1, c, а,
а3. Гемовые группы цитохромов связаны с белковой частью координационными связями между ионом железа и соответствующими аминокислотными остатками.
В цитохромах c и c1 дополнительные ковалентные связи формируются между тиоловыми группами цистеина и боковыми винильными группами гема.
QН2-дегидрогеназа(комплекс III на рис. 5) представляет собой комплекс цитохромов b и c1. Этот фермент катализирует окисление восстановленного кофермента Q и перенос электронов на цитохром c.
Слайд 16
Электроны последовательно переносятся атомами железа цитохромов b и
c1, а затем поступают на цитохром c. В то
же время протоны за счет энергии, выделяющейся в процессе транспорта e- с цитохрома b на цитохром с, выделяются в межмембранное пространство. Цитохромоксидаза включает комплекс цитохромов а и а3 (комплекс IV на рис. 5). Цитохромоксидаза кроме гема содержит ионы меди, которые способны менять валентность и таким способом участвовать в переносе электронов:
Слайд 17
Цитохромоксидаза переносит электроны с цитохрома c на кислород. В
переносе электронов участвуют сначала ионы железа цитохромов а и
а3, а затем ион меди цитохрома а3. Молекула кислорода связывается с железом в геме цитохрома а3. Следовательно, переход электронов на кислород с иона меди цитохрома а3 происходит на молекуле фермента. Каждый из атомов молекулы кислорода присоединяет по два электрона и протона, образуя при этом молекулу воды.
Белки, содержащие негеминовое железо. Некоторое количество атомов железа в митохондриях связано не в геме цитохромов, а образует комплексы с другими белками. Эти белки называют также железосерными, так как атомы железа связаны с атомами серы цистеиновых остатков. Белки, содержащие негеминовое железо, участвуют в переносе электронов в составе комплексов I и III. Хотя не совсем ясен до настоящего времени механизм их действия.
Слайд 18
Окислительное фосфорилирование
Энергия, образующаяся при прохождении потока электронов
по дыхательной цепи, используется для сопряженного фосфорилирования АДФ. Эти
два процесса взаимозависимы: окисление не может протекать в отсутствие АДФ. Соотношение окисления и фосфорилирования определяется коэффициентом P/O, показывающим, какое количество Рi используется на образование АТФ при превращении одного грамм-атома О2 в Н2О (количество моль фосфорилированного АДФ на 1/2 моль кислорода). Коэффициент Р/О называется коэффициентом окислительного фосфорилирования и зависит от точки вхождения восстановительных эквивалентов в цепь транспорта электронов.
Слайд 19
Окислительное фосфорилирование
Например, для субстратов, окисляемых NAD-зависимой дегидрогеназой, Р/О=3,

так как в дыхательной цепи есть три участка, где
перенос электронов сопряжен с синтезом АTФ. Не все субстраты передают электроны и протоны на NAD, некоторые окисляются FAD-зависимымидегидрогеназами, которые переносят протоны и электроны сразу на убихинон, минуя комплекс I. В этом случае Р/О=2. В действительности коэффициент фосфорилирования всегда меньше теоретической величины, потому что часть энергии, высвобождающейся при транспорте электронов, расходуется не на синтез АТФ, а для переноса веществ через митохондриальную мембрану.
В сутки человек потребляет в среднем 27 моль кислорода. Основное его количество (примерно 25 моль) используется в митохондриях в дыхательной цепи. Следовательно, ежесуточно синтезируется 125 моль АTФ или 62 кг (при расчете использовали коэффициент Р/О=2,5, то есть среднее значение коэффициента фосфорилирования). Масса всей АТФ, содержащейся в организме, составляет примерно 20–30г. Итак, можно сделать вывод, что каждая молекула АTФ за сутки 2500 раз проходит процесс гидролиза и синтеза, что и характеризует интенсивность обмена АTФ.
Слайд 20
Сопряжение работы дыхательной цепи с процессом синтеза АТФ
Существование такого сопряжения доказывается тем, что можно ингибировать образование
АТФ, не нарушая процесса транспорта электронов. Это достигается добавлением химических веществ, названных разобщителями. После удаления разобщителей синтез АТФ восстанавливается. Изучение механизма сопряжении дает ответ на основные вопросы:
1)каким образом транспорт электронов служит источником энергии;
2)как эта энергия обеспечивает протекание реакции АДФ + Pi → АТФ.
Слайд 21
Сопряжение работы дыхательной цепи с процессом синтеза АТФ

Хемоосмотическая теория объясняет механизм сопряжения. Комплексы I, III
и IV цепи переноса электронов функционируют как протонные (Н+)-помпы, осуществляя перенос протонов из матрикса через внутреннюю мембрану в межмембранное пространство. Затрата энергии на выброс протонов из матрикса происходит за счет экзергонических окислительно-восстановительных реакций дыхательной цепи. Перенос протонов приводит к возникновению разности концентрации Н+ с двух сторон митохондриальной мембраны: более высокая концентрация будет снаружи и более низкая — внутри. Митохондрия в результате переходит в «энергизованное» состояние, так как возникает градиент концентрации Н+ и одновременно разность электрохимических потенциалов со знаком плюс на наружной поверхности. Электрохимический потенциал стимулирует протоны двигаться в обратном направлении, но мембрана непроницаема для них кроме отдельных участков, называемых протонными каналами. Обратный перенос протонов в матрикс является экзергоническим процессом, высвобождающаяся при этом энергия используется на фосфорилирование АДФ.
Слайд 22
Сопряжение работы дыхательной цепи с процессом синтеза АТФ
Катализирует процесс фермент Н+-АТФ-синтаза, состоящая из протонных каналов, пронизывающих
внутреннюю мембрану митохондрии и обращенной в матрикс «головки», состоящей из субъединиц, участвующих в образовании АТФ (рис. 5 и 7).
Слайд 23
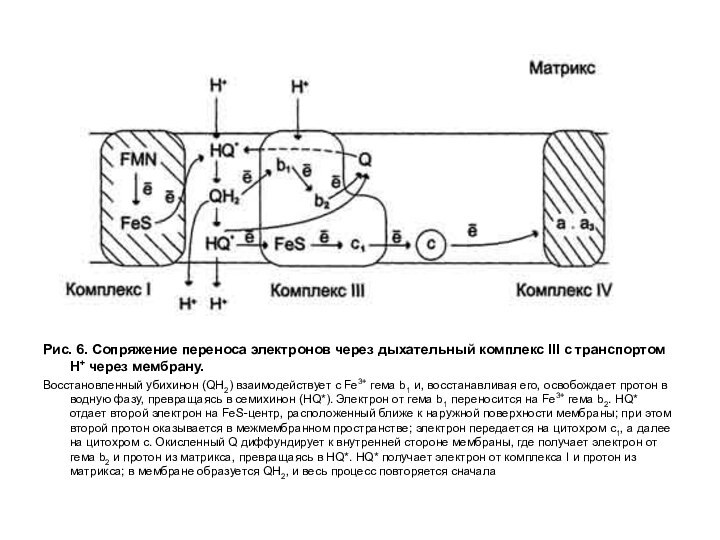
Рис. 6. Сопряжение переноса электронов через дыхательный комплекс
III с транспортом Н+ через мембрану.
Восстановленный убихинон (QH2) взаимодействует с
Fe3+ гема b1 и, восстанавливая его, освобождает протон в водную фазу, превращаясь в семихинон (HQ*). Электрон от гема b1 переносится на Fe3+ гема b2. HQ* отдает второй электрон на FeS-центр, расположенный ближе к наружной поверхности мембраны; при этом второй протон оказывается в межмембранном пространстве; электрон передается на цитохром с1, а далее на цитохром с. Окисленный Q диффундирует к внутренней стороне мембраны, где получает электрон от гема b2 и протон из матрикса, превращаясь в HQ*. HQ* получает электрон от комплекса I и протон из матрикса; в мембране образуется QH2, и весь процесс повторяется сначала
Слайд 24
Разобщение дыхания и фосфорилирования
Убедительные экспериментальные доказательства в
пользу описанного механизма сопряжения дыхания и фосфорилирования были получены
с помощью ионофоров. Молекулы этих веществ, как правило, липофильны и способны переносить ионы через мембрану. Например, 2,4-динитрофенол (протонофор) легко диффундирует через мембрану в ионизированной и неионизированной форме, перенося протоны в сторону их меньшей концентрации в обход протонных каналов (рис. 7 и 8).
Таким образом, 2,4-динитрофенол уничтожает электрохимический потенциал и синтез АTФ сильно снижается, хотя окисление субстратов при этом происходит. Энергия дыхательной цепи в основном рассеивается в виде теплоты. Этим объясняется пирогенное действие разобщителей. Разобщающим действием обладают некоторые антибиотики, такие, как валиномицин и грамицидин.
Слайд 25
Рис. 7. Механизм разобщения дыхания и фосфорилирования.
Протонированная форма 2,4-динитрофенолапереносит
протоны через внутреннюю мембрану митохондрий и препятствует образованию протонного
градиента.
Слайд 26
Рис. 7. Механизм разобщения дыхания и фосфорилирования.
Протонированная форма 2,4-динитрофенолапереносит
протоны через внутреннюю мембрану митохондрий и препятствует образованию протонного
градиента.
Слайд 27
Дыхательный контроль
Скорость дыхания митохондрий может контролироваться концентрацией
АДФ. Это объясняется тем, что окисление и фосфорилирование жестко
сопряжены. Энергия, необходимая клетке для совершения работы, поставляется за счет гидролиза АТФ. Концентрация АДФ при этом увеличивается; в результате создаются условия для ускорения дыхания, что и ведет к восполнению запасов АТФ. Таким образом повышение концентрации АДФ стимулирует работу ЦПЭ, а увеличение содержания АТФ ее снижает.
Слайд 28
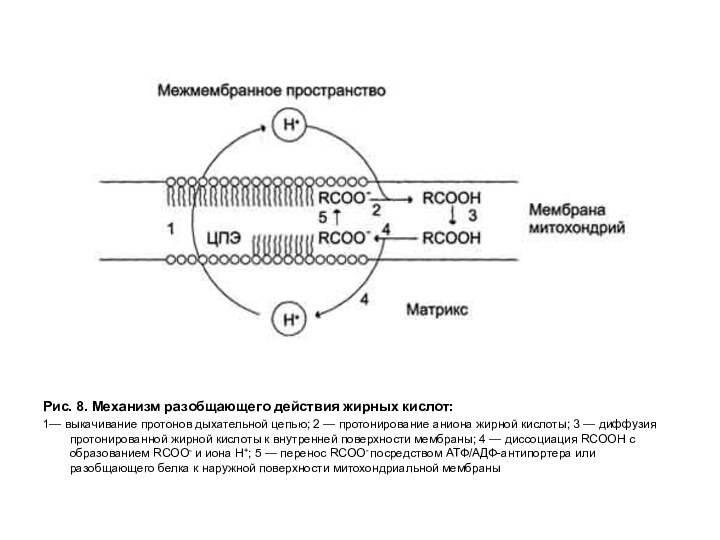
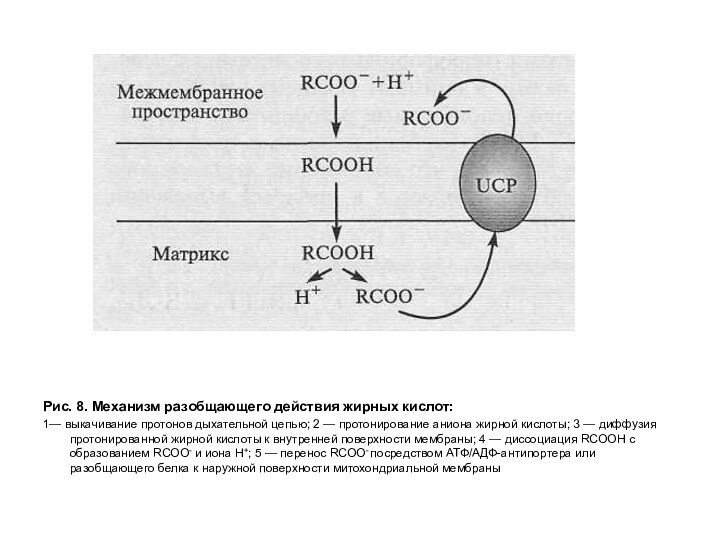
Рис. 8. Механизм разобщающего действия жирных кислот:
1— выкачивание
протонов дыхательной цепью; 2 — протонирование аниона жирной кислоты;
3 — диффузия протонированной жирной кислоты к внутренней поверхности мембраны; 4 — диссоциация RCOOH с образованием RCOO- и иона Н+; 5 — перенос RCOO- посредством АТФ/АДФ-антипортера или разобщающего белка к наружной поверхности митохондриальной мембраны
Слайд 29
Рис. 8. Механизм разобщающего действия жирных кислот:
1— выкачивание
протонов дыхательной цепью; 2 — протонирование аниона жирной кислоты;
3 — диффузия протонированной жирной кислоты к внутренней поверхности мембраны; 4 — диссоциация RCOOH с образованием RCOO- и иона Н+; 5 — перенос RCOO- посредством АТФ/АДФ-антипортера или разобщающего белка к наружной поверхности митохондриальной мембраны