Слайд 2
План лекции
История учения о биологическом окислении.
Современные представления о
биологическом окислении.
Тканевое дыхание, определение, этапы, общая схема.
Редоксистема, редокспотенциал.
Характеристика
ферментов дыхательной цепи.
Укороченные (побочные) пути тканевого дыхания.
Дыхательный коэффициент.
Окислительное фосфорилирование. Теория Митчела.
Пункты сопряжения ТД и ОФ.
Коэффициент окислительного фосфорилирования.
Дыхательный контроль.
Виды фосфорилирования.
Роль АТФ
Макроэргические вещества
Гипоэнергетические состояния
Разобщение ТД и ОФ. Виды разобщения.
Ингибиторы тканевого дыхания.
Микросомальное окисление. Схема. Роль.
Активные формы кислорода
Вспомогательные ферменты ТД
Слайд 3
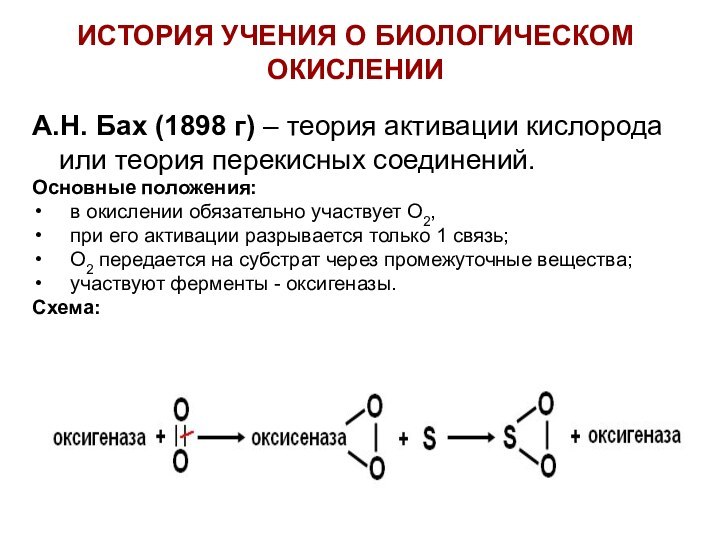
ИСТОРИЯ УЧЕНИЯ О БИОЛОГИЧЕСКОМ ОКИСЛЕНИИ
А.Н. Бах (1898 г)
– теория активации кислорода или теория перекисных соединений.
Основные положения:
в окислении обязательно участвует О2,
при его активации разрывается только 1 связь;
О2 передается на субстрат через промежуточные вещества;
участвуют ферменты - оксигеназы.
Схема:
Слайд 4
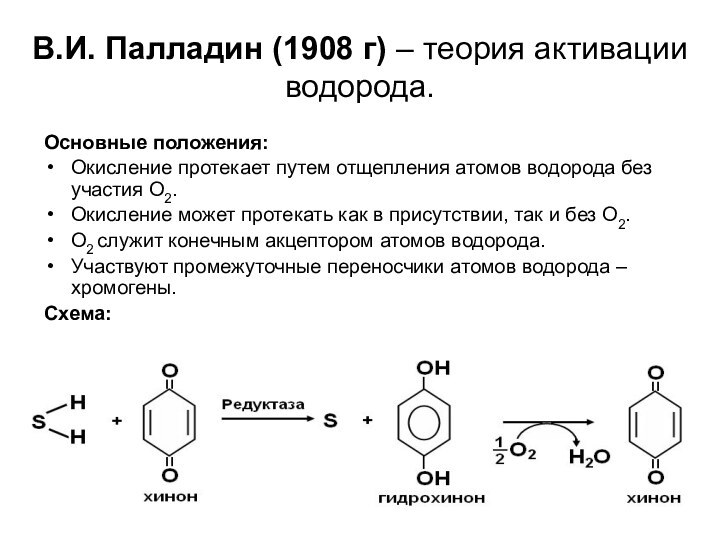
В.И. Палладин (1908 г) – теория активации водорода.
Основные
положения:
Окисление протекает путем отщепления атомов водорода без участия О2.
Окисление
может протекать как в присутствии, так и без О2.
О2 служит конечным акцептором атомов водорода.
Участвуют промежуточные переносчики атомов водорода – хромогены.
Схема:
Слайд 5
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О БИОЛОГИЧЕСКОМ ОКИСЛЕНИИ И ТКАНЕВОМ ДЫХАНИИ.
БИОЛОГИЧЕСКОЕ
ОКИСЛЕНИЕ – совокупность всех ОВР в живых системах, протекающие
в аэробных и анаэробных условиях.
Слайд 6
Тканевое дыхание
комплекс аэробных окислительно-восстановительных реакций распада субстратов, сопровождающийся
передачей протонов и электронов через дыхательную цепь ферментов на
кислород и выделением энергии
Слайд 7
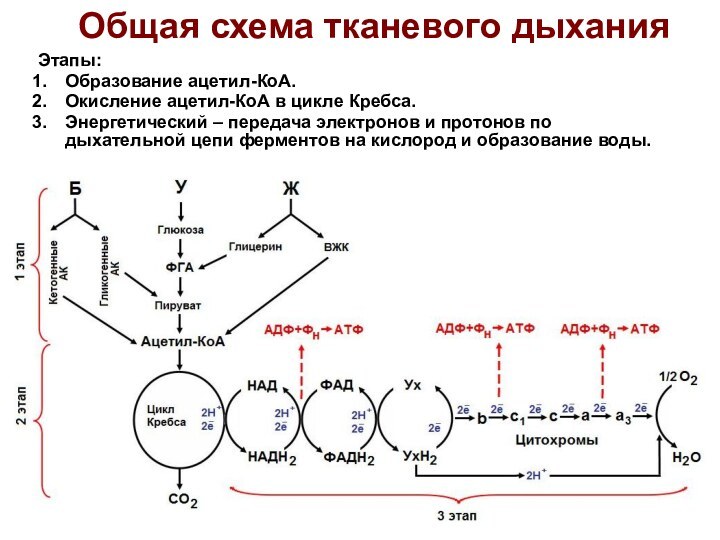
Общая схема тканевого дыхания
Этапы:
Образование ацетил-КоА.
Окисление ацетил-КоА в
цикле Кребса.
Энергетический – передача электронов и протонов по дыхательной
цепи ферментов на кислород и образование воды.
Слайд 8
Редокс-система
Окисленная и восстановленная форма одного вещества.
Примеры:
НАД/НАДН2
ФАД/ФАДН2
Ух/УхН2
Слайд 9
- это химическая характеристика способности вещества принимать и
удерживать электроны. Выражается в вольтах (В).
Самый низкий Р-П
имеет начальное звено дыхательной цепи НАД/НАДН2 = - 0,32 В
самый высокий Р-П у Н2О/О2 = 0,82 В, расположенного в конце цепи.
Перенос протонов водорода и электронов возможен только в одном направлении - в порядке возрастания их Р-П.
РЕДОКС-ПОТЕНЦИАЛ (Р-П)
Слайд 10
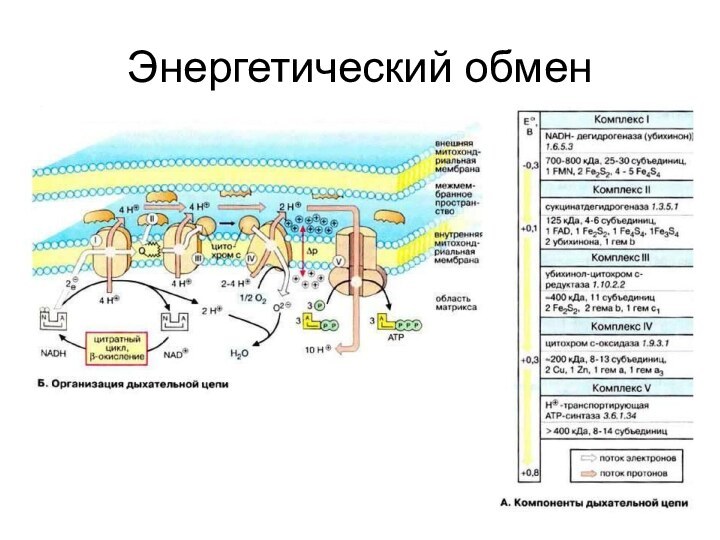
Характеристика дыхательной цепи
Состоит из 3 групп ферментов и
низкомолекулярного витаминоподобного вещества – убихинона.
Локализована на внутренней мембране
митохондрий.
Ферменты:
НАД–зависимые ДГГ
ФАД–зависимые ДГГ
Цитохромы
Слайд 11
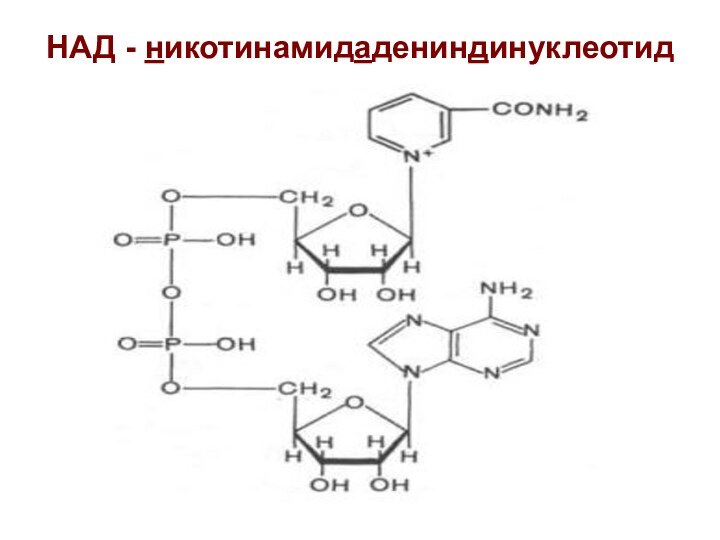
НАД - никотинамидадениндинуклеотид
Слайд 12
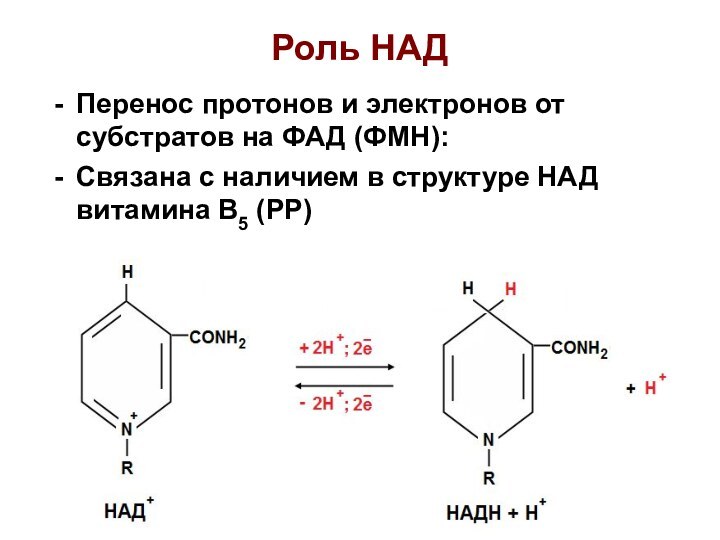
Роль НАД
Перенос протонов и электронов от субстратов на
ФАД (ФМН):
Связана с наличием в структуре НАД витамина В5
(РР)
Слайд 14
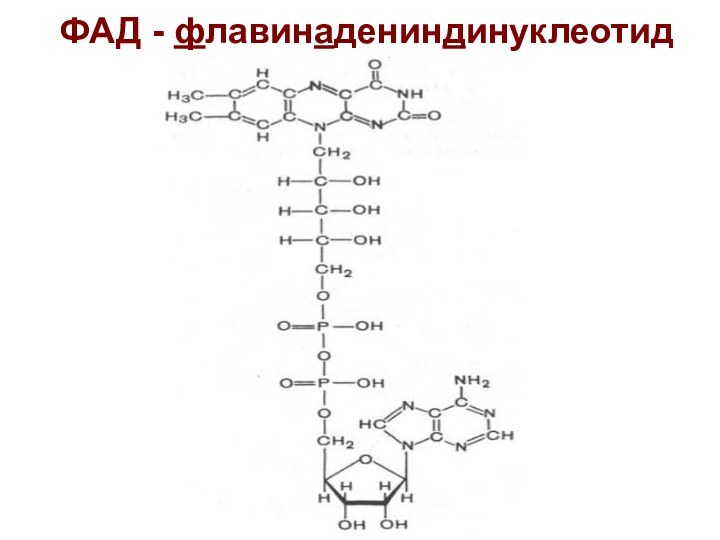
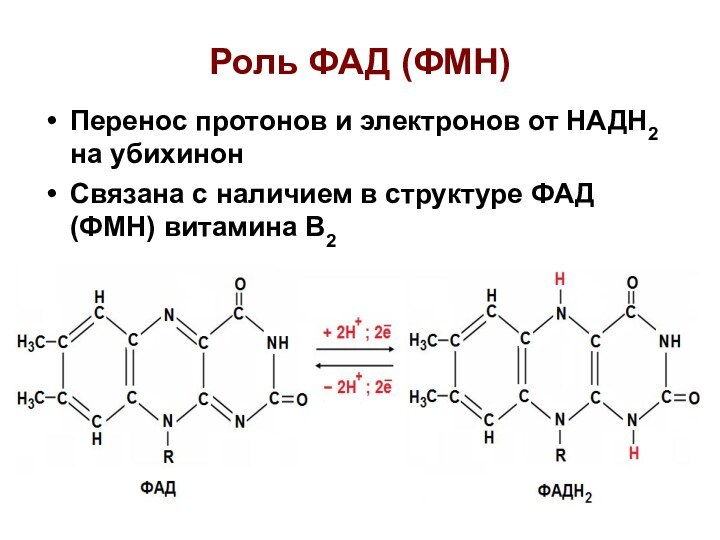
Роль ФАД (ФМН)
Перенос протонов и электронов от НАДН2
на убихинон
Связана с наличием в структуре ФАД (ФМН)
витамина В2
Слайд 15
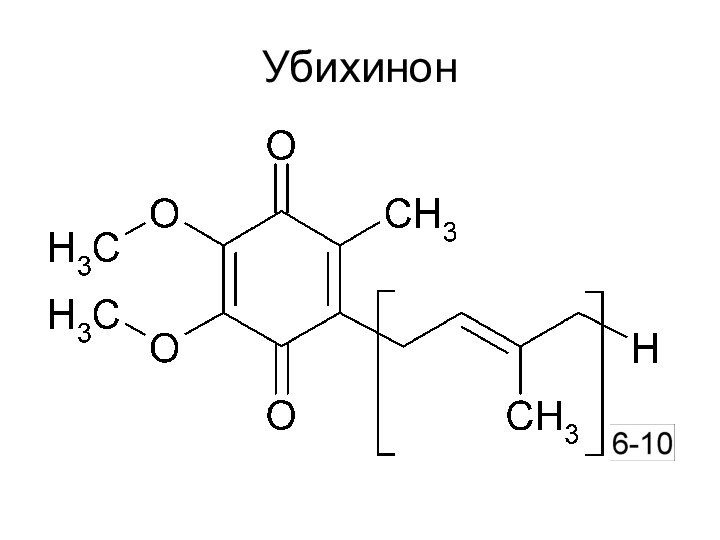
Роль убихинона
Перенос электронов от ФАДН2 на цитохромы, а
протонов – в межмембранное пространство.
Слайд 16
Цитохромы (Цх)
- гемсодержащие ферменты, осуществляют перенос электронов за
счет изменения степени окисления атома железа в составе гема.
Fe3+ + e- ↔ Fe2+
Аутооксидабельность – способность передавать электроны непосредственно на кислород.
Единственным аутооксидабельным является цитохром аа3 – цитохромоксидаза.
Цитохромоксидаза состоит из 6 субъединиц, каждая из которых содержит гем и атом меди.
Ионы меди также могут переносить электроны:
Cu2+ + e- ↔ Cu+
Слайд 17
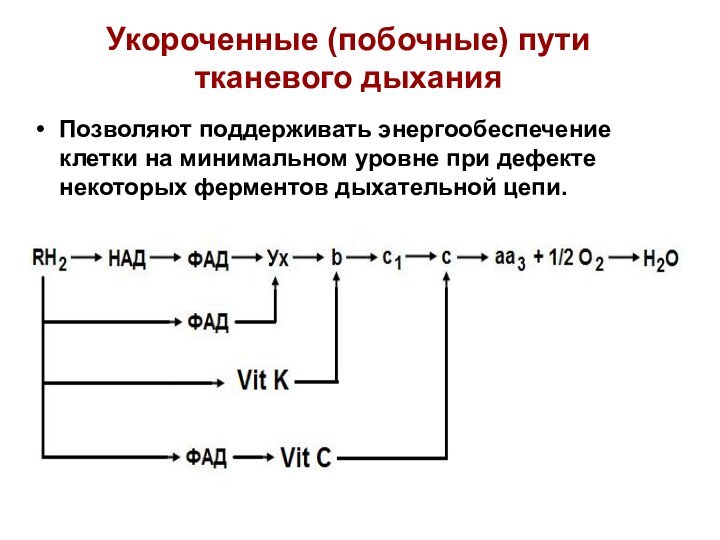
Укороченные (побочные) пути тканевого дыхания
Позволяют поддерживать энергообеспечение клетки
на минимальном уровне при дефекте некоторых ферментов дыхательной цепи.
Слайд 18
Дыхательный коэффициент
отношение объема СО2, выделенного из легких, к
объему поглощенного О2.
RQ = CO2/O2
Для углеводов = 1;
белков = 0,8;
липидов = 0,7
Для мозга = 1
Миокарда = 0,74
Слайд 19
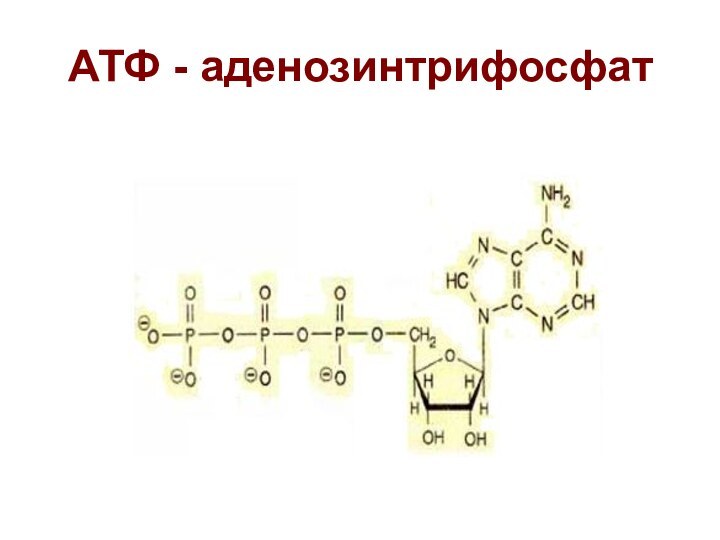
Окислительное фосфорилирование
- синтез АТФ из АДФ и
Н3РО4 с затратой энергии тканевого дыхания.
Слайд 20
- это внутренняя митохондриальная мембрана, т.к. благодаря её
работе происходит сопряжение тканевого дыхания и окислительного фосфорилирования.
Особенности:
большое количество
липидов, из которых 90% – фосфолипиды;
митохондриальные фосфолипиды характеризуются высокой степенью ненасыщенности.
Сопрягающая мембрана
Слайд 21
Пункты сопряжения ТД и ОФ в дыхательной цепи
Между
НАД и ФАД
Между цитохромами b и с1
Между цитохромами а
и а3
Это участки дыхательной цепи, где разность редокс-потенциалов между соседними редокс-системами более 0,2 В, достаточный для синтеза АТФ
Слайд 22
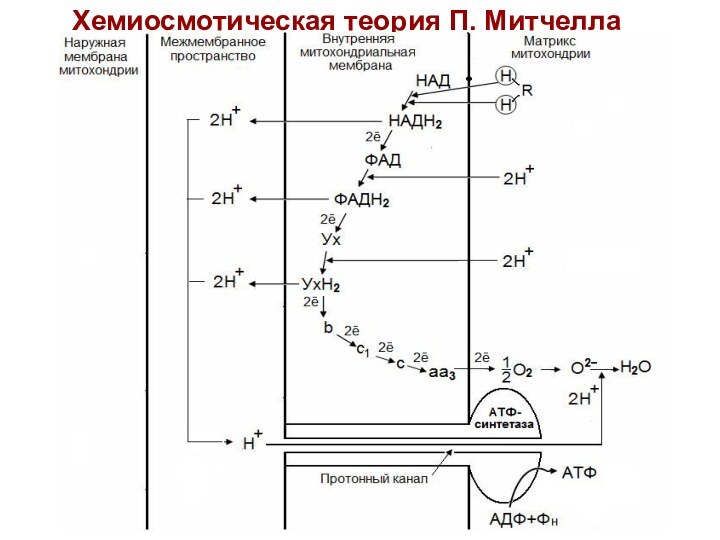
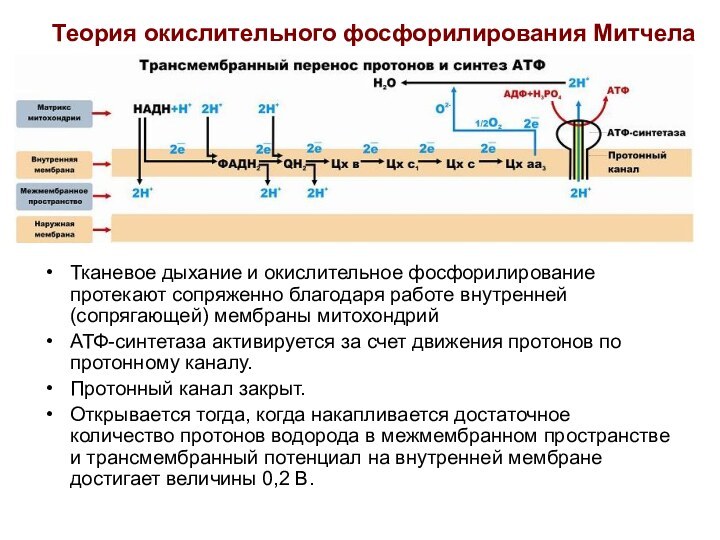
Хемиосмотическая теория П. Митчелла
(1961-1966 гг)
Дыхание и фосфорилирование
связаны между собой через электрохимический потенциал Н+ на митохондриальной
мембране.
Согласно Митчеллу, первичным событием в окислительном фосфорилировании является транслокация H+ на наружную сторону внутренней митохондриальной мембраны, осуществляемую за счет окисления в дыхательной цепи.
Процесс протекает следующим образом:
Слайд 24
ДГГ НАДН2 отдает пару ē на ДГГ ФАД,
что позволяет ФАД принять пару протонов (Н+) из матрикса
с образованием ФАДН2. Пара Н+, принадлежащих НАД выталкивается на наружную поверхность внутренней митохондриальной мембраны.
ДГГ ФАДН2 выталкивает пару Н+ на наружную поверхность внутренней мембраны, а пару ē отдает на убихинон (Ух), который при этом получает способность присоединить пару Н+ из матрикса с образованием УхН2.
УхН2 выталкивает пару Н+ в межмембранное пространство, а ē переносятся через цитохромы на О2 в матриксе. В итоге создается разница потенциалов и разница рН между поверхностями внутренней мембраны.
Слайд 25
Разница потенциалов и разница рН обеспечивает движение протонов
через протонный канал в матрикс. Протонный канал открывается, когда
разность потенциалов превышает 0,2 В.
Движение протонов через протонный канал ведет к активации АТФ-синтетазы и синтезу АТФ из АДФ и Н3РО4.
Транспорт АТФ из матрикса в цитоплазму обеспечивается специфическим переносчиком – транслоказой. Этот фермент катализирует перенос 1 молекулы АТФ с одновременным переносом в обратном направлении одной молекулы АДФ.
Слайд 26
Таким образом, тканевое дыхание заряжает митохондриальную
мембрану, а окислительное фосфорилирование разряжает ее, используя энергию мембранного
потенциала для синтеза АТФ.
Слайд 27
Хемиосмотическая теория П. Митчелла
Слайд 28
Коэффициент окислительного фосфорилирования (Р/О) -
отношение количества связанной Н3РО4 к количеству поглощенного атомарного кислорода.
Р/О
для субстратов, передающих Н+ и е- на НАД = 3,
Р/О для субстратов, передающих Н+ и е- на
ФАД = 2,
Р/О для Vit «С» = 1
Слайд 29
Дыхательный контроль -
усиление дыхания и
фосфорилирования в митохондриях при увеличении концентрации АДФ
Слайд 30
Виды фосфорилирования:
Окислительное
За счет энергии тканевого
дыхания
Субстратное
2 реакции в гликолизе
Транс-
(перефосфорилирование)
Креатин ↔ креатинфосфат
Ионное
при действии ионизирующего излучения
Фотофосфорилирование
Только у растений
Слайд 31
Роль АТФ:
Энергия АТФ тратится на работу
Механическую (мышечное
сокращение)
Химическую (анаболические процессы - синтез веществ)
Осмотическую (транспорт веществ
против градиента концентрации)
Электрическую (генерация нервного импульса)
Тепловую (поддержание температурного гомеостаза)
Слайд 32
соединения, при гидролизе которых высвобождается более
30 кДж/моль энергии.
АТФ, ГТФ, ЦТФ и т.д., АДФ
Креатинфосфат
1,3-дифоглицериновая кислота
Фосфоенолпируват
Карбамоилфосфат
Сукцинил-КоА
Ацетил-КоА
Макроэргические
соединения –
Слайд 33
Гипоэнергетические состояния - снижение синтеза АТФ.
Причины:
Гипоксия
тканей (недостаток О2);
Гиповитаминозы (образуется мало коферментов);
Голодание (отсутствие субстратов
окисления)
Действие разобщителей
Действие ингибиторов ТД и ОФ
Слайд 34
Разобщение тканевого дыхания и окислительного фосфорилирования -
состояние,
при котором потребление кислорода и окисление субстратов продолжаются, а
синтез АТФ невозможен.
Наблюдается при наличии в клетке веществ, способных переносить протоны через внутреннюю мембрану митохондрий.
В этом случае выравнивается градиент концентрации рН, исчезает движущая сила фосфорилирования.
При этом энергия переноса протонов и электронов рассеивается в виде тепла, поэтому температура тела повышается.
Слайд 35
Виды разобщения
1) физиологическое (холод, тироксин, кортикостероиды, женские половые
гормоны)
2) медикаментозное (дикумарин)
3) токсическое (динитрофенол)
Слайд 36
Ингибиторы ТД и ОФ
а) ингибиторы электронного транспорта –
это вещества, которые взаимодействуют с ферментами дыхательной цепи и
тем самым нарушают перенос электронов.
Они являются клеточными токсинами, вызывают тканевую гипоксию. К ним относятся:
Барбитураты и ротенон (инсектицид) – блокируют НАД-ДГГ
Малоновая кислота – блокируют ФАД-ДГГ
Антимицин (антибиотик) – блокирует дыхательную цепь на уровне цитохром в – цитохром с.
Цианиды (ионы СN-), угарный газ (СО), сероводород (Н2S) – блокируют цитохромоксидазу и перенос электронов на кислород.
б) ингибиторы окислительного фосфорилирования
Олигомицин (антибиотик) – угнетает работу АТФ-синтазы (Fо-фрагмент).
Слайд 37
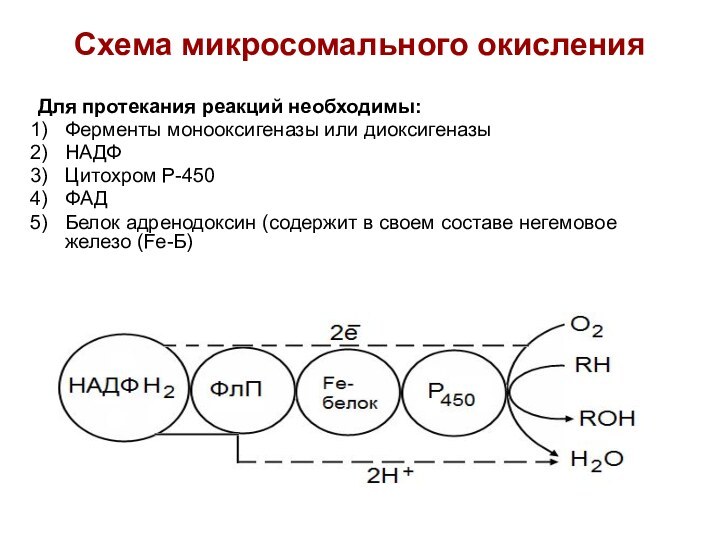
Микросомальное окисление
Протекает в мембранах ЭПР (микросомах) клеток печени
и коры надпочечников.
Не дает клетке энергии
Кислород непосредственно включается в
субстрат с образованием новой гидроксильной группы в реакциях:
1) Гидроксилирования (пролина и лизина в синтезе коллагена, желчных кислот, холестерина, стероидных гормонов)
2) Обезвреживания токсичных веществ
(эндогенных ядов, лекарственных препаратов и др.).
Слайд 38
Схема микросомального окисления
Для протекания реакций необходимы:
Ферменты монооксигеназы или
диоксигеназы
НАДФ
Цитохром Р-450
ФАД
Белок адренодоксин (содержит в своем составе негемовое железо
(Fe-Б)
Слайд 39
Активные формы кислорода (АФК)
Это продукты неполного восстановления кислорода,
содержащие неспаренные электроны. АФК являются свободными радикалами.
Свободные радикалы –
агрессивные молекулы, способные атаковать другие молекулы с целью забрать недостающий электрон.
К активным формам кислорода относят:
ОН• - гидроксильный радикал;
О2- - супероксидный анион;
Н2О2 - пероксид водорода.
Полное восстановление кислорода до воды требует 4-х электронов и катализируется цитохромоксидазой.
О2 + 4 е- + 4 Н+→ 2 Н2О
Но присоединение электронов происходит поэтапно и при этом образуются АФК.
О2 + е- → O2- (супероксидный радикал)
O2 - + е- + 2H+ → H2O2
H2O2 + е- + H+ → H2O + HO• (гидроперекисный радикал)
HO• + е- + H+ → H2O
Слайд 40
Вспомогательные ферменты тканевого дыхания
1) Супероксиддисмутаза (превращает супероксидные
радикалы в
менее токсичную перекись водорода);
2О2-
+ 2Н+ → Н2О2 + О2
2) Каталаза
2Н2О2 → 2Н2О + О2
3) Пероксидаза
Н2О2 + RН2 → 2Н2О + R
Роль каталазы и пероксидазы – разрушение перекиси водорода.
Слайд 41
Владимир Петрович Скулачев
(род. 21 февраля 1935, Москва)
Направление
научной деятельности
Механизмы биологического окисления: трансформации химической энергии в электрическую
на мембранах митохондрий, роли мембранного потенциала как фактора, сопрягающего освобождение и аккумуляцию энергии в клетке.
С 2005 года возглавляет проект по созданию препарата — геропротектора на основе митохондриально-адресованных антиоксидантов.
Слайд 44
Теория окислительного фосфорилирования Митчела
Тканевое дыхание и окислительное фосфорилирование
протекают сопряженно благодаря работе внутренней (сопрягающей) мембраны митохондрий
АТФ-синтетаза
активируется за счет движения протонов по протонному каналу.
Протонный канал закрыт.
Открывается тогда, когда накапливается достаточное количество протонов водорода в межмембранном пространстве и трансмембранный потенциал на внутренней мембране достигает величины 0,2 В.
Слайд 46
Биохимические процессы протекающие в матриксе митохондрий и передающие
водород в дыхательную цепь
Цикл Кребса.
Бета-окисление ВЖК.
Превращение пирувата в ацетил-КоА.
Слайд 48
Гипоэнергетические состояния
Причины:
алиментарные (голодание, гиповитаминозы РР, В2);
гипоксические (нарушения доставки
О2 в клетки);
митохондриальные (действие ингибиторов и разобщителей; митохондриальные болезни)
-
ингибиторы тканевого дыхания
- ингибиторы окислительного фосфорилирования
- разобщители тканевого дыхания и
окислительного фосфорилирования
Слайд 49
В живых клетках АФК образуются:
в реакциях окисления гемоглобина
в
метгемоглобин;
в реакциях, катализируемых оксидазами (пероксид
водорода);
в процессе переноса е- по
дыхательной цепи ( при
передаче электронов с убихинона на цитохром с)
в процессе микросомного окисления (при
передаче электрона с цит. Р 450);
при гипоксии (в митохондриях нарушается работа
цитохромоксидазы, происходит утечка АФК);
при действии ионизирующей радиации и УФО.
Слайд 50
Негативное воздействие свободных радикалов на организм
действуют на SH
– группы белков, что ведет к их
денатурации и инактивации
ферментов;
повреждают ненасыщенные жирные кислоты
фосфолипидов клеточных мембран, запуская
процесс перекисного окисления липидов (ПОЛ),
нарушается функция мембран;
вызывают деполимеризацию гликопротеинов
соединительной ткани;
стимулируют разрывы в молекулах нуклеиновых
кислот, повреждая генетический аппарат клетки
(мутации);
повреждают митохондрии, вызывая нарушение
проницаемости ВММ и нарушение процесса синтеза
АТФ;
усиленная генерация свободных радикалов
кислорода сопровождает болезни Паркинсона,
Альцгеймера и сам процесс старения, ведет к
появлению катаракты.
Слайд 51
Положительное воздействие
свободных радикалов на организм:
Обновление липидного состава мембран;
Из
арахидоновой кислоты образуются
простагландины (ПГ) и их производные
(простациклины и тромбоксаны,
лейкотриены);
Обезвреживание
ксенобиотиков и токсичных
продуктов метаболизма
Функционирование иммунной системы
(фагоциты способны генерировать
свободные радикалы, уничтожая бактерии,
поврежденные и опухолевые клетки)
Слайд 52
Антиоксидантная защита
Неферментативная защита.
Важнейшим компонентом является витамин Е
(токоферол), витамин
размножения.
Токоферол защищает ненасыщенные жирные
кислоты клеточных мембран от перекисного
окисления
Предохраняет от
окисления SH-группы
мембранных белков
Защищает от окисления двойные связи в
молекулах каротинов и витамина А.
Токоферол (совместно с витамином С)
способствует включению селена в состав
активного центра глутатионпероксидазы —
важнейшего фермента антиоксидантной защиты
клеток.
Контролирует синтез гема, цитохромов.
Слайд 53
ФЕРМЕНТАТИВНАЯ АНТИОКСИДАНТНАЯ
ЗАЩИТА КЛЕТКИ ОТ АФК
Супероксиддисмутаза (превращает супероксидные
радикалы в
менее токсичную перекись водорода);
Каталаза (разлагает перекись водорода на воду
и
кислород);
Система глутатиона: трипептид глутатион ( Г –
SH), глутатионпероксидазу (ГП), глутатионредуктазу
(ГР), НАДФН·Н+, селен.