Слайд 2
Аспекты изучения «Физиологии клетки»
ДВИГАТЕЛЬНАЯ ФУНКЦИЯ КЛЕТОК
РЕЦЕПТОРНАЯ
ФУНКЦИЯ КЛЕТОК
ФУНКЦИИ ИЗМЕНЕНИЯ рН В КЛЕТКЕ. ПЕРЕКИСНОЕ ОКИСЛЕНИЕ
ЛИПИДОВ.
КАЛЬЦИЕВАЯ ПРОНИЦАЕМОСТЬ. РОЛЬ КАЛЬЦИЯ В КЛЕТКЕ.
КЛЕТОЧНЫЕ МЕМБРАНЫ
ТРАНСМЕМБРАННЫЙ ТРАНСПОРТ
ПРОНИЦАЕМОСТЬ КЛЕТКИ ДЛЯ МИНЕРАЛЬНЫХ ИОНОВ, НЕЭЛЕКТРОЛИТОВ, ВОДЫ, ОРГАНИЧЕСКИХ КИСЛОТ, КРАСИТЕЛЕЙ.
РОСТ И СТАРЕНИЕ КЛЕТОК
Слайд 3
ДВИГАТЕЛЬНАЯ
ФУНКЦИЯ КЛЕТОК
Слайд 4
Контрактильные механизмы
(приводящие к сокращению или движению):
мышечное
сокращение
движение ресничек и жгутиков
расхождение хромосом при митозе и мейозе
укорочение хромосом, происходящее перед прикреплением к веретену деления
амебоидное движение
циклоз
Слайд 5
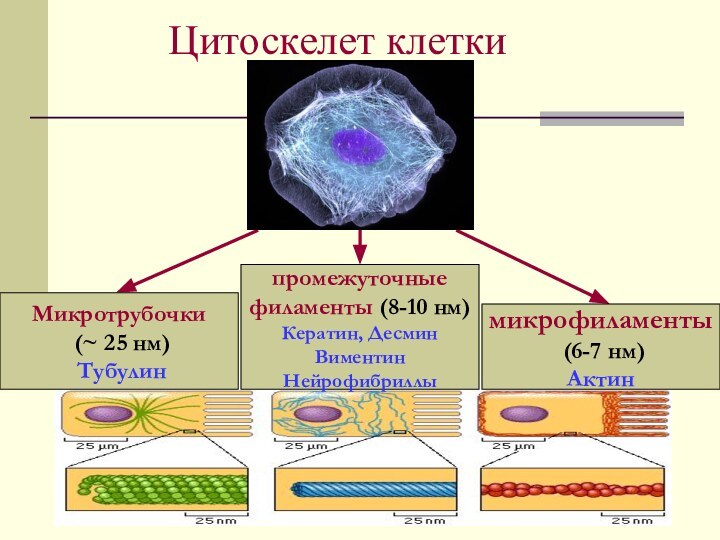
Цитоскелет клетки
Микротрубочки
(~ 25 нм)
Тубулин
микрофиламенты
(6-7
нм)
Актин
промежуточные
филаменты (8-10 нм)
Кератин, Десмин
Виментин
Нейрофибриллы
Слайд 6
Микрофиламенты
(Актиновые филаменты)
Слайд 7
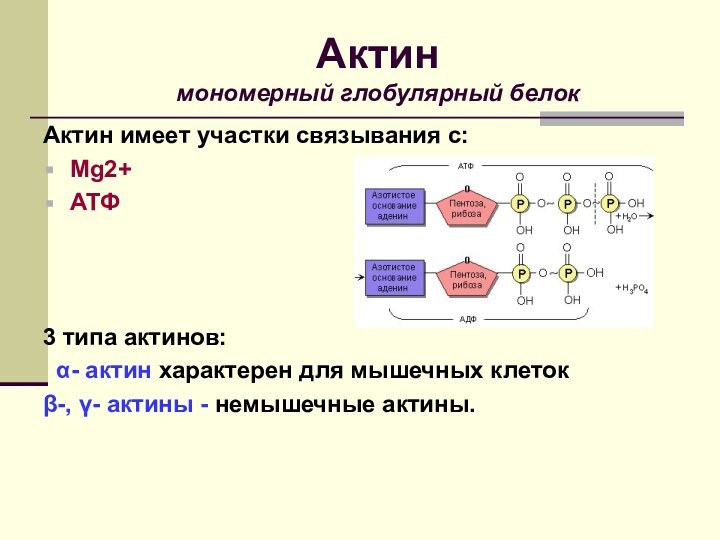
Актин имеет участки связывания с:
Mg2+
АТФ
3 типа
актинов:
α- актин характерен для мышечных клеток
β-, γ-
актины - немышечные актины.
Актин
мономерный глобулярный белок
Слайд 8
Процесс полимеризации-деполимеризации
G-актина
Нуклеация – образование затравок (тримеров)
Элонгация
– рост полимеров засчет присоединения к обоим концам тримера
новых молекул G–актина.
Формирование F-актина - двойная спираль из актиновых мономеров, содержащая по крайней мере 5 специфических участков связывания с системой вспомогательных или актинсвязывающих белков (АСБ):
«+» - конец
«-» – конец
не менее 3-х специфических участков на боковых поверхностях
Диссоциация мономеров на концах, фрагментация филаментов и их стыковка
Слайд 9
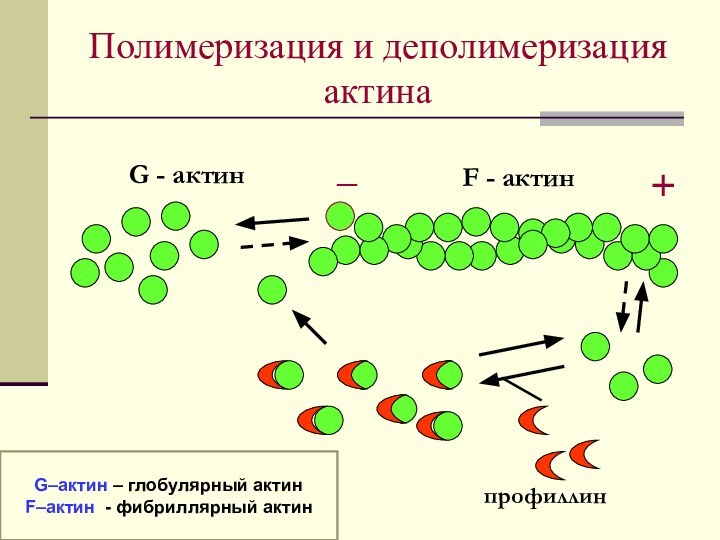
Полимеризация и деполимеризация актина
G - актин
F -
актин
_
+
профиллин
G–актин – глобулярный актин
F–актин - фибриллярный актин
Слайд 10
Типы АСБ
Белки, ингибирующие полимеризацию актина: профиллин
Кэпирующие белки. Кэпирование
«+»-конца F–актина :
гельзолин, виллин, фрагмин. Кэпирование
«-»-конца F–актина:акументин
Стабилизирующие белки: тропомиозин и филамин
Сшивающие
Белки, связывающие актин с мембраной
Немышечный миозин
Слайд 11
Некоторые соединения имитируют действие АСБ, ингибируя полимеризацию и
деполимеризацию актина
Цитохалазины (низкомолекулярные гетероциклические соединения, вторичные метаболиты некоторых грибов)
образуют комплекс с актином и, связываясь с «+»-концом микрофиламента, блокируют полимеризацию, что в конечном счете приводит к разборке фибриллы.
Циклопептид фаллоидин (яд бледной поганки), напротив, стабилизирует актиновые филаменты.
Оба вещества широко используются в исследованиях цитоскелета клетки.
Слайд 12
Функции микрофиламентов
Образование сократимого кольца при цитотомии
Перемещение клетки
Эндо- и
экзоцитоз
Участие в свертывании крови
Все эти процессы обеспичиваются благодаря
Актин-миозиновой
системе- Главный компонент всех сократительных процессов в организме
Слайд 13
Структура миозина
палочковидная хвостовая
часть
две глобулярные головки:
-тяжелые цепи (200 кДа)
-
легкие цепи (18 кДа).
Слайд 19
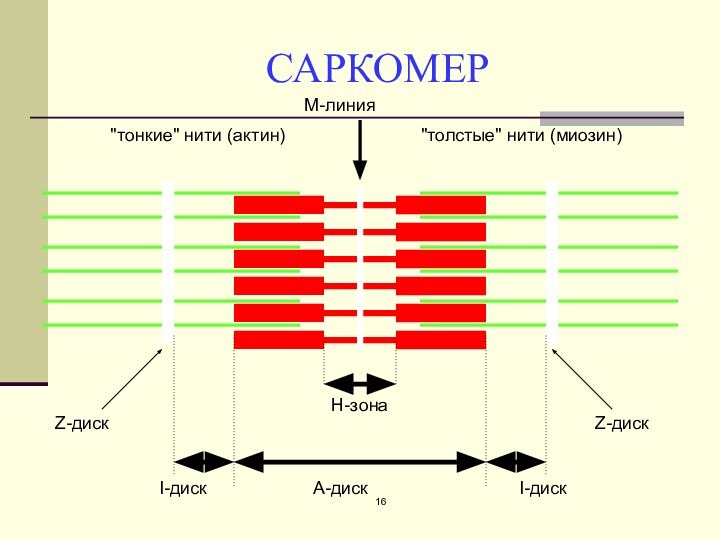
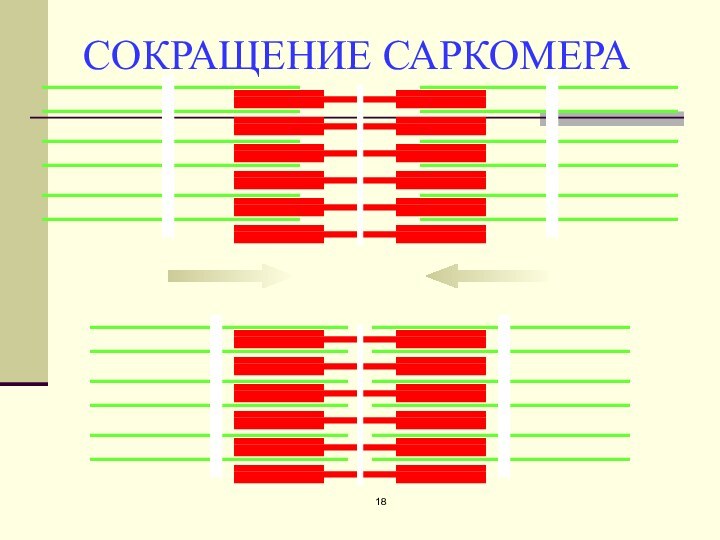
Действие Са2+ во время активации миофибриллы
1- «шейка» миозина
2-
«головка» миозина
3-актиновый мономер
4-тропонин
5-тропомиозин
А- актиновая и миозиновая нити на продольном
срезе
Б – они же на поперечном сечении
Слайд 21
Микротрубочки
Основной белок микротрубочек – тубулин.
У всех эукариотических клеток он представляет собой гетеродимер, состоящий
из молекул α- и β-тубулина, близких по аминокислотным последовательностям.
α- тубулин
β- тубулин
тубулиновый димер
Слайд 22
Полимеризация тубулина
Нуклеация - образование затравок – олигомеры тубулина,
содержащие несколько десятков молекул; образуются нитевидные структуры – протофиламенты,
в которых β-тубулин предшествующего димера контактирует с α-тубулином следующего
Элонгация - надстраивание затравок с формированием плоской пластинки из 13-14 параллельно уложенных и продольно ориентированных протофиламентов, которая по мере удлинения постепенно сворачивается, образуя микротрубочку.
При полимеризации происходит гидролиз ГТФ.
Условия:
- присутствие ГТФ , Mg 2+ ,
- удаление Са 2+
- повышение температуры до 37 градусов.
Слайд 23
ЗАРИСУЙТЕ СХЕМУ ОБРАЗОВАНИЯ МИКРОТРУБОЧЕК
Слайд 25
Соединения, блокирующие полимеризацию-деполимеризацию МТ
колхицин, (растительный алкалоид), связывается
с тубулиновым димером и «+»-концом микротрубочек, препятствуя полимеризации;
колхицин
и винбластин присоединяются к мономерам тубулина и блокируют рост микротрубочек, при этом продолжается и распад микротрубочек;
таксол (выделенный из коры тиса, противоопухлевое лекарство) – стабилизирует микротрубочки, препятствуя деполимеризации.
Слайд 27
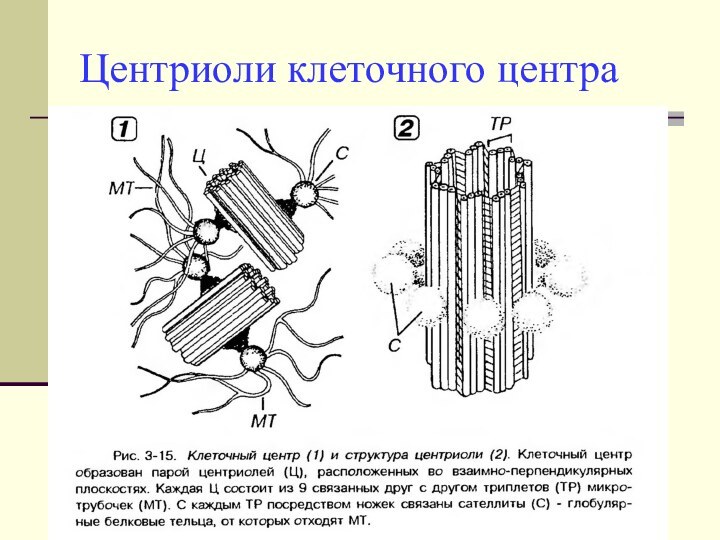
Центриоли клеточного центра
- Состоят из 9-ти триплетов микротрубочек,
располагающихся строго по переферии.
- Триплеты микротрубочек соединены между
собой системой связок, а снаружи одеты чехлом из бесструктурного материала - матриксом.
- Клеточный центр образован парой центриолей, расположенных во взаимно-перпендикулярных плоскостях.
- По периферии центральной части центриолей с каждым триплетом посредством ножек связаны небольшие шарообразные уплотнения цитоплазмы (содержащие белки) – центры организации микротрубочек (ЦОМТ)
- В ЦОМТы заякорены «-» концы микротрубочек.
- «+» – концы микротрубочек направлены дистально относительно ЦОМТ.
В делящихся клетках центриоли принимают участие в формировании веретена деления и располагаются на его полюсах.
Слайд 30
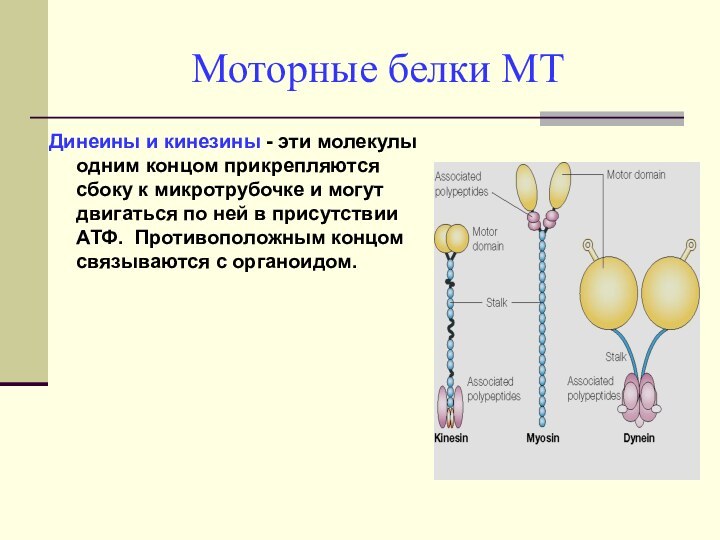
Моторные белки МТ
Динеины и кинезины - эти молекулы
одним концом прикрепляются сбоку к микротрубочке и могут двигаться
по ней в присутствии АТФ. Противоположным концом связываются с органоидом.
Слайд 31
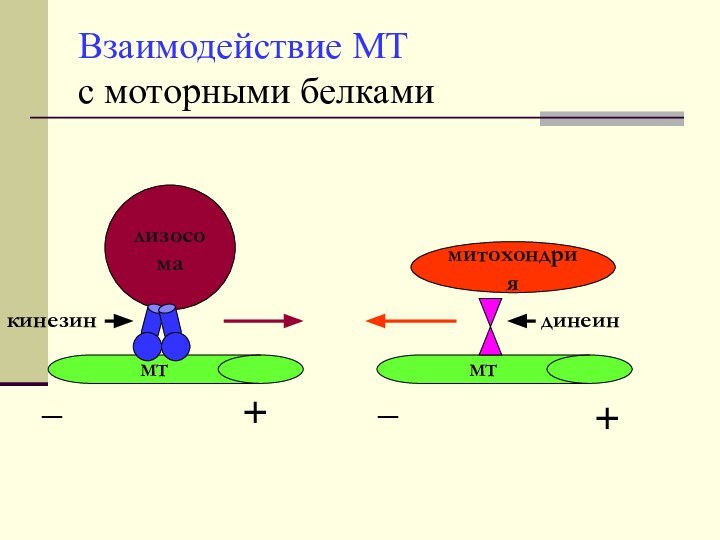
Взаимодействие МТ
с моторными белками
митохондрия
лизосома
МТ
МТ
кинезин
динеин
_
_
+
+
Слайд 33
Представляют собой фибриллы диаметром 8-12 нм.
В
клетке локализуются в виде трехмерной сети преимущественно в околоядерной
области и собраны в пучки, которые направляются к периферии клетки.
Характерны для всех видов клеток, особенно хорошо развиты в клетках, испытывающих механические нагрузки, например, в клетках эпидермиса, мышечных клетках, нейронах.
Основные функции:
- опорная
- поддержание формы клетки
-участие в формировании межклеточных
соединений.
Слайд 34
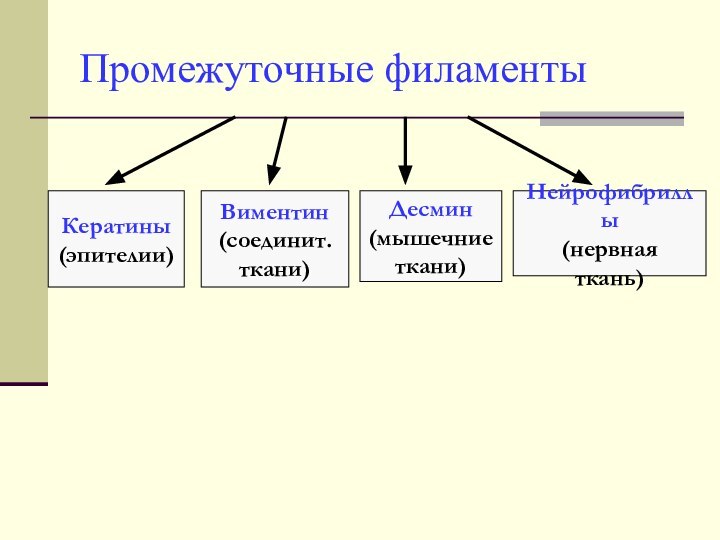
Промежуточные филаменты
Кератины
(эпителии)
Виментин
(соединит.
ткани)
Десмин
(мышечние
ткани)
Нейрофибриллы
(нервная
ткань)
Слайд 35
Промежуточные филаменты
в составе различают:
- центральный консервативный (одинаковый у
всех) домен. Имеет палочковидную форму и состоит из 310
аминокислотных остатков. Образуют суперспирали между двумя молекулами белка.
2 концевых участка сильно варьирующих по длине и по последовательности аминокислот. Не имеют спиральной структуры.
Полимеризация димеров белка происходит путем взаимодействия концевых участков, без затраты энергии АТФ или ГТФ. В результате полимеризации формируются протофибриллы (состоят из 4-х молекул), которые затем объединяются в филаменты диаметром ~ 10 нм.
Центральный домен
Концевой
участок
Слайд 36
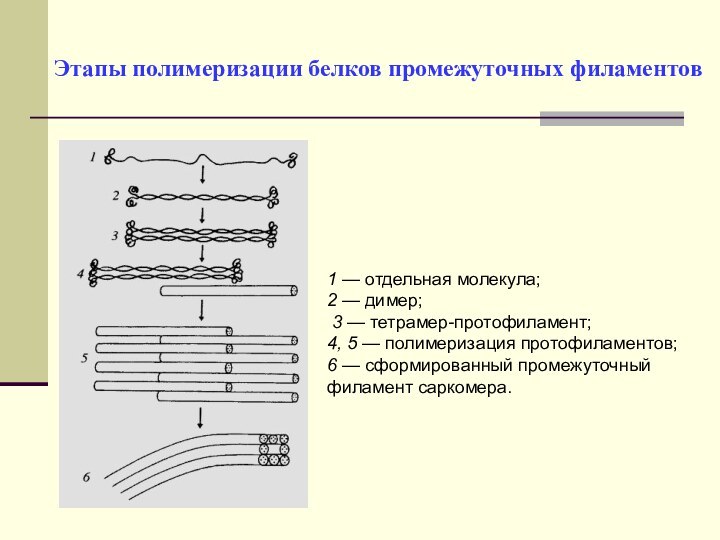
Этапы полимеризации белков промежуточных филаментов
1 — отдельная молекула;
2 — димер;
3 — тетрамер-протофиламент;
4, 5 — полимеризация
протофиламентов;
6 — сформированный промежуточный филамент саркомера.
Слайд 37
Циклоз (течение цитоплазмы) лучше всего выражено в растительных
клетках, но его можно наблюдать и у простейших, в
тканевых культурах животных.
Циклоз характеризует уровень жизнедеятельности клетки и зависит от процессов дыхания и гликолиза.
Разнообразные внешние стимулы (нагрев, повышенное гидростатическое давление, механические воздействия, электрический ток) останавливают движение цитоплазмы.
При освещении ультрафиолетовыми и рентгеновскими лучами, при действии эфира, хлороформа, гербицидов описаны 2-х-фазные изменения – вначале движение ускорялось, а затем замедлялось и останавливалось.
Во многих растительных клетках (элодеи, валиснерии) циклоз может начаться под влиянием внешних воздействий (соли металлов, сапонин, видимый свет). Такое индуцированное движение обычно называют вторичным, в отличие от спонтанного, или первичного, движения, характерного например, для клеток нителлы, корневых волосков многих растений.
Слайд 38
Циклоз
В основе циклоза лежит функционирование сократительных белков, обладающих
АТФ-азной активностью, например может быть обусловлено сокращением МТ.
МТ
обнаружены в растительных клетках, где наблюдается интенсивно движение цитоплазмы; много МТ в гладких миоцитах;
МТ и нейрофиламенты регулируют транспорт веществ по аксону и дендритам в том или ином направлении.
Слайд 39
Амебоидное движение
Амебоидным движением обладают самые разнообразные клетки
– простейшие из класса саркодовых, зооспоры, некоторые сперматозоиды и
яйцеклетки, плазмодии миксомицетов, фибробласты, лейкоциты, эпителиоциты и нейроны в тканевых культурах, клетки эмбрионов позвоночных. Хорошо развито амебоидное движение у миобластов, из которых развиваются миосимпласты. При регенерации эпителия клетки становятся подвижными и путем амебоидных движений перемещаются в глубь раны. Одним из способов злокачественных новообразований внутри организма является амебоидное движение раковых клеток.
Слайд 40
Амебоидное движение состоит в медленном перетекании тела
клетки по субстрату и осуществляется благодаря внутриклеточному течению цитоплазмы
и образованию временных псевдоподий.
Скорость амебоидного движения зависит от температуры и кислотности среды, от осмотического давления, от соотношения одновалентных и 2-х-валентных катионов. Недостаток кислорода замедляет амебоидное движение. Под влиянием любого сильного раздражителя (нагревание до 40 С, встряхивание) амебоидное движение прекращается.
Слайд 41
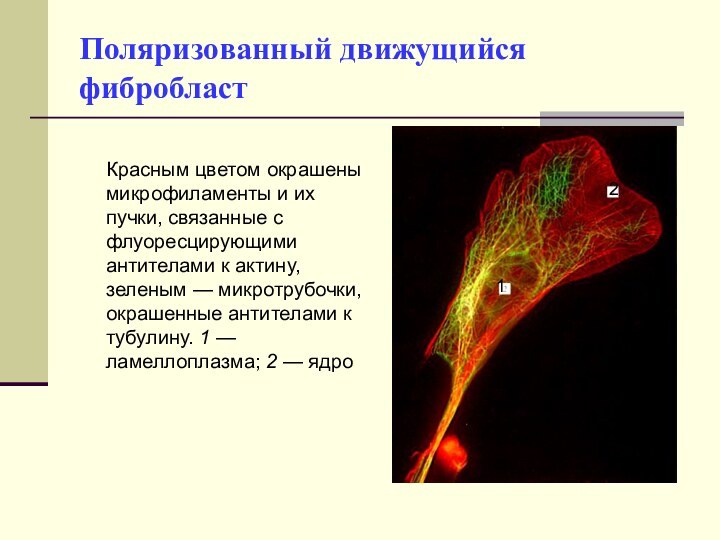
Поляризованный движущийся фибробласт
Красным цветом окрашены
микрофиламенты и их пучки, связанные с флуоресцирующими антителами к
актину, зеленым — микротрубочки, окрашенные антителами к тубулину. 1 — ламеллоплазма; 2 — ядро
1
2
Слайд 42
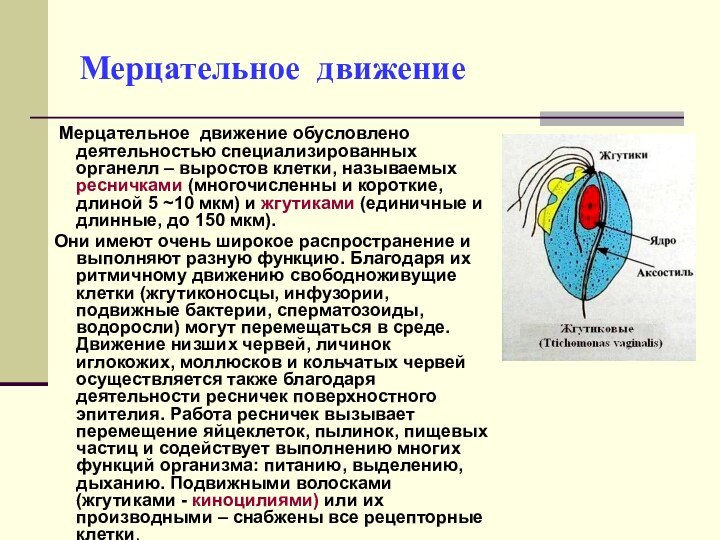
Мерцательное движение
Мерцательное движение обусловлено деятельностью специализированных органелл
– выростов клетки, называемых ресничками (многочисленны и короткие, длиной
5 ~10 мкм) и жгутиками (единичные и длинные, до 150 мкм).
Они имеют очень широкое распространение и выполняют разную функцию. Благодаря их ритмичному движению свободноживущие клетки (жгутиконосцы, инфузории, подвижные бактерии, сперматозоиды, водоросли) могут перемещаться в среде. Движение низших червей, личинок иглокожих, моллюсков и кольчатых червей осуществляется также благодаря деятельности ресничек поверхностного эпителия. Работа ресничек вызывает перемещение яйцеклеток, пылинок, пищевых частиц и содействует выполнению многих функций организма: питанию, выделению, дыханию. Подвижными волосками (жгутиками - киноцилиями) или их производными – снабжены все рецепторные клетки.
Слайд 43
Реснички и жгутики
Основной тип движения жгутиков –
ундулирующее или волнообразное (синусоидальное, распространяющееся в одном направлении, либо
от основания жгутика к его вершине, либо наоборот). Большинство ресничек действует наподобие весел, производя гребущие взмахи. Интенсивность движения ресничек и жгутиков зависит от температуры и концентрации Н+.
Жгутики одной клетки могут функционировать относительно независимо друг от друга, деятельность ресничек простейших и мерцательного эпителия проявляет четкую согласованность. При постепенной наркотизации исчезает координация движения ресничек и они начинают колебаться независимо друг от друга, а затем их двигательная активность прекращается.
Ресничкам и жгутикам присущ автоматизм, будучи изолированными они ритмически двигаются, но движения их не координированы. Для нормального функционирования реснички (жгутика) необходима связь ее с базальным тельцем, расположенным у основания реснички (жгутика).