Слайд 2
Очевидно, что дифференцировка пола происходит на нескольких уровнях:
1) генетическом;
2) гонадном; 3) гормональном;
4) фенотипическом;
5)
психологическом. Наследственные нарушения на каждом из этих уровней могут приводить к репродуктивной дисфункции
Слайд 3
Этапы созревания половых клеток
Слайд 4
У человека первичные половые клетки могут быть обнаружены
в первичной полоске уже на 16-18 день развития, а
их детерминация происходит еще раньше. Затем они долго мигрируют, попадая в желточный мешок, энтодерму средней кишки и на 6-ой неделе развития –
в половые валики (зачатки гонад), где преобразуются в оогонии или сперматогонии
Слайд 5
В течение последующих 3-4 месяцев оогонии делятся митотически,
в результате их количество от исходных 1500-2000 возрастает до
нескольких миллионов. Максимальное число оогониев (до 7 млн) наблюдается в яичниках плодов женского пола на 7-ом месяце беременности.
Сразу за периодом размножения следует апоптоз, и большая часть оогониев погибают, а оставшиеся вступают в мейоз, но не заканчивают его, так как их деление блокируется на стадии диплотены
Слайд 6
Они окружаются фолликулярными клетками и в виде ооцитов
1-го порядка сохраняются до половой зрелости. Количество ооцитов к
концу беременности и у новорожденных уменьшается до 2 млн., к 7 годам – до 300 тысяч, а к началу полового созревания – до 40 тысяч.
Реально в течение всей жизни женщины овулирует не более 400-500 ооцитов
Слайд 7
До момента овуляции выжившие ооциты I порядка проходят
период роста и вновь вступают в мейоз, который останавливается
на стадии метафазы 2, когда они превращаются в ооциты 2-го порядка.
Мейоз полностью заканчивается лишь с началом оплодотворения
Слайд 8
У половозрелых мужчин общая продолжительность сперматогенеза составляет 70-72
дня.
За это время стволовые клетки сперматогенного ряда (сперматогонии)
проходят путь развития до зрелых сперматозоидов. Сперматогонии образуются из первичных половых клеток путем митоза – этот процесс происходит в эмбриональном периоде при формировании мужских гонад
Слайд 9
Затем они окружаются клетками целомического эпителия, образуя «половые
тяжи», и остаются в недифференцированном виде вплоть до начала
полового созревания. Основные этапы дифференцировки сперматозоидов проходят во время первой фазы сперматогенеза – тестикулярной
Слайд 10
После митотического деления и дифференцировки сперматогонии вступают в
два последовательных деления мейоза, образуя сперматоциты 1-го, а затем
2-го порядка и сперматиды с гаплоидным числом хромосом.
Эти процессы происходят в стенке извитых семенных канальцев. При этом клетки сперматогенного ряда находятся в цитоплазме клеток Сертоли
Слайд 11
Во время второй фазы сперматогенеза – эпидидемальной –
завершается созревание спермиев, и они приобретают подвижность. Ежедневно у
мужчин активного репродуктивного возраста образуется свыше 10 миллионов зрелых сперматозоидов
Слайд 12
До 6-недельного возраста зачатки гонад у эмбриона развиваются
как бипотенциальные образования.
Их дифференцировка в семенник или яичник
зависит от хромосомного набора первичных половых клеток, мигрирующих в эмбриональную гонаду
Слайд 13
Развитие по мужскому типу и дифференцировка гонады в
семенник запускается тестис-детерминирующим фактором (TDF), появление которого обусловлено наличием
Y хромосомы в первичных половых клетках.
При отсутствии Y хромосомы в гоноцитах бипотенциальные эмбриональные гонады формируются в яичник, и развитие идет по женскому пути
Слайд 14
Генетический контроль и наследственные нарушения половой дифференцировки
Слайд 15
Таким образом, определяющую роль в первичной детерминации пола
у млекопитающих играет Y-хромосома. Это свойство Y-хромосомы определяется наличием
в ней гена SRY, продуктом которого является TDF – транскрипционный фактор, способный связываться с промоторами генов, детерминируюших половую дифференцировку
Слайд 16
При мужском кариотипе и делеции гена SRY развитие
идет по женскому типу, хотя при этом оно сопровождается
дисгенезией гонад. Эта наследственная патология получила название
синдрома Свайера.
Все пациентки с женским фенотипом и наличием Y хромосомы должны подвергаться удалению гонад, так как велика вероятность их озлокачествления
Слайд 17
С другой стороны перенос на X-хромосому или аутосому
локуса Yp11.31, содержащего ген SRY, приводит к формированию мужского
фенотипа при женском кариотипе –
синдром де Ля Шапеля.
У таких мужчин наблюдаются нарушения репродуктивной функции, обусловленные отсутствием локуса AZF (Yq11.21), участвующего в генетическом контроле сперматогенеза
Слайд 18
В детерминации пола участвуют не только гены Y-хромосомы,
но также аутосомные и Х-хромосомные гены.
В настоящее время
идентифицировано несколько десятков генов, участвующих в контроле развития либо яичек, либо яичников
Слайд 19
Среди первой группы SRY-родственный ген SOX9. Ко второй
группе относится ген DAX1.
В морфогенезе гонад на ранней
бипотенциальной стадии участвует также ген WT1– ключевой регулятор морфогенеза мочеполовой системы.
Ген WT1 трансактивирует ген SRY, а также ген SF1 стероидогенного фактора 1, участвующего в дифференцировке гонад и стероидогенезе.
Ген SF1, в свою очередь, активирует ген DAX1
Слайд 20
До начала половой дифференцировки выводящая система эмбриона представлена
вольфовыми и мюллеровыми протоками.
Обособление наружных половых органов начинается
с пятой недели беременности.
У женщин мюллеровы протоки преобразуются в фаллопиевы трубы, матку и верхнюю треть влагалища, а вольфовы протоки атрофируются
Слайд 21
У мужчин наоборот, мюллеровы протоки атрофируются, а вольфовы
преобразуются в семявыносящие протоки и семенные пузырьки.
За развитие
мюллеровых протоков отвечает ген WNT4, продуктом которого является цистеин-богатый секретируемый гликопротеин, принадлежащий семейству внеклеточных сигнальных факторов Wnt
Слайд 22
Ген WNT4 экспрессируется в желтом теле и его
продукт на ранних стадиях фолликулярного роста, участвует в регрессии
клеток Лейдига и в контроле мезенхимально-эпителиального перехода, необходимого для развития нефрона.
Согласованная экспрессия генов
DAX1, SF1 и WNT4
необходима для закладки и развития яичников
Слайд 23
Половая дифференцировка гонад сама по себе недостаточна для
формирования мужского или женского фенотипа.
Вторичная детерминация пола происходит
под действием гормонов, вырабатываемых надпочечниками и половыми железами
Слайд 24
В формировании мужского фенотипа участвуют два гормона: антимюллеровый,
вызывающий регрессию мюллеровых протоков, и тестостерон, или андроген,
под влиянием которого формируются не только половые органы, но и вторичные мужские половые признаки
Слайд 25
Ген антимюллерового гормона AMH активируется геном SRY на
7-ой неделе беременности, и его экспрессия продолжается до пубертатного
периода.
Биосинтез тестостерона активируется продуктом гена SF1.
Важную роль в формировании мужских половых признаков играет не только андроген, но и его рецептор, кодируемый геном AR
Слайд 26
Важную роль в детерминации пола играют также эстрогены
и их рецепторы.
Однако при недостаточности мужских половых гормонов
наружные половые органы формируются по женскому типу независимо от наличия или отсутствия эстрогенов
Слайд 27
Мы перечислили только ключевые этапы первичной половой дифференцировки.
Функциональные взаимоотношения между контролирующими эти процессы генами, определяют
особенности репродуктивной системы, а нарушения их работы ассоциированы с развитием наследственных заболеваний, затрагивающих половую сферу
Слайд 28
Наследственные нарушения мужской половой дифференцировки, или реверсии пола
XY (РПXY) — это генетически гетерогенная группа заболеваний, характеризующихся
развитием половой системы по женскому типу при нормальном мужском кариотипе
Слайд 29
Одним из генетических вариантов РПXY является синдром Свайера.
К
сходному фенотипу могут приводить дупликации гена DAX1. Инактивирующие мутации
в гене DAX1 найдены у мальчиков с врожденной гипоплазией надпочечников, сочетающейся с гипогонадотропным гипогонадизмом
Слайд 30
К РПXY могут приводить доминантные мутации в гене
SF1 и микроделеции цитогенетической области 9p24.3.
В последнем
случае реверсия пола при кариотипе 46,XY с формированием наружных женских гениталий и матки не сопровождается какими-либо другими проявлениям хромосомного дисбаланса
Слайд 31
Аутосомно-рецессивный тип РПXY обусловлен мутациями в гене транскрипционного
фактора, участвующего в морфогенезе гонад на ранней бипотенциальной стадии
– CBX2
Слайд 32
Аутосомно-доминантные типы РПXY могут быть обусловлены мутациями в
генах митоген-активирующей киназы, участвующей в контроле апоптоза (MAP3K1); одного
из регуляторов полового морфогенеза (DHH) и фермента, дигидродиолдегидрогеназы, участвующего, в частности, в метаболизме глюкокортикоидов, прогестинов и простагландинов (AKR1C2)
Слайд 33
Реверсия пола при мужском кариотипе может наблюдаться у
больных кампомелической дисплазией, обусловленной мутациями в гене транскрипционного фактора
Sox9, который является одним из наиболее ранних маркеров дифференцировки яичек. Подчеркнем еще раз, что ген SOX9 активируется продуктом гена SRY. А сам ген SRY, также как ген SF1, активируются продуктом гена WT1
Слайд 34
Поэтому неудивительно, что некоторые мутации в гене WT1
сопровождаются генитальными аномалиями у мужчин, вплоть до полной реверсии
пола.
Эти аномалии сочетаются с почечной недостаточностью и высокой предрасположенностью к возникновению опухолей почек и гонад – аллельные синдромы Дениса-Драша, Фрейзера, Мичема
Слайд 35
Причиной реверсии пола ХХ (РПХХ), то есть развития
половой системы по мужскому типу при кариотипе 46,XX, могут
быть
транслокации гена SRY на Х-хромосому (синдром де Ля Шапеля), а также делеции и транслокации проксимального отдела короткого плеча хромосомы 9
Слайд 36
Мутации в гене WNT4 обнаруживаются при двух аллельных
заболеваниях с РПХХ: аутосомно-доминантной аплазии мюллеровых протоков у женщин
в сочетании с гиперандрогенизмом и летальном аутосомно-рецессивном
SERKAL-синдроме (РПXX в сочетании с дизгенезией почек, надпочечников и легких).
При дупликациях гена SOX9 с увеличением уровня его экспрессии также наблюдается мужской фенотип при кариотипе 46XX
Слайд 37
Некоторые мутации в перечисленных выше генах приводят к
различным формам гермафродитизма.
К мужскому ложному гермафродитизму
могут приводить дефекты чувствительности тканей-мишеней к андрогенам, обусловленные, в частности, мутациями в генах антимюллерового гормона (AMH) и его рецептора (AMHR2) — аутосомно-рецессивные синдромы персистенции (незаращения) мюллеровых протоков
Слайд 38
Больные мужчины при нормальном кариотипе имеют женское строение
наружных половых органов в сочетании с гипоспадией и микропенисом.
Клиническими проявлениями заболевания могут быть паховые грыжи, недостаточное оволосение лобковой и подмышечной областей, часто в сочетании с женственным фенотипом. При обследовании могут быть обнаружены фаллопиевы трубы в паховом канале, в некоторых случаях — зачатки матки
Слайд 39
Дефекты метаболизма тестостерона в периферических тканях, обусловленные мутациями
в гене стероидной 5-альфа-редуктазы 2 (SRD5A2), также являются одной
из наследственных причин развития мужского ложного гермафродитизма. Клиническими проявлениями этого синдрома являются неполная вирилизация наружных половых органов, гипоспадия со слепо заканчивающимся влагалищем, крипторхизм и гипоплазия предстательной железы
Слайд 40
В большинстве случаев наружные половые органы имеют женский
тип при наличии яичек в паховом канале. Иногда при
достижении пубертатного периода наступает выраженная вирилизация наружных половых органов, требующая хирургической коррекции пола
Слайд 41
Врожденный идиопатический гипогонадотропный гипогонадизм (ВИГГ) характеризуется низким уровнем
циркулирующих гонадотропинов и тестостерона с выраженной задержкой полового созревания
при отсутствии каких-либо иных гипоталамус-гипофизарных аномалий
Слайд 42
Эта патология может развиваться при недостаточной секреции гонадотропин-рилизинг
гормона (ГнРГ) – декапептида гипотоламуса, который является ключевым нейрорегулятором
репродуктивных процессов.
Сопутствующими проявлениями заболевания могут быть варьирующие по степени тяжести расстройства обоняния (синдром Каллмана), расщепление неба, нейросенсорная тугоухость
Слайд 43
В настоящее время идентифицированы гены 18 наследственных типов
ВИГГ.
Эти гены составляют генетическую сеть, ответственную за нейроэндокринный
контроль репродукции человека.
При этом мутации в нескольких генах в различных комбинациях могут приводить к изолированной недостаточности ГнРГ
Слайд 44
Почти у 20% больных ВИГГ одновременно присутствуют мутации
в двух и более генах, причем в большинстве олигогенных
случаев, по крайней мере, один ген принадлежит к семейству фибробластных факторов роста
Слайд 45
Генетически гетерогенный синдром Каллмана объясняет около 20% всех
случаев ВИГГ.
Х-сцепленный тип заболевания обусловлен мутациями в гене
KAL1, который активно экспрессируется в обонятельных нервах, а его продукт участвует в контроле миграции ГнРГ
Слайд 46
При аутосомно-доминантном типе мутации найдены в гене рецептора
1 фибробластных факторов роста (FGFR1) иногда в сочетании с
гетерозиготными мутациями в генах фибробластного фактора роста 8 (FGF8) и рецептора ГнРГ (GNRHR). Причем изолированные доминантные мутации в каждом из этих двух генов также могут приводить к ВИГГ
Слайд 47
Вторыми по частоте являются типы ВИГГ, обусловленные мутациями
в генах прокинецитина 2 (PROK2) и его рецептора (PROKR2).
Они составляют около 10% всех случаев заболевания
Слайд 48
Прокинецитины – это небольшие секреторные белки, участвующие в
регуляции циркадных ритмов.
Они присутствуют в гипоталамусе и обонятельных
луковицах и действуют как хемоаттрактанты для нейрональных предшественников.
Остальные типы ВИГГ, включая тот, который обусловлен рецессивными мутациями в гене ГнРГ (GNRH),встречаются значительно реже
Слайд 50
Наследственные причины первичного бесплодия достаточно разнообразны, при этом
нужно различать мужское и женское бесплодие.
Все варианты реверсии
пола и гермафродитизма сопровождаются бесплодием
Слайд 51
Нарушения гаметогенеза являются одним из ведущих проявлений хромосомных
болезней.
У 2-3% мужчин выявляется олигозооспермия или азооспермия.
При этом у 10-15% мужчин с азооспермией и у 5-8% с олигозооспермией встречаются аномалии кариотипа
Слайд 52
До 30% случаев необструктивной азооспермии и тяжелой олигозооспермии
вызваны микроделециями, возникающими de novo в клетках сперматогенного ряда
Слайд 53
До 30% случаев необструктивной азооспермии и тяжелой олигозооспермии
вызваны микроделециями, возникающими de novo в клетках сперматогенного ряда.
Чаще всего эти дефекты располагаются в дистальной части длинного плеча Y-хромосомы, где находится локус AZF, получивший название
«фактора азооспермии»
Слайд 54
Этот локус содержит 3 участка
(AZFa, AZFb и
AZFc),
в каждом из которых присутствуют гены, участвующие в
контроле сперматогенеза.
Чаще всего у больных мужчин наблюдаются микроделеции локуса AZFc.
Делеции в локусе AZFb связывают с более тяжелыми нарушениями сперматогенеза.
Делеции в AZFa обычно
обнаруживаются при
синдроме «только клетки Сертоли» I типа
Слайд 55
В среднем, частота микроделеций в локусе AZF при
азооспермии составляет 15% и при тяжелой олигозооспермии – 6%.
В дополнение к делециям этого локуса к необструктивной азооспермии и гипосперматогенезу приводят мутации в гене USP9Y, расположенном в локусе AZFa
Слайд 56
Конечно, AZF – не единственный локус, связанный со
сперматогенезом.
Наследственная
сперматогенная недостаточность (СН) может быть связана с
реорганизациями хромосомы 1.
Основными причинами моногенных форм СН являются дефекты мейоза в сперматоцитах или нарушения морфологии сперматозоидов
Слайд 57
К первому классу относится СН, обусловленная мутациями в
гене белка 3 синаптонемального комплекса (SYCP3).
Причиной другого типа
СН являются нарушения в работе специфического сперматогенного катионного канала, обусловленные мутациями в гене CATSPER
Слайд 58
Необычная морфология сперматозоидов (крупная головка, многожгутиковость) в сочетании
с их полиплоидией, обусловлена мутациями в гене AURKC, продуктом
которого является протеинкиназа, участвующая в разделении центросомы и сегрегации хромосом в митозе.
Дефекты акросом, приводящие к глобозооспермии, обусловлены мутациями в гене сперматогенез-ассоциированного белка 16 (SPATA16)
Слайд 59
Однако в 75% случаев причиной глобозооспермии у мужчин
разного этнического происхождения является присутствие гомозиготных 200-кб делеций, затрагивающих
ген DPY19L2.
Этот ген избирательно экспрессируется в тестикулах и участвует в контроле сперматогенеза
Слайд 60
При муковисцидозе наблюдается прогрессирующая непроходимость семявыводящих протоков и
нарушения сперматогенеза.
Больные муковисцидозом мужчины, как правило, бесплодны
Слайд 61
В настоящее время описаны более 80 мутаций в
гене муковисцидоза (CFTR), которые приводят к врожденному билатеральному отсутствию
семявыносящих протоков и азооспермии, иногда без проявления других признаков муковисцидоза
Слайд 62
Кроме того, частота гетерозиготных носителей мутаций в гене
CFTR среди пациентов с билатеральным отсутствием семявыносящих протоков составляет
47%.
По крайней мере, 14% мужчин с азооспермией и 17% – с олигозооспермией являются гетерозиготными носителями мутаций в гене CFTR
Слайд 63
Наследственными вариантами первичного женского бесплодия являются гипергонадотропная дисгенезия
яичников и синдром преждевременной недостаточности яичников.
Дизгенезия яичников объясняет
около половины случаев первичной аменореи и часто она связана с крупными перестройками в
Х-хромосоме
Слайд 64
Аутосомно-рецессивная гипергонадотропная дисгенезия яичников 1-го типа в сочетании
с тяжелым остеопорозом и некоторыми другими нарушениями обусловлена мутациями
в гене рецептора фолликуло-стимулирующего гормона (FSHR). Это моногенное заболевание особенно часто встречается в Финляндии
Слайд 65
Причиной развития
Х-сцепленной дизгенезии яичников 2-го типа являются
доминантные мутации в гене костного морфогенетического белка, участвующего в
регуляции фолликулогенеза (BMP15)
Слайд 66
Синдром преждевременной недостаточности яичников – это гетерогенная группа
заболеваний, при которых вторичная аменорея с повышенным уровнем сывороточных
гонадотропинов развивается в возрасте до 40 лет.
В настоящее время идентифицированы 8 генов, ассоциированных с этим заболеванием
Слайд 67
Три из них оказались локализованы в длинном плече
Х-хромосомы – FMR1, DIAPH2 и POF1В.
Мутации в каждом
из этих генов обладают доминантным эффектом.
Слайд 68
Напомним, что динамические мутации в гене FMR1, обусловленные
экспансией CGG-повтора, приводят к синдрому Мартина-Белл.
У больных женщин
с преждевременной недостаточностью яичников обнаруживаются премутации в гене FMR1, то есть количество CGG-триплетов колеблется в пределах от 40 до 50
Слайд 69
Ген DIAPH2 участвует в контроле цитокинеза, а ген
POF1В кодирует актин-связывающий белок.
В некоторых случаях у больных
женщин присутствуют сбалансированные транслокации, затрагивающие длинное плечо Х-хромосомы.
При этом в точках разрыва часто оказываются локализованы гены
DIAPH2 или POF1В
Слайд 70
Еще один сцепленный с Х-хромосомой доминантный тип преждевременной
недостаточности яичников является аллельным вариантом дизгенезии яичников 2 типа,
так как обусловлен мутациями в гене BMP15.
Аутосомно-доминантные типы заболевания обусловлены мутациями в генах транскрипционных факторов, преимущественно экспрессирующихся в ооцитах (FOXL2; NOBOX и FIGLA)
Слайд 72
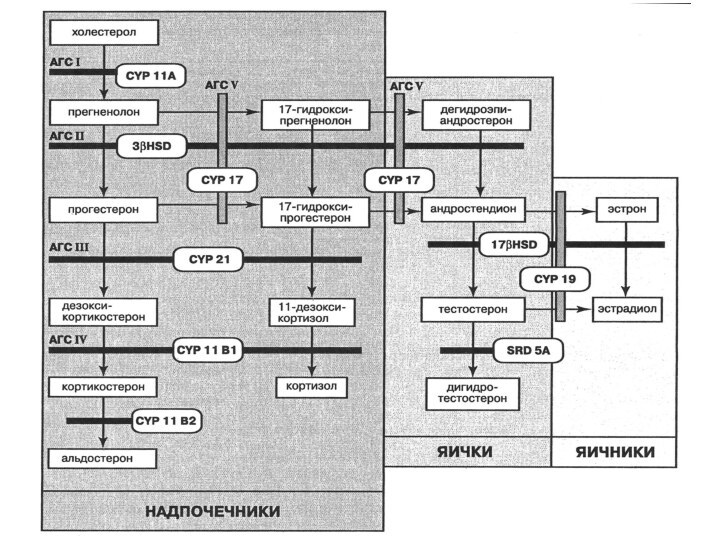
Адреногенитальный синдром (АГС) — это гетерогенная группа аутосомно-рецессивных
заболеваний, обусловленных мутациями в генах ферментов биосинтеза
стероидных гормонов
надпочечников.
Уменьшение или отсутствие активности некоторых ферментов стероидогенеза сопровождается гиперплазией коры надпочечников
Слайд 73
При этом нарушается выработка кортизола надпочечниками, и его
дефицит приводит к избыточной продукции АКТГ-зависимых стероидов.
Общая распространенность
АГС в разных популяциях составляет 1 случай на
5000 – 15000 новорожденных.
В настоящее время описано 5 генетических типов АГС.
Дефициту каждого из ферментов соответствует специфическая клиническая картина заболевания
Слайд 75
Наиболее распространенным является 3 тип АГС, или синдром
дефицита 21-гидроксилазы, объясняющий более 90% всех случаев заболевания.
Он
обусловлен мутациями в гене ключевого фермента биосинтеза гормонов коры надпочечников – 21-гидроксилазы (CYP21A2).
Этот фермент катализирует превращение 17-гидроксипрогестерона в 11-дезоксикортизол
Слайд 76
Следствием дефицита 21-гидроксилазы является уменьшение содержания кортизола и
альдостерона в плазме крови, избыточная секреция АКТГ, повышение продукции
предшественников кортизола, андрогенов и половых стероидов. АКТГ непрерывно стимулирует синтез цитохромов P450, вовлеченных в производство кортизола
Слайд 77
Накопление 17-гидроксипрогестерона вызывает потерю натрия и задержку калия,
что сопровождается потерей воды.
Гиперэкспрессия АКТГ стимулирует синтез андрогенных
предшественников и тестостерона, что приводит к нарушениям развития половой сферы, а также сопровождается повышенным выбросом меланостимулирующего гормона, объясняющим, в частности, гиперпигментацию наружных гениталий
Слайд 78
Заболевание характеризуется значительным клиническим полиморфизмом. Классические варианты делятся
на тяжелую сольтеряющую и более легкую, простую (вирильную) формы
Слайд 79
В первом случае у больных наблюдаются выраженные нарушения
солевого обмена в виде гипонатриемии и гиперкалиемии, которые у
новорожденных или в раннем неонатальном периоде могут приводить к внезапным кризам
Слайд 80
Длительность кризов варьирует от нескольких минут до получаса,
а иногда они заканчиваются гибелью больного.
На 2–3-й неделе
жизни у ребенка появляются неспецифические симптомы: вялое сосание, частые срыгивания и рвота, диарея, потеря массы тела
Слайд 81
Нарастание электролитных нарушений приводит к развитию гипонатриемической дегидратации,
гиперкалиемии, метаболическому ацидозу и кардиогенному шоку. Нарушения
солевого метаболизма сопровождаются различными пороками развития наружных половых органов, выраженность которых зависит от степени остаточной активности дефектного фермента
Слайд 82
Простая форма заболевания, составляющая 1/3 всех случаев, проявляется
в виде изолированной вирилизации наружных половых органов без грубых
нарушений гормонального метаболизма.
У девочек с рождения наблюдаются признаки маскулинизации, иногда затрудняющие определение пола ребенка
Слайд 83
У мальчиков вирильная форма диагностируется с 5 лет
и старше при появлении признаков преждевременного полового и физического
развития, что может быть причиной неадекватного поведения. Преждевременное созревание костной ткани приводит к низкорослости.
Рост больных женщин, в среднем, составляет 140-150 см, а мужчин — на 10 см больше
Слайд 84
Неклассические или взрослые варианты АГС включают различные нарушения
полового созревания в подростковом или пубертатном возрасте в виде
гирсутизма, угрей, аменореи, бесплодия.
Для девочек характерно раннее менархе до развития молочных желез, маскулинное телосложение
Слайд 85
Ген CYP21A2 расположен в области локализации генов HLA-комплекса,
которая отличается высокой рекомбиногенной и мутагенной активностью.
В непосредственной
близости от гена CYP21A2 расположен псевдоген CYP21A1P, неактивный вследствие наличия целой серии мутаций
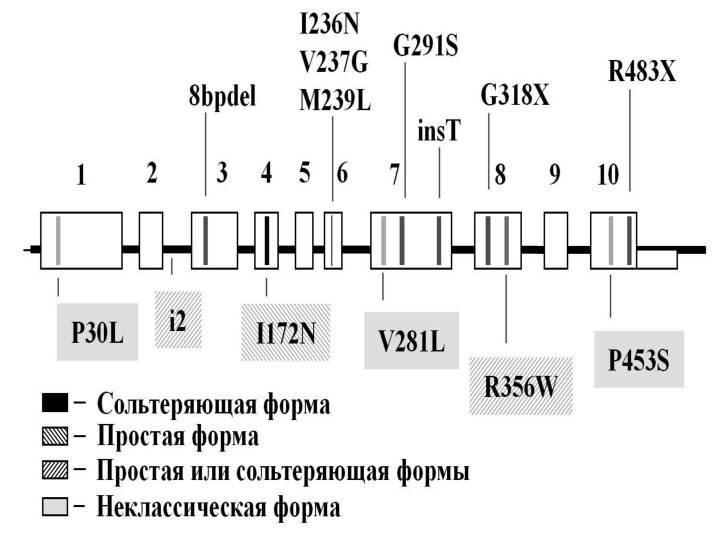
Слайд 86
Спектр мутаций в гене CYP21A2 у больных АГС-3
хорошо изучен. Широкое распространение в разных популяциях имеют крупные
делеции, включающие весь ген CYP21A2, мутации, гомологичные тем, которые присутствуют в псевдогене CYP21A1P и «химерные» конструкции, состоящие из фрагментов гена CYP21A2 и псевдогена CYP21A1P
Слайд 87
При классических вариантах АГС3 – сольтеряющей и
простой – выявляются разные мажорные мутации.
В первом случае
самой частой является делеция всего гена (delA2), присутствующая почти у половины отечественных больных, в то время как во втором случае на первое место выходит одна из сплайсинговых мутаций (28%)
Слайд 89
Среди пациентов с подозрением на неклассический вариант врожденной
гиперплазии коры надпочечников мутации в гене CYP21A2 идентифицируются примерно
в 10% случаев
Слайд 91
Синдром тестикулярной феминизации
Слайд 92
Синдром тестикулярной феминизации, или синдром нечувствительности к андрогенам
— Х-сцепленное рецессивное заболевание, обусловленное присутствием инактивирующих мутаций в
гене андрогенового рецептора (AR)
Слайд 93
Патогенез синдрома связан с полным или частичным отсутствием
чувствительности тканей к андрогенам. Распространенность заболевания составляет 1 случай
на 50000–70000 новорождённых
Слайд 94
В зависимости от степени нечувствительности периферических рецепторов к
андрогенам различают полную форму и неполную форму, когда чувствительность
изначально частично сохранена или частично восстанавливается в пубертатном периоде
Слайд 95
Клинически болезнь у мальчиков проявляется в виде ложного
мужского гермафродитизма при нормальном мужском кариотипе 46,XY.
Полная форма
характеризуется наличием наружных половых органов, сформированных по женскому типу.
При этом влагалище заканчивается слепо, а матка, яичники и простата отсутствуют
Слайд 96
Половые железы представлены яичками, которые располагаются внутрибрюшинно, в
половых губах или паховом канале, формируя грыжевое выпячивание. Аномальное
расположение яичек способствует развитию герминогенных опухолей, которые могут появляться в возрасте 20-30 лет или старше
Слайд 97
Молочные железы хорошо развиты, при этом подмышечное и
лобковое оволосение — скудные.
Телосложение, эмоциональное и сексуальное поведение
больных соответствует женскому типу
Слайд 98
Неполные формы синдрома тестикулярной феминизации обусловлены снижением количества
рецепторов на поверхности клеток-мишеней или их связывающей способности
Слайд 99
Фенотип больных, как правило, мужской, но сопровождается различной
степенью гипоплазии половых органов, крипторхизмом, гипоспадией, расщеплением мошонки и
нарушением сперматогенеза, слабо выраженным подмышечным и лобковым оволосением.
В некоторых случаях может развиваться рак грудной железы
Слайд 100
Спектр мутаций в гене AR достаточно разнообразен. При
полной форме синдрома тестикулярной феминизации у больных обнаруживаются внутригенные
делеции или нонсенс-мутации.
К неполным формам чаще всего приводят миссенс-мутации. Некоторые из них найдены у больных как с полными, так и с неполными формами синдрома, что указывает на возможность модифицирующего влияния каких-то иных генетических или средовых факторов на проявление этих мутаций
Слайд 101
Целью лечения больных с полной формой синдрома тестикулярной
феминизации является предотвращение опухолевого перерождения тестикул (удаление половых желез),
находящихся в брюшной полости.
При наличии врождённой вирилизации наружных половых органов показана феминизирующая пластика
Слайд 102
При неполной форме необходимо предотвратить пубертатную вирилизацию наружных
половых органов и огрубение голоса. В послеоперационном периоде у
больных с этими формами проводят заместительную гормональную терапию эстрогенами с целью восполнения эстрогенового дефицита
Слайд 103
Интересно отметить, что в первом экзоне гена AR
локализован нестабильный тринуклеотидный CAG-повтор, экспансия которого, сопровождающаяся увеличением полиглютаминового
трека в андрогеновом рецепторе, приводит к развитию спинально-бульбарной мышечной атрофии, или
болезни Кеннеди, которая также может сопровождаться гинекомастией и мужским бесплодием, обусловленным атрофией яичек и олигоспермией