Слайд 2
УГЛЕВОДЫ КАК ХИМИЧЕСКИЕ СОЕДИНЕНИЯ
Углеводы являются наиболее распространенным классом
природных органических соединений, который можно рассматривать как основу существования
растительных и животных организмов.
По своему строению углеводы являются многоатомными спиртами с альдегидной или кетоновой группой (полигидроксиальдегиды и полигидроксикетоны).
Наиболее известные углеводы (крахмал, глюкоза, гликоген) обладают эмпирической формулой (CH2O)6. Другие представители класса не соответствуют данному соотношению, и даже могут включать атомы азота, серы, фосфора.
Слайд 3
ФУНКЦИИ УГЛЕВОДОВ:
Энергетическая – преимущество углеводов состоит в их
способности окисляться как в аэробных, так и в анаэробных
условиях (глюкоза),
Защитно-механическая – основное вещество поверхностей суставов, находятся в сосудах и слизистых оболочках (гиалуроновая кислота и другие гликозаминогликаны),
Опорно-структурная – целлюлоза в растениях, гликозаминогликаны в составе протеогликанов, например, хондроитинсульфат в соединительной ткани,
Гидроосмотическая и ионрегулирующая – гетерополисахариды обладают высокой гидрофильностью, отрицательным зарядом и, таким образом, удерживают Н2О, ионы Са2+, Mg2+, Na+ в межклеточном веществе, обеспечивают тургор кожи, упругость тканей,
Кофакторная – гепарин является кофактором липопротеинлипазы плазмы крови и ферментов свертывания крови (инактивирует тромбокиназу).
Слайд 4
КЛАССИФИКАЦИЯ УГЛЕВОДОВ
Согласно современной классификации углеводы подразделяются на три
основные группы:
моносахариды,
олигосахариды;
полисахариды.
Слайд 5
КЛАССИФИКАЦИЯ УГЛЕВОДОВ (СХЕМА)
Слайд 6
МОНОСАХАРИДЫ - ЭТО СТРУКТУРНАЯ ЕДИНИЦА ЛЮБЫХ УГЛЕВОДОВ
Моносахариды
– это углеводы, которые не могут быть гидролизованы до
более простых форм углеводов.
Классификация моносахаридов
Моносахариды подразделяются:
на стереоизомеры по конформации асимметричных атомов углерода – например, L- и D-формы,
в зависимости от конформации -ОН-группы первого атома углерода – α- и β-формы,
в зависимости от числа содержащихся в их молекуле атомов углерода – триозы, тетрозы, пентозы, гексозы, гептозы, октозы,
в зависимости от присутствия альдегидной или кетоновой группы – кетозы и альдозы.
Слайд 7
СТРОЕНИЕ И КЛАССИФИКАЦИЯ МОНОСАХАРИДОВ
Слайд 8
ПРОИЗВОДНЫЕ МОНОСАХАРИДОВ
В природе существуют многочисленные производные моносахаров.
К
ним, например, относятся:
1) Уроновые кислоты – дериваты гексоз, имеющие
в 6 положении карбоксильные группы, например, глюкуроновая, галактуроновая, идуроновая, аскорбиновая кислоты.
Слайд 9
СТРОЕНИЕ ПРОИЗВОДНЫХ МОНОСАХАРИДОВ
2) Аминосахара – производные моносахаров, содержащие
аминогруппы, например, глюкозамин или галактозамин.
Слайд 10
СИАЛОВЫЕ КИСЛОТЫ
3) Сиаловые кислоты являются N- или O-ацилпроизводными
нейраминовой кислоты, которую можно рассматривать как производное глюкозы.
Слайд 11
ГЛИКОЗИДЫ
4) Гликозиды – соединения, образующиеся путем конденсации моносахарида
(свободного или в составе полисахарида) с гидроксильной группой другого
соединения, которым может быть любой моносахарид или вещество неуглеводной природы (агликон), например, метанол, глицерол, стерол, фенол.
Слайд 12
ДИСАХАРИДЫ
Дисахариды часто присутствуют в пище
Дисахариды – это
углеводы, которые при гидролизе дают две одинаковые или различные
молекулы моносахарида и связаны друг с другом гликозидной связью.
Сахароза – пищевой сахар, в которой остатки глюкозы и фруктозы связаны α-1,2-гликозидной связью. В наибольшем количестве содержится в сахарной свекле и тростнике, моркови, ананасах, сорго.
Мальтоза – продукт гидролиза крахмала и гликогена, два остатка глюкозы связаны α-1,4-гликозидной связью, содержится в солоде, проростках злаков.
Слайд 14
ЛАКТОЗА И ЦЕЛЛОБИОЗА
Лактоза – молочный сахар, остаток галактозы
связан с глюкозой β-1,4-гликозидной связью, содержится в молоке. В
некоторых ситуациях (например, при беременности) может появляться в моче.
Целлобиоза – промежуточный продукт гидролиза целлюлозы в кишечнике, в котором остатки глюкозы связаны β-1,4-гликозидной связью. Здоровая микрофлора кишечника способна гидролизовать до 3/4 поступающей сюда целлюлозы до свободной глюкозы, которая либо потребляется самими микроорганизмами, либо всасывается в кровь.
Слайд 15
ДИСАХАРИДЫ ЛАКТОЗА И ЦЕЛЛОБИОЗА
Слайд 16
ПОЛИСАХАРИДЫ
Выделяют гомополисахариды, состоящие из одинаковых остатков моносахаров (крахмал,
гликоген, целлюлоза) и гетерополисахариды (гиалуроновая кислота, хондроитинсульфаты), включающие разные
моносахара.
Гомополисахариды
Крахмал – гомополимер α-D-глюкозы. Находится в злаках, бобовых, картофеле и некоторых других овощах. Синтезировать крахмал способны почти все растения. Двумя основными компонентами крахмала являются амилоза (15-20%) и амилопектин (80-85%).
Гликоген – резервный полисахарид животных тканей, в наибольшей мере содержится в печени и мышцах. Структурно он схож с амилопектином, но, во-первых, длина веточек меньше – 11-18 остатков глюкозы, во-вторых, более разветвлен – через каждые 8-10 остатков. За счет этих особенностей гликоген более компактно уложен, что немаловажно для животной клетки.
Слайд 18
ЦЕЛЛЮЛОЗА
Целлюлоза является наиболее распространенным органическим соединением биосферы.
Единственной
связью в ней является β-1,4-гликозидная связь.
Слайд 19
ГЕТЕРОПОЛИСАХАРИДЫ
Большинство гетерополисахаридов характеризуется наличием повторяющихся дисахаридных остатков. Эти
дисахариды включают в себя уроновую кислоту и аминосахар. Дублируясь,
они образуют олиго- и полисахаридные цепи – гликаны.
Основными представителями гетерополисахаридов (гликозаминогликанов) являются гиалуроновая кислота, хондроитинсульфаты, кератансульфаты и дерматансульфаты, гепарин.
Слайд 20
СТРОЕНИЕ ГИАЛУРОНОВОЙ И ХОНДРОИТИНСЕРНОЙ КИСЛОТ
Слайд 21
ИСПОЛЬЗОВАНИЕ УГЛЕВОДОВ
Экспериментальная биология
Для хроматографии используются декстраны – резервный

полисахарид дрожжей и бактерий
Лабораторная диагностика
Полисахарид фруктозы инулин, содержащийся в
корнях георгинов, артишоков, одуванчиков, является легко растворимым соединением. В медицинской практике используется для определения очистительной способности почек – клиренса.
Клиническая медицина
декстраны используются как компонент кровезаменителей, например, в виде вязкого раствора на 0,9% NaCl – реополиглюкина,
сердечные гликозиды и гепарин применяются в кардиологии,
при заболеваниях позвоночника и суставов широкое применение нашли препараты, содержащие гиалуроновую кислоту, хондроитинсульфат и глюкозамины,
при нарушении функции кишечника используются кристаллическая целлюлоза, лактулоза, хитин как стимуляторы перистальтики, целлюлоза и хитин могут использоваться и в качестве адсорбента,
инфекционные заболевания лечатся гликозидными антибактериальными средствами, например, стрептомицин, эритромицин.
Слайд 22
ПОТРЕБНОСТЬ В УГЛЕВОДАХ
Потребность в углеводах взрослого организма составляет
350-400 г в сутки, при этом целлюлозы и других
пищевых волокон должно быть не менее 30-40 г.
С пищей в основном поступают крахмал, гликоген, целлюлоза, сахароза, лактоза, мальтоза, глюкоза и фруктоза, рибоза.
Слайд 23
ПЕРЕВАРИВАНИЕ УГЛЕВОДОВ В ЖЕЛУДОЧНО-КИШЕЧНОМ ТРАКТЕ
Ротовая полость
Здесь находится кальций-содержащий
фермент α-амилаза. Оптимум ее рН 7,1-7,2, активируется ионами Cl–.
Являясь эндоамилазой, она беспорядочно расщепляет внутренние α-1,4-гликозидные связи и не влияет на другие типы связей.
В ротовой полости углеводы расщепляются до декстринов и мальтозы. Дисахариды не гидролизуются.
Слайд 24
ПЕРЕВАРИВАНИЕ УГЛЕВОДОВ В ЖЕЛУДОЧНО-КИШЕЧНОМ ТРАКТЕ
Желудок
Из-за низкой рН амилаза
инактивируется, хотя некоторое время расщепление углеводов продолжается внутри пищевого
комка.
Кишечник
В полости тонкого кишечника работают совместно панкреатическая α-амилаза, разрывающая внутренние α-1,4-связи, изомальтаза, разрывающая α-1,6-связи изомальтозы, олиго-1,6-глюкозидаза, действующая на точки ветвления крахмала и гликогена.
Слайд 25
ПРИСТЕНОЧНОЕ ПИЩЕВАРЕНИЕ
Кроме полостного, имеется еще и пристеночное пищеварение,
которое осуществляют:
сахаразо-изомальтазный комплекс (рабочее название сахараза) – в тощей
кишке гидролизует α-1,2-, α-1,4-, α-1,6-гликозидные связи, расщепляет сахарозу, мальтозу, мальтотриозу, изомальтозу,
гликоамилазный комплекс – находится в нижних отделах тонкого кишечника и расщепляет α-1,4-гликозидные связи в олигосахаридах,
β-гликозидазный комплекс (рабочее название лактаза) – гидролизует β-1,4-гликозидные связи между галактозой и глюкозой (лактозу). У детей активность лактазы очень высока уже до рождения и сохраняется на высоком уровне до 5-7 лет, после чего снижается.
Слайд 26
РОЛЬ ЦЕЛЛЮЛОЗЫ В ПИЩЕВАРЕНИИ
Целлюлоза ферментами человека не переваривается.
Но в толстом кишечнике под действием микрофлоры до 75%
ее количества гидролизуется с образованием целлобиозы и глюкозы. Глюкоза частично используется самой микрофлорой и окисляется до органических кислот (масляной, молочной), которые стимулируют перистальтику кишечника. Частично глюкоза может всасываться в кровь.
Основная роль целлюлозы для человека:
стимулирование перистальтики кишечника,
формирование каловых масс,
стимуляция желчеотделения,
абсорбция холестерола и других веществ, что препятствует их всасыванию.
Слайд 27
НЕПЕРЕНОСИМОСТЬ ЛАКТОЗЫ И САХАРОЗЫ
Существуют две наиболее встречающиеся формы
нарушения переваривания дисахаридов в кишечнике – дефект лактазы (гликозидазного комплекса) и
сахаразы (сахаразо-изомальтазного комплекса), которые называются как непереносимость лактозы и сахарозы.
Приобретенная недостаточность
Приобретенные формы недостаточности переваривания углеводов возникают в результате заболеваний стенок ЖКТ: энтериты, колиты, когда нарушается образование ферментов и их размещение на щеточной каемке энтероцитов. К тому же ухудшается всасывание моносахаров.
Наследственная недостаточность
При наследственной (первичной) патологии лактазы симптомы проявляются после первых кормлений. Патология сахаразы обнаруживается позднее, при введении в рацион сладкого.
Недостаточность лактазы может проявляться не только у младенцев, но и в подростковом и взрослом возрасте, что является физиологическим возрастным изменением.
Слайд 28
ПАТОГЕНЕЗ ФЕРМЕНТНОЙ НЕДОСТАТОЧНОСТИ
Отсутствие гидролиза соответствующих дисахаридов приводит к

осмотическому эффекту и задержке воды в просвете кишечника.
Кроме этого,
сахара активно потребляются микрофлорой толстого кишечника и метаболизируют с образованием органических кислот (масляная, молочная) и газов. Из-за этого симптомами лактазной или сахаразной недостаточности являются диарея, срыгивания, метеоризм, вспучивание живота, его спазмы и боли, атопический дерматит.
Диагностика
Диагноз ферментативной недостаточности ставится на основании анамнеза, симптомов заболевания и анализа кала.
Дифференциальная диагностика нарушений переваривания и всасывания заключается в контроле уровня глюкозы крови после раздельного приема дисахаридов и эквивалентного количества моносахаридов. Незначительный подъем концентрации глюкозы крови в первом случае указывает на нехватку ферментов, во втором – на нарушение всасывания.
Основы лечения
Использование препаратов содержащих соответствующие ферменты, снижение в рационе содержания молока или продуктов с добавлением сахара в зависимости от типа непереносимого углевода.
Слайд 29
ТРАНСПОРТ МОНОСАХАРОВ ЧЕРЕЗ МЕМБРАНЫ
Всасывание в кишечнике
После переваривания крахмала

и гликогена, после расщепления дисахаридов в полости кишечника накапливается
глюкоза и другие моносахариды, которые должны попасть в кровь. Для этого им необходимо преодолеть, как минимум, апикальную мембрану энтероцита и его базальную мембрану.
Всасывание моносахаридов из просвета кишечника происходит по механизму вторичного активного транспорта. Это значит, что затрата энергии при переносе сахаров происходит, но тратится она не непосредственно на транспорт молекулы, а на создание градиента концентрации другого вещества.
В случае моносахаридов таким веществом является натрий. Фермент Na+К+-АТФаза постоянно, в обмен на калий, выкачивает ионы натрия из клетки, именно этот транспорт требует затрат энергии. Результатом является накопление сахара в клетке, а ионы натрия выкачиваются Na+,К+-АТФазой.
Выход глюкозы из клетки в межклеточное пространство и далее кровь происходит благодаря простой и облегченной диффузии.
Слайд 30
ТРАНСПОРТ МОНОСАХАРИДОВ ЧЕРЕЗ МЕМБРАНЫ ЭНТЕРОЦИТОВ
Слайд 31
ТРАНСПОРТ ИЗ КРОВИ ЧЕРЕЗ МЕМБРАНЫ КЛЕТОК
После выхода в

кровь, оттекающую от кишечника, моносахариды движутся по сосудам воротной
системы в печень, частично задерживаются в ней, частично выходят в большой круг кровообращения. Следующей их задачей стоит проникновение в клетки органов.
Из крови внутрь клеток глюкоза попадает при помощи облегченной диффузии по градиенту концентрации с участием белков-переносчиков (глюкозных транспортеров "ГлюТ"). Различают 5 видов транспортеров глюкозы ГлюТ 1, ГлюТ 2, ГлюТ 3, ГлюТ 4, ГлюТ 5. Глюкозные транспортеры имеются на мембранах всех клеток.
В мышцах и жировой ткани находится ГлюТ 4, только эти транспортеры являются чувствительными к влиянию инсулина. При действии инсулина на клетку они поднимаются к поверхности мембраны и переносят глюкозу внутрь. Указанные ткани получили название инсулинзависимых.
Некоторые ткани совершенно нечувствительны к действию инсулина, их называют инсулиннезависимыми. К ним относятся нервная ткань, стекловидное тело, хрусталик, сетчатка, клубочковые клетки почек, эндотелиоциты, семенники и эритроциты.
Часть клеток занимает промежуточное положение, т.е. на их мембранах находятся ГлюТ 4 и другие типы транспортеров.
Слайд 32
ВЗАИМОПРЕВРАЩЕНИЕ САХАРОВ
Поскольку в кишечнике всасываются все поступающие с
пищей моносахариды (фруктоза, галактоза, манноза и т.п.), то перед
организмом встает задача превратить полученные гексозы в глюкозу для ее дальнейшего использования в реакциях метаболизма. Этот процесс получил название взаимопревращение сахаров.
Цель этого процесса – создание только одного субстрата для реакций метаболизма, а именно α-D-глюкозы, что позволяет сэкономить ресурсы, не образовывать множество ферментов для каждого вида моносахарида. Реакции протекают в эпителии кишечника и, в основном, в гепатоцитах.
У детей некоторое время после рождения, даже при гипогликемии, в крови отмечается относительный избыток других моносахаридов, например, фруктозы и галактозы, что обычно связано с функциональной незрелостью печени.
Слайд 33
ПРЕВРАЩЕНИЕ ГАЛАКТОЗЫ
Галактоза сначала подвергается фосфорилированию по
1-му атому углерода. Отличительной особенностью является превращение в глюкозу
не напрямую, а через синтез УДФ-галактозы из галактозо-1-фосфата, которая впоследствии изомеризуется в УДФ-глюкозу и далее в двух реакциях превращается в глюкозу.
Слайд 34
ПРЕВРАЩЕНИЕ ГАЛАКТОЗЫ В ГЛЮКОЗУ
Слайд 35
НАРУШЕНИЯ ПРЕВРАЩЕНИЯ ГАЛАКТОЗЫ
Нарушения обмена галактозы могут быть вызваны
генетическим дефектом одного из ферментов:
галактокиназы, частота дефекта 1:500000,
галактозо-1-фосфат-уридилтрансферазы, частота
дефекта 1:40000,
эпимеразы, частота дефекта менее 1:1000000.
Заболевание, возникающее при этих нарушениях, получило название галактоземия.
Диагностика. Дети отказываются от еды. Концентрация галактозы в крови возрастает до 11,1-16,6 ммоль/л (норма 0,3-0,5 ммоль/л), в крови появляется галактозо-1-фосфат. К лабораторным критериям относятся также билирубинемия, галактозурия, протеинурия, гипераминоацидурия, накопление гликозилированного гемоглобина.
Слайд 36
ПАТОГЕНЕЗ ГАЛАКТОЗЕМИИ.
Избыток галактозы превращается в спирт галактитол

(дульцитол), накапливающийся в хрусталике и осмотически привлекающий сюда воду.
Изменяется солевой состав, нарушается конформация белков хрусталика, что приводит к катаракте в молодом возрасте. Катаракта возможна даже у плодов матерей с галактоземией, употреблявших молоко во время беременности.
При дефекте галактозо-1-фосфат-уридил-трансферазы АТФ постоянно расходуется на фосфорилирование галактозы и дефицит энергии угнетает активность многих ферментов, "токсически" действуя на нейроны, гепатоциты, нефроциты. Как результат возможны задержка психомоторного развития, умственная отсталость, некроз гепатоцитов и цирроз печени. В почках и кишечнике избыток галактозы и ее метаболитов ингибирует всасывание аминокислот.
Основы лечения. Исключение из рациона молока и других источников галактозы позволяет предотвратить развитие патологических симптомов. Однако сохранность интеллекта может быть достигнута только при ранней, не позднее первых 2 месяцев жизни, диагностике и вовремя начатом лечении.
Слайд 37
ПРЕВРАЩЕНИЕ ФРУКТОЗЫ
Реакции перехода фруктозы в глюкозу достаточно просты.
Сначала происходит активация фруктозы посредством фосфорилирования 6-го атома углерода.
В печени реакцию могут катализировать два фермента – гексокиназа и фруктокиназа, но гексокиназа имеет гораздо более низкое сродство к фруктозе.
Фруктозо-6-фосфат далее изомеризуется и глюкозо-6-фосфатаза отщепляет уже ненужный фосфат. Если образуется фруктозо-1-фосфат, под действием соответствующей альдолазы он превращается в глицеральдегид и диоксиацетонфосфат, которые в дальнейших реакциях либо используются в гликолизе, либо в реакциях глюконеогенеза превращаются в фруктозо-6-фосфат и далее в глюкозу
Слайд 38
ОСОБЕННОСТИ МЕТАБОЛИЗМА ФРУКТОЗЫ
Особенностью метаболизма фруктозы является то, что
фермент фруктокиназа является инсулин-независимым. В результате превращение фруктозы в
пировиноградную кислоту и ацетил-SКоА происходит быстрее, чем для глюкозы.
Это объясняется "игнорированием" лимитирующей реакции метаболизма глюкозы, катализируемой фосфофруктокиназойЭто объясняется "игнорированием" лимитирующей реакции метаболизма глюкозы, катализируемой фосфофруктокиназой. Дальнейший метаболизм ацетил-SКоА в данном случае может привести к избыточному образованию жирных кислот и триацилглицеролов.
Слайд 39
ПУТИ МЕТАБОЛИЗМА ФРУКТОЗЫ И ЕЕ ПРЕВРАЩЕНИЕ В ГЛЮКОЗУ
Слайд 40
НАРУШЕНИЯ МЕТАБОЛИЗМА ФРУКТОЗЫ
Эссенциальная фруктозурия
Генетический дефект фруктокиназы приводит к
доброкачественной эссенциальной фруктозурии, протекающей безо всяких отрицательных симптомов.
Наследственная фруктозурия
Заболевание
формируется вследствие наследственных аутосомно-рецессивных дефектов других ферментов обмена фруктозы. Дефект фруктозо-1-фосфатальдолазы проявляется после введения в рацион младенца соков и фруктов, содержащих фруктозу.
Патогенез связан со снижением концентрации фосфора в крови, гиперфруктоземией, с тяжелой постпрандиальной гипогликемией. Отмечается вялость, нарушения сознания, почечный канальцевый ацидоз.
Диагноз ставится исходя из "непонятного" заболевания печени, гипофосфатемии, гиперурикемии, гипогликемии и фруктозурии. Для подтверждения проводят тест толерантности к фруктозе.
Лечение включает диету с ограничением сладостей, фруктов, овощей.
Дефект фруктозо-1,6-дифосфатазы проявляется сходно с предыдущим, но не так тяжело.
Слайд 41
АКТИВАЦИЯ (ФОСФОРИЛИРОВАНИЕ) ГЛЮКОЗЫ
Наличие глюкозы в клетке обеспечивается, в
первую очередь, проникновением ее из крови.
Активация глюкозы
После перемещения через
мембраны глюкоза в цитозоле немедленно фосфорилируется ферментом гексокиназой, в связи с чем ее образно называют "ловушка глюкозы".
Фосфорилирование глюкозы решает несколько задач:
фосфатный эфир глюкозы не в состоянии выйти из клетки, так как молекула отрицательно заряжена и отталкивается от фосфолипидной поверхности мембраны,
наличие заряженной группы обеспечивает правильную ориентацию молекулы в активном центре фермента,
уменьшается концентрация свободной (нефосфорилированной) глюкозы, что способствует диффузии новых молекул из крови.
Слайд 42
ДЕФОСФОРИЛИРОВАНИЕ ГЛЮКОЗЫ
Дефосфорилирование глюкозы осуществляется глюкозо-6-фосфатазой. Этот фермент есть
только в печени и почках.
В эпителии канальцев почек
работа фермента связана с реабсорбцией глюкозы.
В гепатоцитах фермент необходим, когда печень поддерживает гомеостаз глюкозы в крови.
Также почти все клетки имеют запасы гликогена, который используется как внутриклеточный резерв глюкозы.
Печеночные клетки и почки обладают способностью синтезировать глюкозу из неуглеводных компонентов (глюконеогенез).
Слайд 43
РЕАКЦИИ ФОСФОРИЛИРОВАНИЯ И ДЕФОСФОРИЛИРОВАНИЯ ГЛЮКОЗЫ
Слайд 44
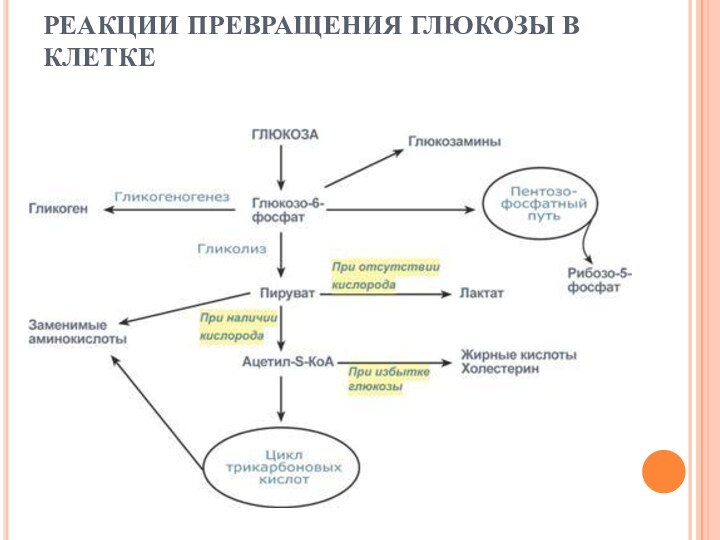
СУДЬБА ГЛЮКОЗЫ
После активации (фосфорилирования) глюкоза в зависимости от
условий и вида клетки превращается по различным направлениям:
часть глюкозы
обязательно используется в энергетическом обмене, она сгорает в реакциях катаболизма для синтеза АТФ,
при достаточно большом количестве в клетке глюкоза запасается в виде гликогена, к синтезу гликогена способны большинство тканей,
в гепатоцитах (при высокой концентрации) и в адипоцитах глюкоза перенаправляется на синтез триацилглицеролов и в печени на синтез холестерола,
при определенных условиях часть глюкозы идет в реакции пентозофосфатного пути, в котором образуются рибозо-5-фосфат и НАДФН,
некоторая доля глюкозы используется для синтеза гликозаминов и далее структурных или иных гетерополисахаридов.
Слайд 45
РЕАКЦИИ ПРЕВРАЩЕНИЯ ГЛЮКОЗЫ В КЛЕТКЕ
Слайд 46
МЕТАБОЛИЗМ ГЛИКОГЕНА. ГЛИКОГЕНОЛИЗ.
Мобилизация гликогена (гликогенолиз)
Резервы гликогена используются по-разному
в зависимости от функциональных особенностей клетки.
Гликоген печени расщепляется при
снижении концентрации глюкозы в крови, прежде всего между приемами пищи. Через 12-18 часов голодания запасы гликогена в печени полностью истощаются.
В мышцах количество гликогена снижается обычно только во время физической нагрузки – длительной и/или напряженной.
Мобилизация (распад) гликогена или гликогенолиз активируется при недостатке свободной глюкозы в клетке, а значит и в крови (голодание, мышечная работа). При этом уровень глюкозы крови "целенаправленно" поддерживает только печень, в которой имеется глюкозо-6-фосфатаза, гидролизующая фосфатный эфир глюкозы. Образуемая в гепатоците свободная глюкоза выходит через плазматическую мембрану в кровь. Остальные органы используют гликоген только для собственных нужд.
Слайд 47
ГЛИКОГЕНОЛИЗ
В гликогенолизе непосредственно участвуют три фермента:
1. Фосфорилаза гликогена
(кофермент пиридоксальфосфат) – расщепляет α-1,4-гликозидные связи с образованием глюкозо-1-фосфата.
Фермент работает до тех пор, пока до точки ветвления (α-1,6-связи) не останется 4 остатка глюкозы.
2. α(1,4)-α(1,6)-Глюкантрансфераза – фермент, переносящий фрагмент из трех остатков глюкозы на другую цепь с образованием новой α-1,4-гликозидной связи. При этом на прежнем месте остается один остаток глюкозы и "открытая" доступная α-1,6-гликозидная связь.
3. Амило-α-1,6-глюкозидаза, ("деветвящий" фермент) – гидролизует α-1,6-гликозидную связь с высвобождением свободной (нефосфорилированной) глюкозы. В результате образуется цепь без ветвлений, вновь служащая субстратом для фосфорилазы.
Слайд 48
РОЛЬ ФЕРМЕНТОВ В РАСЩЕПЛЕНИИ ГЛИКОГЕНА
Слайд 49
СИНТЕЗ ГЛИКОГЕНА
Гликоген способен синтезироваться почти во всех тканях,
но наибольшие запасы гликогена находятся в печени и скелетных
мышцах.
Накопление гликогена в мышцах отмечается в период восстановления после работы, особенно при приеме богатой углеводами пищи.
В печени гликоген накапливается только после еды, при гипергликемии. Такие отличия печени и мышц обусловлены наличием различных изоферментов гексокиназы, фосфорилирующей глюкозу в глюкозо-6-фосфат.
Слайд 50
ГЛЮКОКИНАЗА ПЕЧЕНИ
Для печени характерен изофермент, получивший собственное название
– глюкокиназа. Отличиями этого фермента от других гексокиназ являются:
низкое
сродство к глюкозе (в 1000 раз меньше), что ведет к захвату глюкозы печенью только при ее высокой концентрации в крови (после еды),
продукт реакции (глюкозо-6-фосфат) не ингибирует фермент, в то время как в других тканях гексокиназа чувствительна к такому влиянию. Это позволяет гепатоциту в единицу времени захватывать глюкозы больше, чем он может сразу же утилизовать.
Благодаря особенностям глюкокиназы гепатоцит эффективно захватывает глюкозу после еды и впоследствии метаболизирует ее в любом направлении. При нормальных концентрациях глюкозы в крови ее захват печенью не производится.
Слайд 51
ФЕРМЕНТЫ СИНТЕЗА ГЛИКОГЕНА
Непосредственно синтез гликогена осуществляют следующие ферменты:
1.
Фосфоглюкомутаза – превращает глюкозо-6-фосфат в глюкозо-1-фосфат;
2. Глюкозо-1-фосфат-уридилтрансфераза – фермент,
осуществляющий ключевую реакцию синтеза. Необратимость этой реакции обеспечивается гидролизом образующегося дифосфата;
3. Гликогенсинтаза – образует α-1,4-гликозидные связи и удлиняет гликогеновую цепочку, присоединяя активированный С1 УДФ-глюкозы к С4 концевых остатков гликогена;
4. Амило-α1,4-α1,6-гликозилтрансфераза,"гликоген-ветвящий" фермент – переносит фрагмент с минимальной длиной в 6 остатков глюкозы на соседнюю цепь с образованием α1,6-гликозидной связи.
Слайд 54
РОЛЬ ГЛИКОГЕНСИНТАЗЫ И ГЛИКОЗИЛТРАНСФЕРАЗЫ В СИНТЕЗЕ ГЛИКОГЕНА
Слайд 55
РЕГУЛЯЦИЯ СИНТЕЗА И РАСПАДА ГЛИКОГЕНА
Метаболизм гликогена в
печени, мышцах и других клетках регулируется несколькими гормонами, одни
из которых активируют синтез гликогена, а другие – распад гликогена.
При этом в одной клетке не могут идти одновременно синтез и распад гликогена – это противоположные процессы с совершенно с разными задачами. Синтез и распад исключают друг друга или, по-другому, они реципрокны.
Активность ключевых ферментов метаболизма гликогена гликогенфосфорилазы и гликогенсинтазы изменяется в зависимости наличия в составе фермента фосфорной кислоты – они активны либо в фосфорилированной, либо в дефосфорилированной форме.
Слайд 56
РЕГУЛЯЦИЯ СИНТЕЗА И РАСПАДА ГЛИКОГЕНА (ПРОДОЛЖЕНИЕ)
Присоединение фосфатов к
ферменту производят протеинкиназы, источником фосфора является АТФ:
фосфорилаза гликогена активируется
после присоединения фосфатной группы,
синтаза гликогена после присоединения фосфата инактивируется.
Скорость фосфорилирования указанных ферментов повышается после воздействия на клетку адреналина, глюкагона и некоторых других гормонов. В результате адреналин и глюкагон вызывают гликогенолиз, активируя фосфорилазу гликогена.
Например, во время мышечной работы адреналин вызывает фосфорилирование внутримышечных ферментов обмена гликогена. В результате фосфорилаза гликогена активируется, синтаза инактивируется. В мышце происходит распад гликогена, образуется глюкоза для обеспечения энергией мышечного сокращения.
Слайд 57
ИЗМЕНЕНИЕ АКТИВНОСТИ ФЕРМЕНТОВ ОБМЕНА ГЛИКОГЕНА В ЗАВИСИМОСТИ ОТ
УСЛОВИЙ
Слайд 58
СПОСОБЫ АКТИВАЦИИ СИНТАЗЫ И ФОСФОРИЛАЗЫ ГЛИКОГЕНА
1) Способы активации
синтазы гликогена.
Гликогенсинтаза активна в дефосфорилированном виде, т.е. при аденилатциклазном
каскаде она прекращает работу. Удаление фосфата от ферментов осуществляют протеинфосфатазы. Активатором протеинфосфатаз выступает инсулин – он повышает синтез гликогена.
Вместе с этим, инсулин и глюкокортикоиды ускоряют синтез гликогена, увеличивая количество молекул гликогенсинтазы.
2) Способы активации фосфорилазы гликогена
Скорость гликогенолиза лимитируется только скоростью работы фосфорилазы гликогена. Ее активность может изменяться тремя способами:
•ковалентная модификация,
•кальций-зависимая активация и
•аллостерическая активация с помощью АМФ.
Слайд 59
АДЕНИЛАТЦИКЛАЗНЫЙ СПОСОБ АКТИВАЦИИ ФОСФОРИЛАЗЫ ГЛИКОГЕНА
Слайд 60
СУММАРНАЯ СХЕМА СПОСОБОВ АКТИВАЦИИ ФОСФОРИЛАЗЫ
Слайд 61
ГЛИКОГЕНОЗЫ
Гликогеновые болезни – это наследственные заболевания, обусловленные недостаточностью
каких-либо ферментов, отвечающих за метаболизм гликогена.
Могут быть нарушены
обе стороны обмена: как синтез гликогена, так и его распад. Средняя частота встречаемости составляет 1:40000.
Гликогенозы
В настоящее время гликогенозы делят по патогенетическому признаку на печеночные, мышечные и смешанные формы. Следует отметить, что при гликогенозах количество гликогена не всегда изменено, изменения могут быть только в структуре его молекулы.
Слайд 62
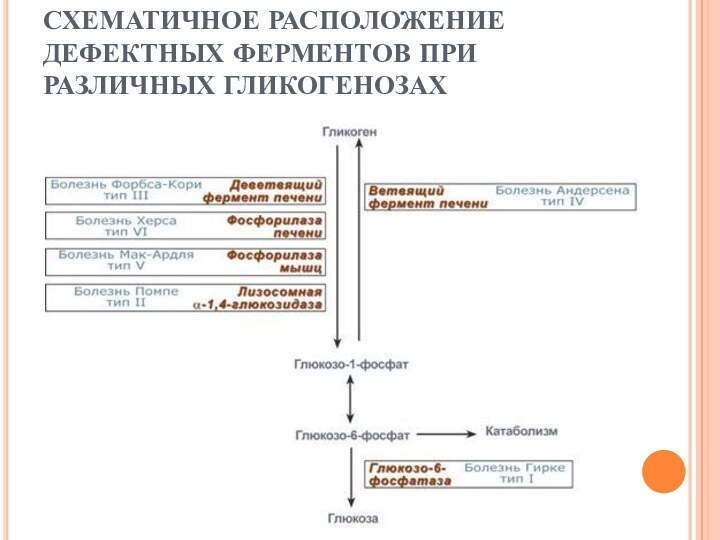
ПЕЧЕНОЧНЫЕ ГЛИКОГЕНОЗЫ
Самый частый гликогеноз I типа или болезнь
фон Гирке обусловлен аутосомно-рецессивным дефектом глюкозо-6-фосфатазы. Из-за того, что
этот фермент есть только в печени и почках, преимущественно страдают эти органы, и болезнь носит еще одно название – гепаторенальный гликогеноз.
Даже у новорожденных детей наблюдаются гепатомегалия и нефромегалия, обусловленные накоплением гликогена не только в цитоплазме, но и в ядрах клеток. Кроме этого, активируется синтез липидов с возникновением стеатоза печени. Так как фермент необходим для дефосфорилирования глюкозо-6-фосфата с последующим выходом глюкозы в кровь, у больных отмечается гипогликемия и, как следствие, ацетонемия, метаболический ацидоз, ацетонурия.
Слайд 63
ГЛИКОГЕНОЗЫ
Гликогеноз III типа или болезнь Форбса-Кори или лимит-декстриноз
– это аутосомно-рецессивный дефект амило-α1,6-глюкозидазы, "деветвящего" фермента, гидролизующего α-1,6-гликозидную
связь. Болезнь имеет более доброкачественное течение, и частота ее составляет примерно 25% от всех гликогенозов. Для больных характерна гепатомегалия, умеренная задержка физического развития, в подростковом возрасте возможна небольшая миопатия.
Еще два печеночных гликогеноза – гликогеноз IV типа (болезнь Андерсена), связанный с дефектом ветвящего фермента и гликогеноз VI типа (болезнь Херса), связанный с дефицитом печеночной фосфорилазы гликогена встречаются довольно редко.
Слайд 64
МЫШЕЧНЫЕ ГЛИКОГЕНОЗЫ
Для этой группы гликогенозов характерны изменения ферментов
мышечной ткани. Это приводит к нарушению энергообеспечения мышц при
физической нагрузке, к болям в мышцах, судорогам.
Гликогеноз V типа (болезнь Мак-Ардля) – отсутствие мышечной фосфорилазы. При тяжелой мышечной нагрузке возникают судороги, миоглобинурия, хотя легкая работа не вызывает каких-либо проблем.
Слайд 65
СХЕМАТИЧНОЕ РАСПОЛОЖЕНИЕ ДЕФЕКТНЫХ ФЕРМЕНТОВ ПРИ РАЗЛИЧНЫХ ГЛИКОГЕНОЗАХ
Слайд 66
СМЕШАННЫЕ ГЛИКОГЕНОЗЫ
Эти заболевания касаются и печени, и мышц,
и других органов.
Гликогеноз II типа (болезнь Помпе) – поражаются
все гликогенсодержащие клетки из-за отсутствия лизосомальной α-1,4-глюкозидазы, поэтому данная болезнь относится к лизосомным болезням накопления. Происходит накопление гликогена в лизосомах и в цитоплазме. Заболевание составляет почти 10% всех гликогенозов и является наиболее злокачественным. Больные умирают в грудном возрасте из-за кардиомегалии и тяжелой сердечной недостаточности.
Слайд 67
АГЛИКОГЕНОЗЫ
Агликогенозы – состояния, связанные с отсутствием гликогена. В качестве
примера агликогеноза можно привести наследственный аутосомно-рецессивный дефицит гликоген-синтазы.
Симптомами
является резкая гипогликемия натощак, особенно утром, появляется рвота, судороги, потеря сознания. В результате гипогликемии наблюдается задержка психомоторного развития, умственная отсталость. Болезнь несмертельна при адекватном лечении (частое кормление), хотя и опасна.
Слайд 68
ОКИСЛЕНИЕ ГЛЮКОЗЫ
Энергетика любой клетки нашего организма основана на
окислении глюкозы.
Окисление глюкозы происходит по двум направлениям:
1) Пути
метаболизма пирувата в присут-
ствии и в отсутствии кислорода (связан с получением энергии)
2) Окисление с образованием пентоз: рибозы, рибулозы, ксилулозы. Этот путь называется пентозофосфатный шунт и не связан с получением энергии
Слайд 69
ГЛЮКОЗА – ЦЕНТРАЛЬНАЯ МОЛЕКУЛА КЛЕТОЧНОГО ДЫХАНИЯ
С нее начинается
путь к АТФ
β
Слайд 70
ОКИСЛЕНИЕ С ПОЛУЧЕНИЕМ ЭНЕРГИИ.
Путь, по которому глюкоза
окисляется для получения энергии, называется гликолиз (греч. glykos —
сладкий и греч. lysis — растворение).
Конечным продуктом гликолиза является пировиноградная кислота (пируват).
В зависимости от дальнейшей судьбы пирувата различают аэробное и анаэробное окисление глюкозы. Целью обоих типов окисления является получение АТФ.
Слайд 72
АЭРОБНЫЙ ПРОЦЕСС
В аэробном процессе пировиноградная кислота превращается в
ацетил-SКоА и далее сгорает в реакциях цикла трикарбоновых кислот
до СО2.
Общее уравнение аэробного окисления глюкозы:
C6H12O6 + 6 O2 + 38 АДФ + 38 Фнеорг = 6 CO2 + 44 H2О + 38 АТФ
Слайд 73
АНАЭРОБНОЕ ОКИСЛЕНИЕ
В анаэробном процессе пировиноградная кислота восстанавливается
до молочной кислоты (лактата).
Лактат является метаболическим тупиком и
далее ни во что не превращается, единственная возможность утилизовать лактат – это окислить его обратно в пируват.
В микробиологии анаэробный гликолиз называют молочнокислым брожением. Суммарное уравнение анаэробного гликолиза имеет вид:
C6H12O6 + 2 АДФ + 2 Фнеорг= 2 Лактат + 2 H2O + 2 АТФ
Слайд 74
ГЛЮКОЗА – ЭТО ИСТОЧНИК ОКСАЛОАЦЕТАТА
После того как пируват
синтезировался, он необязательно превращается в ацетил-SКоА. Существенное значение имеет
его способность карбоксилироваться в оксалоацетат, особенно эта реакция активна в печени. Наличие избытка оксалоацетата "подталкивает" реакции ЦТК , ускоряет связывание ацетильной группы, ее окисление и производство энергии.
При голодании отсутствие глюкозы в клетках и активация глюконеогенеза в гепатоцитах, ухудшение окисления глюкозы до пирувата при сахарном диабете влечет за собой недостаточное количество оксалоацетата. Это сопровождается гипоэнергетическим состоянием клетки и активацией синтеза кетоновых тел в печени .
Слайд 75
БЕСКИСЛОРОДНОЕ ОКИСЛЕНИЕ ГЛЮКОЗЫ ВКЛЮЧАЕТ ДВА ЭТАПА
Многие клетки
организма способны к анаэробному окислению глюкозы. Для эритроцитов он
является единственным источником энергии. Клетки скелетной мускулатуры за счет бескислородного расщепления глюкозы способны выполнять мощную, быструю, интенсивную работу, как, например, бег на короткие дистанции, напряжение в силовых видах спорта. Бескислородное окисление глюкозы усиливается при гипоксии клеток при анемиях, нарушении кровообращения в тканях.
Слайд 76
ЭТАПЫ АНАЭРОБНОГО ГЛИКОЛИЗА
Анаэробное превращение глюкозы локализуется в цитозоле
и включает два этапа из 11 ферментативных реакций.
Первый
этап гликолиза
Первый этап гликолиза – подготовительный, здесь происходит затрата энергии АТФ, активация глюкозы и образование из нее триозофосфатов.
Первая реакция гликолиза сводится к превращению глюкозы в реакционно-способное соединение за счет фосфорилирования 6-го, не включенного в кольцо, атома углерода. Эта реакция является первой в любом превращении глюкозы, катализируется гексокиназой.
Вторая реакция необходима для выведения еще одного атома углерода из кольца для его последующего фосфорилирования (фермент изомераза). В результате образуется фруктозо-6-фосфат.
Слайд 77
ПЕРВЫЙ ЭТАП ГЛИКОЛИЗА (ПРОДОЛЖЕНИЕ)
Третья реакция – фермент фосфофруктокиназа
фосфорилирует фруктозо-6-фосфат с образованием почти симметричной молекулы фруктозо-1,6-дифосфата. Эта
реакция является главной в регуляции скорости гликолиза.
В четвертой реакции фруктозо-1,6-дифосфат разрезается пополам фруктозо-1,6-дифосфат-альдолазой с образованием двух фосфорилированных триоз-изомеров – альдозы глицеральдегида (ГАФ) и кетозы диоксиацетона (ДАФ).
Слайд 79
ПЕРВЫЙ ЭТАП (ПРОДОЛЖЕНИЕ)
ПЯТАЯ РЕАКЦИЯ
Пятая реакция подготовительного этапа –
переход глицеральдегидфосфата и диоксиацетонфосфата друг в друга при участии
триозофосфатизомеразы. Равновесие реакции сдвинуто в пользу диоксиацетонфосфата, его доля составляет 97%, доля глицеральдегидфосфата – 3%.
Эта реакция, при всей ее простоте, определяет дальнейшую судьбу глюкозы:
при нехватке энергии в клетке и активации окисления глюкозы диоксиацетонфосфат превращается в глицеральдегидфосфат, который далее окисляется на втором этапе гликолиза,
при достаточном количестве АТФ, наоборот, глицеральдегидфосфат изомеризуется в диоксиацетонфосфат, и последний отправляется на синтез жиров.
Слайд 80
ВТОРОЙ ЭТАП ГЛИКОЛИЗА
Второй этап гликолиза – это освобождение
энергии, содержащейся в глицеральдегидфосфате, и запасание ее в форме
АТФ.
Шестая реакция гликолиза (фермент глицеральдегидфосфат-дегидрогеназа) – окисление глицеральдегидфосфата и присоединение к нему фосфорной кислоты приводит к образованию макроэргического соединения 1,3-дифосфоглицериновой кислоты и НАДН.
В седьмой реакции (фермент фосфоглицераткиназа) энергия фосфоэфирной связи, заключенная в 1,3-дифосфоглицерате тратится на образование АТФ. Реакция получила дополнительное название – реакция субстратного фосфорилирования, что уточняет источник энергии для получения макроэргической связи в АТФ (от субстрата реакции) в отличие от окислительного фосфорилирования (от электрохимического градиента ионов водорода на мембране митохондрий).
Слайд 81
ВТОРОЙ ЭТАП ГЛИКОЛИЗА (ПРОДОЛЖЕНИЕ)
Восьмая реакция – синтезированный в
предыдущей реакции 3-фосфоглицерат под влиянием фосфоглицератмутазы изомеризуется в 2-фосфоглицерат.
Девятая
реакция – фермент енолаза отрывает молекулу воды от 2-фосфоглицериновой кислоты и приводит к образованию макроэргической фосфоэфирной связи в составе фосфоенолпирувата.
Десятая реакция гликолиза – еще одна реакция субстратного фосфорилирования – заключается в переносе пируваткиназой макроэргического фосфата с фосфоенолпирувата на АДФ и образовании пировиноградной кислоты.
Слайд 82
11-АЯ РЕАКЦИЯ
Последняя реакция бескислородного окисления глюкозы, одиннадцатая –
образование молочной кислоты из пирувата под действием лактатдегидрогеназы.
Важно
то, что эта реакция осуществляется только в анаэробных условиях. Эта реакция необходима клетке, так как НАДН, образующийся в 6-й реакции, в отсутствие кислорода не может окисляться в митохондриях.
У плода и детей первых месяцев жизни преобладает анаэробный распад глюкозы, в связи с чем уровень лактата у них выше по сравнению со взрослыми.
При наличии кислорода пировиноградная кислота переходит в митохондрию и превращается в ацетил-S-КоА.
Слайд 83
УСЛОВИЯ ДЛЯ ПРОТЕКАНИЯ АНАЭРОБНОГО ГЛИКОЛИЗ А
Для стабильного протекания
гликолиза в бескислородных условиях необходимы ряд простых условий:
поступление глюкозы,
наличие
минимальных количеств АТФ для активации процесса на первом этапе и АДФ как акцептора для фосфатов на втором этапе,
пополнение запасов окисленного НАД для шестой реакции.
Слайд 84
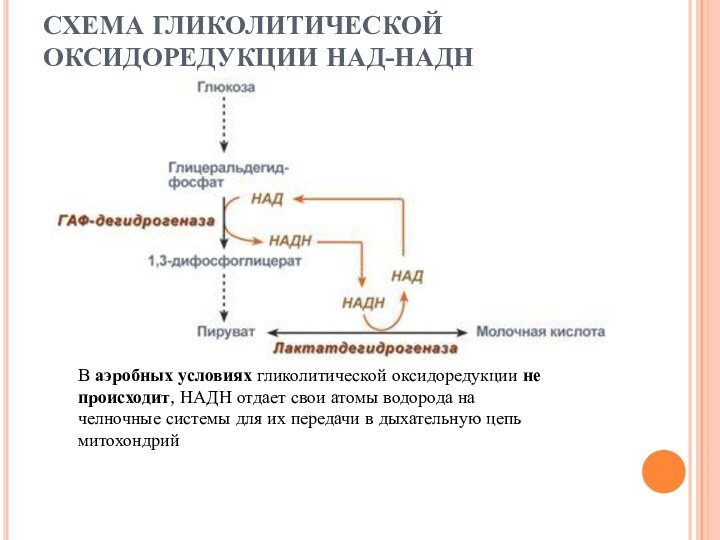
СХЕМА ГЛИКОЛИТИЧЕСКОЙ ОКСИДОРЕДУКЦИИ НАД-НАДН
В аэробных условиях гликолитической оксидоредукции
не происходит, НАДН отдает свои атомы водорода на челночные
системы для их передачи в дыхательную цепь митохондрий
Слайд 85
РАСЧЁТ АТФ ПРИ ОКИСЛЕНИИ ГЛЮКОЗЫ
Для расчета количества АТФ,
образованной при окислении глюкозы необходимо учитывать:
Реакции, идущие с затратой
или образованием АТФ и ГТФ,
Реакции, продуцирующие НАДН и ФАДН2 и использующие их,
Так как глюкоза образует две триозы, то все соединения, образующиеся ниже ГАФ-дегидрогеназной реакции, образуются в двойном (относительно глюкозы) количестве.
Слайд 86
РАСЧЕТ АТФ ПРИ АНАЭРОБНОМ ОКИСЛЕНИИ
На подготовительном этапе на
активацию глюкозы затрачивается 2 молекулы АТФ, фосфат каждой из
которых оказывается на триозе – глицеральдегидфосфате и диоксиацетонфосфате.
В следующий второй этап входят две молекулы глицеральдегидфосфата, каждая из которых окисляется до пирувата с образованием 2-х молекул АТФ в седьмой и десятой реакциях – реакциях субстратного фосфорилирования. Таким образом, суммируя, получаем, что на пути от глюкозы до пирувата в чистом виде образуется 2 молекулы АТФ.
Однако надо иметь в виду и пятую, глицеральдегидфосфат-дегидрогеназную, реакцию, из которой выходит НАДН. Если условия анаэробные, то он используется в лактатдегидрогеназной реакции, где окисляется для образования лактата и в получении АТФ не участвует.
Слайд 87
УЧАСТКИ ГЛИКОЛИЗА, СВЯЗАННЫЕ С ОБРАЗОВАНИЕМ И ЗАТРАТОЙ ЭНЕРГИИ
Слайд 88
АЭРОБНОЕ ОКИСЛЕНИЕ
Если в клетке имеется кислород, то НАДН
из гликолиза направляется в митохондрию, на процессы окислительного фосфорилирования,
и там его окисление приносит три молекулы АТФ.
Образовавшийся в гликолизе пируват в аэробных условиях превращается в ПВК-дегидрогеназном комплексе в ацетил-S-КоА, при этом образуется 1 молекула НАДН.
Ацетил-S-КоА вовлекается в ЦТК и, окисляясь, дает 3 молекулы НАДН, 1 молекулу ФАДН2, 1 молекулу ГТФ. Молекулы НАДН и ФАДН2 движутся в дыхательную цепь, где при их окислении в сумме образуется 11 молекул АТФ. В целом при сгорании одной ацетогруппы в ЦТК образуется 12 молекул АТФ.
Суммируя результаты окисления "гликолитического" и "пируватдегидрогеназного" НАДН, "гликолитический" АТФ, энергетический выход ЦТК и умножая все на 2, получаем 38 молекул АТФ.
Слайд 89
УЧАСТКИ ОКИСЛЕНИЯ ГЛЮКОЗЫ, СВЯЗАННЫЕ С ОБРАЗОВАНИЕМ ЭНЕРГИИ
Слайд 90
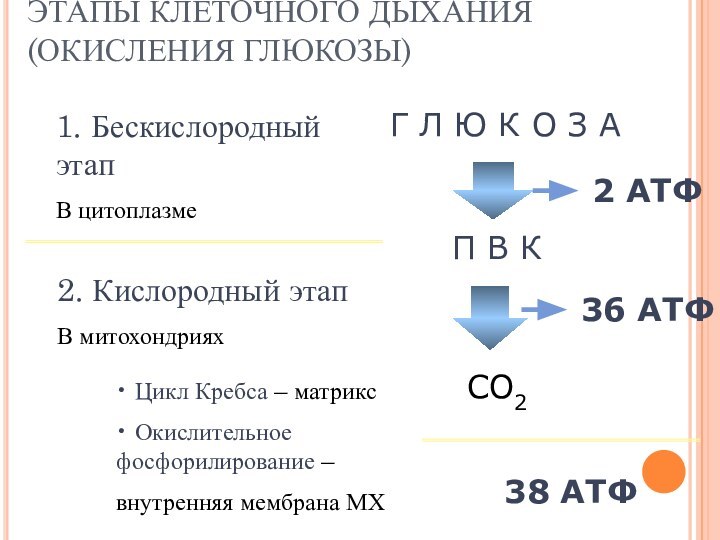
1. Бескислородный этап
В цитоплазме
ЭТАПЫ КЛЕТОЧНОГО ДЫХАНИЯ (ОКИСЛЕНИЯ ГЛЮКОЗЫ)
Г
Л Ю К О З А
П В К
2. Кислородный
этап
В митохондриях
СО2
36 АТФ
2 АТФ
38 АТФ
Цикл Кребса – матрикс
Окислительное фосфорилирование –
внутренняя мембрана МХ
Слайд 91
АТФ В ЦИФРАХ
Время жизни – несколько секунд
Человек
затрачивает ~ 2 300 ккал энергии в сутки.
Для этого
надо расщепить 166 кг АТФ
На самом деле в организме содержится только ~ 50 г АТФ
Поэтому каждая молекула АТФ должна вновь синтезироваться 166 кг : 50 г ≈ 3320 раз в сутки.
АТФ → АДФ → АТФ
Слайд 92
ГЛЮКОНЕОГЕНЕЗ
В клетках организма всегда существует потребность в глюкозе:
для
эритроцитов глюкоза является единственным источником энергии,
нервная ткань потребляет около
120 г глюкозы в сутки и эта величина практически не зависит от интенсивности ее работы. Только в экстремальных ситуациях (длительное голодание) она способна получать энергию из неуглеводных источников,
глюкоза играет весомую роль для поддержания необходимых концентраций метаболитов цикла трикарбоновых кислот (в первую очередь оксалоацетата).
Слайд 93
ГЛЮКОНЕОГЕНЕЗ (ПРОДОЛЖЕНИЕ)
Таким образом, при определенных ситуациях – при
низком содержании углеводов в пище, голодании, длительной физической работе,
т.е. когда глюкоза крови расходуется и наступает гипогликемия, организм должен иметь возможность синтезировать глюкозу и нормализовать ее концентрацию в крови. Это достигается реакциями глюконеогенеза
Глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из аминокислот.
Необходимость глюконеогенеза в организме демонстрируют два цикла – глюкозо-лактатный и глюкозо-аланиновый.
Слайд 94
ГЛЮКОЗО-ЛАКТАТНЫЙ ЦИКЛ (ЦИКЛ КОРИ)
Глюкозо-лактатный цикл (цикл Кори) –
это циклический процесс, объединяющий реакции глюконеогенеза и реакции анаэробного
гликолиза. Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступающий в основном из эритроцитов или мышечной ткани.
В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии.
В скелетных мышцах высокое накопление молочной кислоты (лактата) является следствием гликолиза при очень интенсивной, субмаксимальной мощности, работе. Но даже при работе низкой и средней интенсивности в скелетной мышце всегда образуется некоторое количество лактата.
Слайд 95
ЦИКЛ КОРИ
Убрать молочную кислоту можно только одним способом
– превратить ее в пировиноградную кислоту. Однако сама мышечная
клетка ни при работе, ни во время отдыха не способна превратить лактат в пируват из-за особенностей изофермента лактатдегидрогеназы-5.
Зато клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу. Поэтому во время и после нагрузки (при восстановлении) лактат легко удаляется из мышцы. Это происходит довольно быстро, всего через 0,5-1,5 часа в мышце лактата уже нет. Малая часть молочной кислоты выводится с мочой.
Большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. Глюкоза, образованная в печени используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена. Также она может распределиться по другим органам.
Слайд 96
ГЛЮКОЗО-ЛАКТАТНЫЙ (ВЫДЕЛЕН ЖЕЛТЫМ) И ГЛЮКОЗО-АЛАНИНОВЫЙ ЦИКЛЫ