Слайд 2
Рекомбинация - это процесс, который обеспечивает перемешивание генов
в ряду поколений.
При формировании половых клеток гены, полученные
от родителей, “перетасовываются”, и в каждую гамету попадает только половина родительских генов.
Комбинация генов в зиготе происходит случайно.
Сочетание этих двух случайных процессов, перемешивание генов в половых клетках и формирование из гамет зиготы, обеспечивает уникальность набора генов каждого организма.
Слайд 3
Генетическая рекомбинация
1)Генетическая рекомбинация – это процесс реорганизации генетического
материала посредством разрывов, обмена участками и воссоединения молекул ДНК
2)Генетическая
рекомбинация является одним из основных источников наследственной изменчивости у всех живых организмов. Это определяет ее важную роль как в эволюции, так и в онтогенетической изменчивости.
3)Генетическая рекомбинация участвует в репарации двунитевых разрывов ДНК.
4)Для рекомбинации необходим физический контакт между рекомбинирующими участками ДНК – синапсис.
5)Генетическая рекомбинация бывает гомологичная и негомологичная
Слайд 4
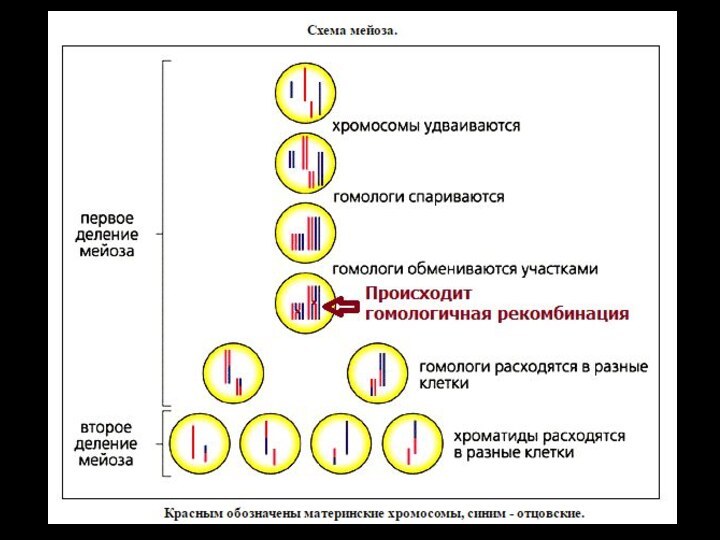
Гомологичная рекомбинация
Мейотическая рекомбинация
У эукариот наиболее типичен обмен участками
гомологичных хромосом в мейозе. Этот обмен может происходить между
плотно конъюгированными хромосомами на ранних стадиях развития половых клеток.
Митотическая рекомбинация
Осуществляется в митозе, направлена на репарацию разрывов в ДНК
Может сопровождаться нежелательными последствиями (например, возникновением мозаицизма).
Может быть вызвана рентгеновским облучением клеток на стадии G2 клеточного цикла. Индуцированная митотическая рекомбинация - метод изучения действия генов в процессе развития.
Слайд 6
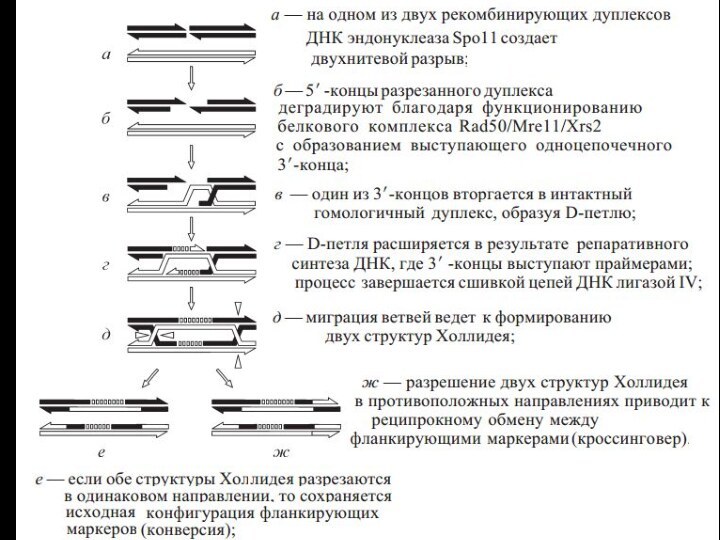
Основные функции гомологичной рекомбинации
Репарация ДНК
Восстановление разрушенной репликационной вилки
Точное устранение двухцепочечных разрывов и др. повреждений ДНК
Обмен
генетической информацией между двумя гомологичными хромосомами
Создаются новые сочетания последовательностей ДНК в каждой из хромосом, что может иметь потенциальную эволюционную выгоду
Образование и сохранение физической связи между гомологами до их расхождения в первом делении мейоза.
Если между парой гомологов не произошло ни одного обмена, то они могут неправильно разойтись к полюсам деления. Тогда у одних гамет будет избыточная доза генов, а у других этих генов не будет вовсе. И то, и другое чаще всего ведет к гибели организмов
Слайд 8
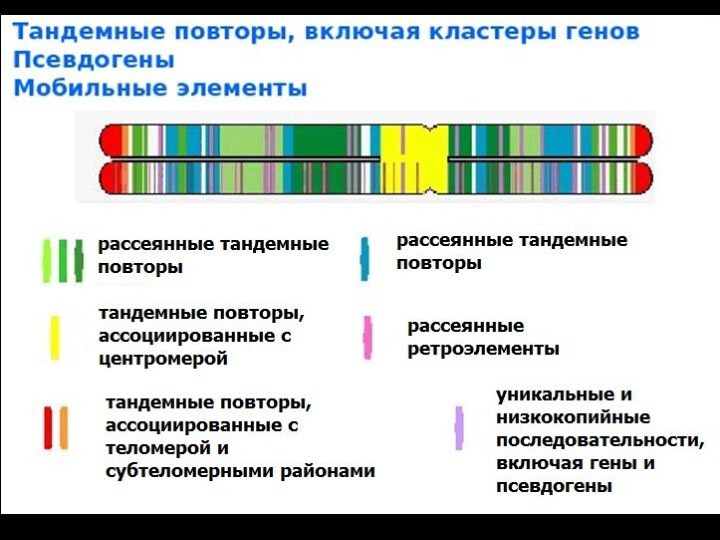
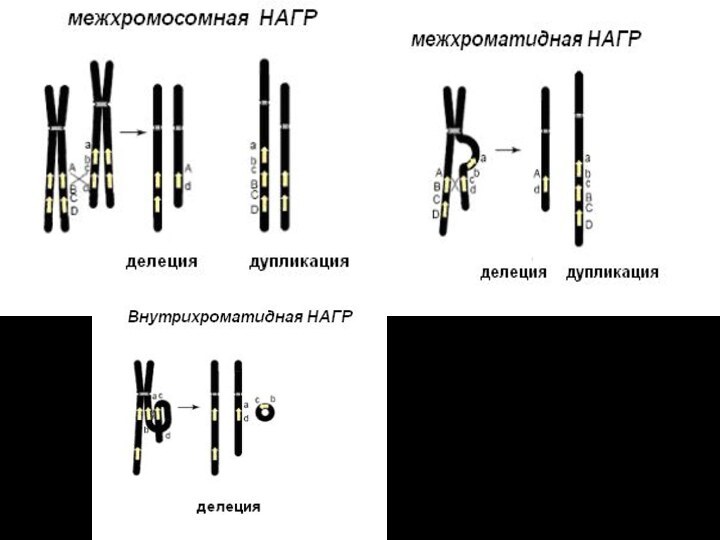
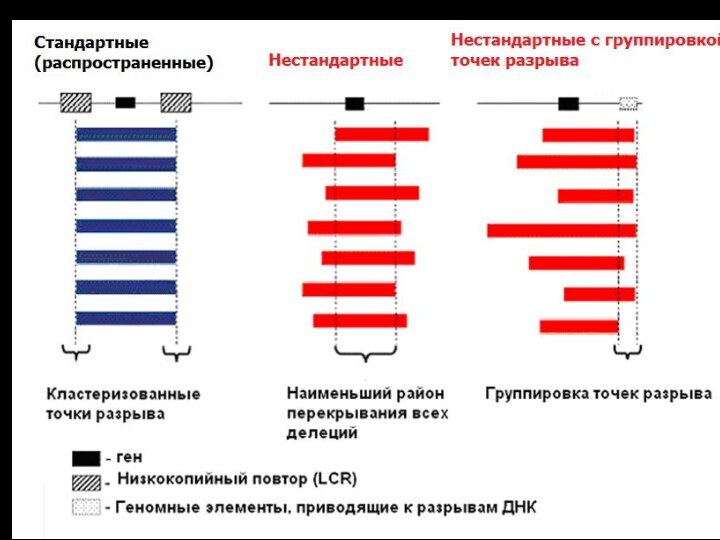
Молекулярные механизмы и организация районов перестроек
НАГР – неаллельная
гомологичная рекомбинация
Основным субстратом для рекомбинации являются повторяющиеся
элеметы генома
кластеры низкокопийных повторов – 10-500 т.п.н.,
до 98% гомологии
- располагаются в «горячих точках», в субтеломерных или прицентромерных районах
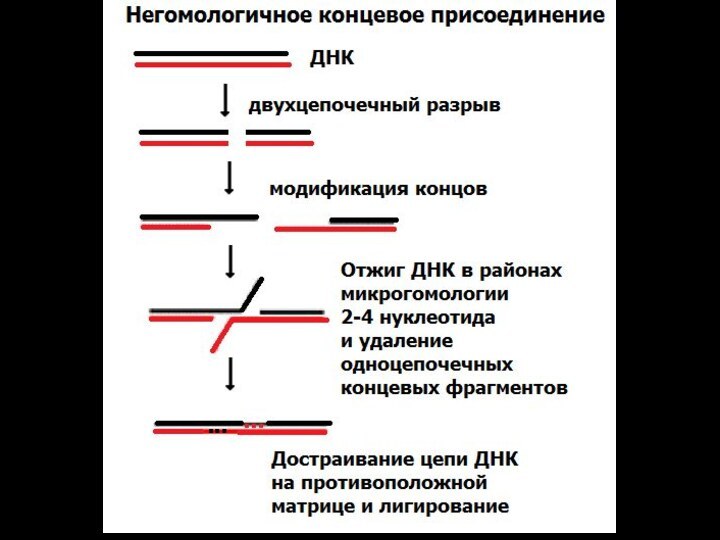
НГКП – негомологичное концевое присоединение
- АТ- богатые палиндромы, рассеянные повторы Alu, транспозоны
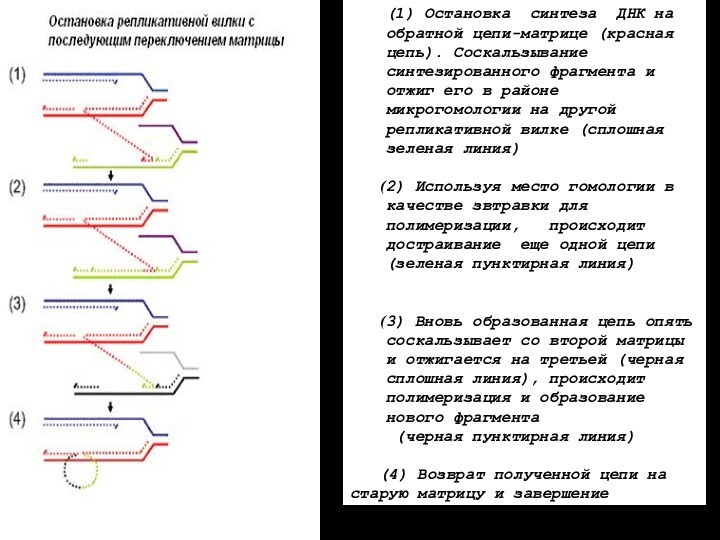
ПМПР – переключение матрицы в процессе репликации
Слайд 9
Повторяющиеся последовательности в геноме
VNTR (variable number tandem
repeats)
Слайд 11
Характеристика «горячих точек рекомбинации»
1. Наличие минимального гомологичного фрагмента
у низкокопийных повторов, обладающих высокой нуклеотидной схожестью или идентичностью.
Экспериментально, на культурах мышиных клеток показано, что снижение гомологии между повторами с 232 до 134 пар нуклеотидов приводит к 20-кратному снижению межхромосомной рекомбинации.
2. Наличие в этих районах АТ-богатых палиндромных последовательностей.
Большие палиндромные последовательности обладают высокой нестабильностью в клетках мышиных культур. Они подвергаются перестройкам, и особенно делециям, с частотой примерно 56%.
3. Наличие cis-активирующих элементов, таких как транспозон-подобные и минисателлитные последовательности
Они напрямую не связаны с рекомбинационными событиями, но их присутствие повышает способность клетки к образованию двуцепочечных разрывов ДНК.
Слайд 12
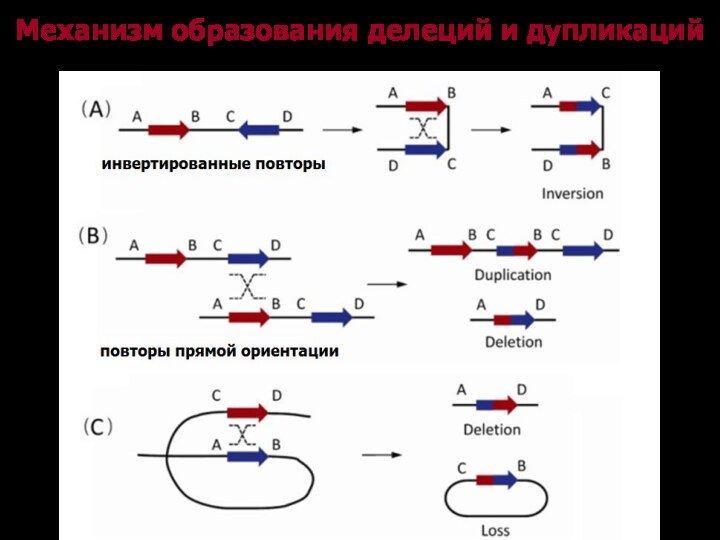
Механизм образования делеций и дупликаций
Слайд 13
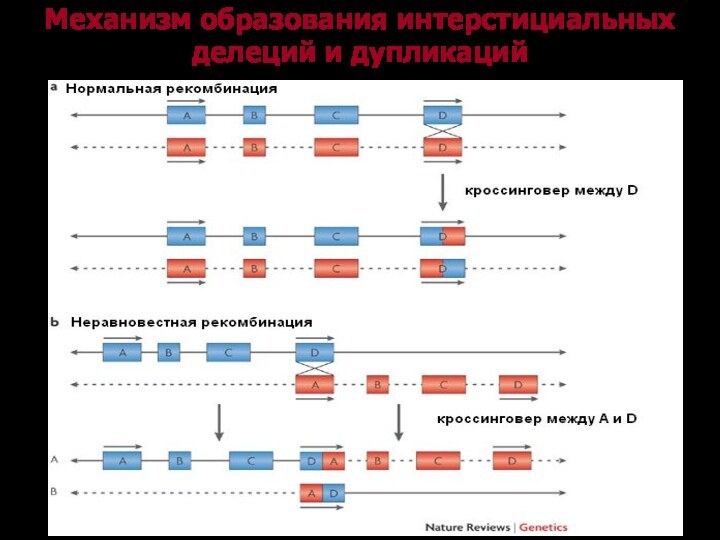
Механизм образования интерстициальных делеций и дупликаций
Слайд 16
(1) Остановка синтеза ДНК на обратной цепи-матрице (красная
цепь). Соскальзывание синтезированного фрагмента и отжиг его в районе
микрогомологии на другой репликативной вилке (сплошная зеленая линия)
2) Используя место гомологии в качестве звтравки для полимеризации, происходит достраивание еще одной цепи (зеленая пунктирная линия)
3) Вновь образованная цепь опять соскальзывает со второй матрицы и отжигается на третьей (черная сплошная линия), происходит полимеризация и образование нового фрагмента
(черная пунктирная линия)
(4) Возврат полученной цепи на старую матрицу и завершение репликации.
Слайд 19
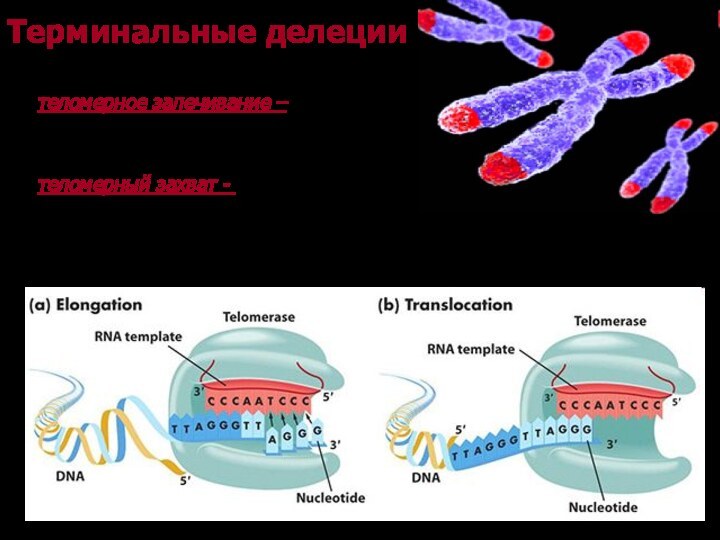
Терминальные делеции
Восстановление теломеры
теломерное залечивание – добавление теломерных
повторов непосредственно на хромосомнный конец
теломерный захват - присоединение
теломерных повторов с другой хромиосомы
Слайд 20
Механизм формирования теломерных делеций и дупликаций
Образование анафазного
моста и его разрыв
Слайд 21
Нозологические формы, сопровождающиеся микрохромосомными аномалиями
.с-м Вольфа-Хиршхорна
del(4)(p16)
.с-м “кошачьего крика” del(5)(p15.5)
.с-м Вильямса del(7)(q11.2)
.с-мы Лангера-Гидиона и ТРФС-I del(8)(q24.1)
.с-мы WAGR и Денниса-Драша del(11)(p13)
.с-м Видеманна-Беквита dup(11)(p15.3)
.с-м DEFECT 11 del(11)(p12)
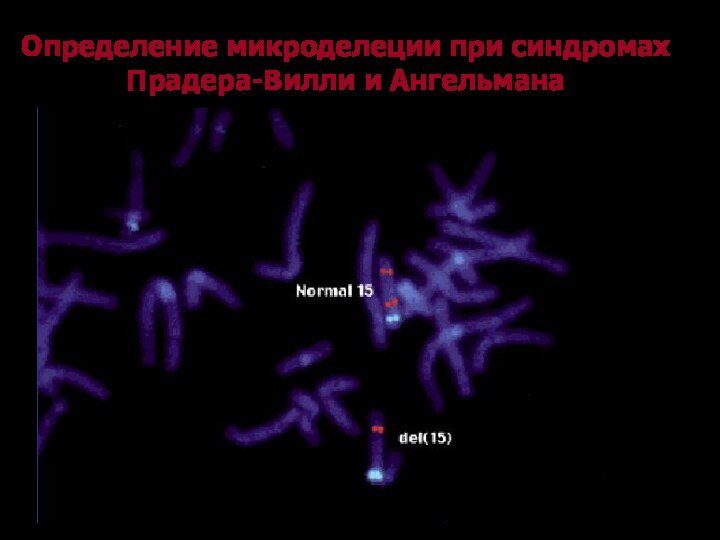
.с-м Прадера-Вилли del(15)(q11.2-q13)
.с-м Ангельмана del(15)(q11.2-q13
с-м Рубинштейна-Тейби del(16)(p13)
.с-м Смита-Магениса del(17)(p11.2)
.с-м Миллера-Дикера del(17)(p13.3)
.с-м Алладжила-Уотсона del(20)(p11.2)
.с-мы ДиДжорджи и вело-кардио-фациальный del(22)(q11.21)
Ретинобластома и остеосаркома del(13)(q14.1)
.Нейрофиброматоз, тип I del(17)(q11.2)
Слайд 22
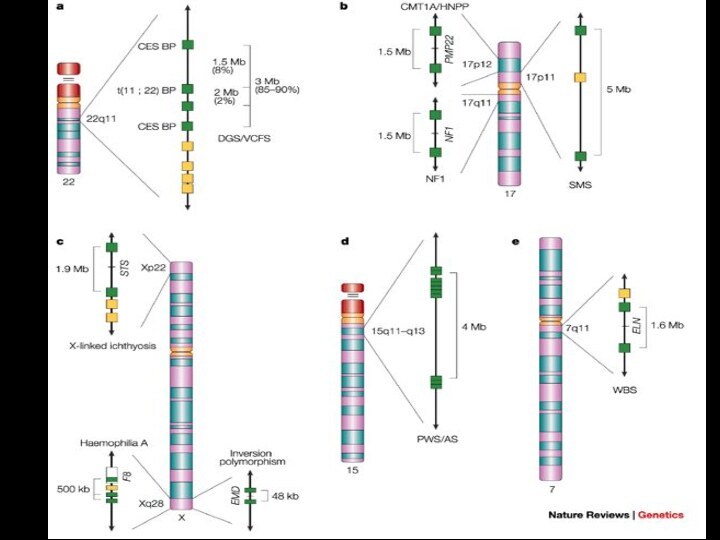
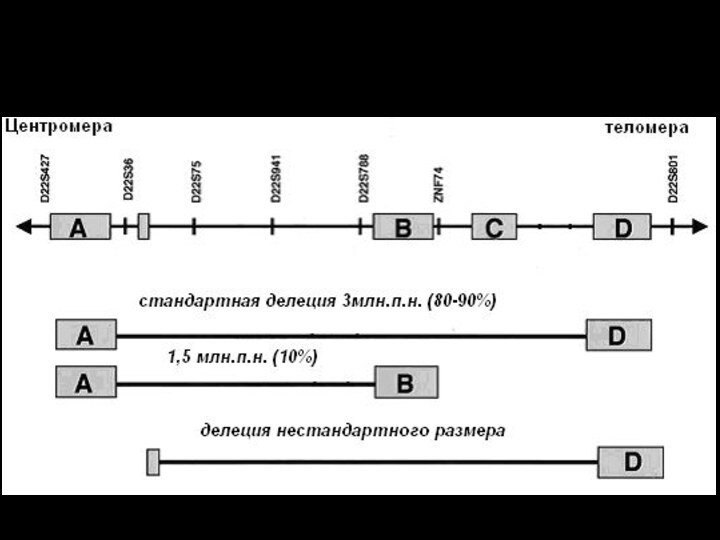
Характеристика микроделеционных синдромов
1.Наличие протяженной делеции
Размер от
видимой в микроскоп до определяемой молекулярными методами
Синдром Вильямса
- 1,5-1,8 м.п.н
Синдром Прадера-Вилли и Ангельмена – 4,5-5 млн.п.н.
Синдрома Ди-Джорджи и CATCH22 - 1,5 - 3 млн.п.н.
2. Механизм: неаллельная гомологичная рекомбинация
Наличие низкокопийных кластеров повторов или псевдогенов по краям зоны делеции
Кластеризация точек разрыва
Наличие района наименьшего перекрывания всех делеций
3. Большое количество генов в районе наименьшего перекрывания всех делеций - синдромы генных последовательностей
– до нескольких десятков в зоне делеции
4.Выделение одного главного гена
Синдром Вильямса ELN
Синдром Смита-Магениса RAI1
Синдром Ди-Джорджи и CATCH22 TBX1
Синдром Миллера-Дикера LIS1
Синдром Ангельмана UBE3A
Слайд 24
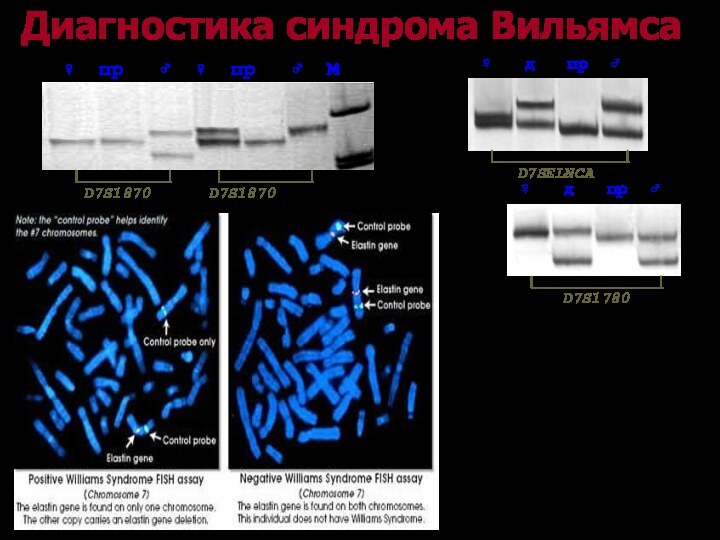
Методы диагностики микроделеционных синдромов
Цитогенетические методы
Кариотипирование
Метод FISH
Молекулярно-генетические методы
Микросателлитный анализ
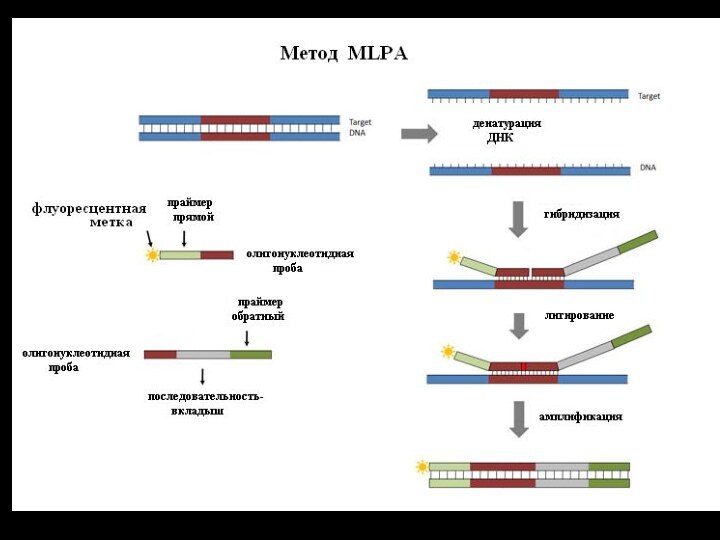
MLPA
Микроматричный
анализ
Слайд 25
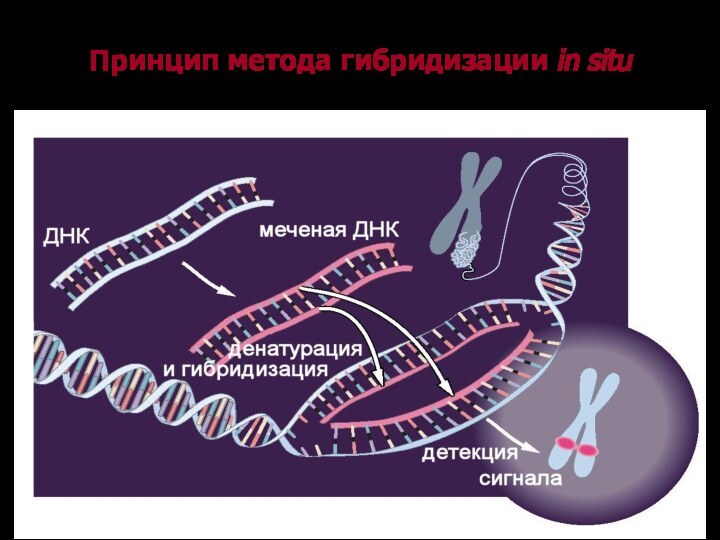
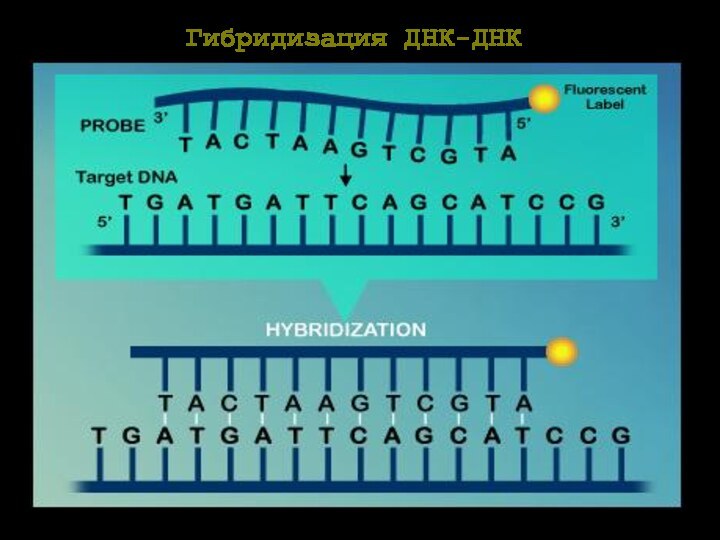
Принцип метода гибридизации in situ
Слайд 26
Определение микроделеции при синдромах Прадера-Вилли и Ангельмана
Слайд 27
Определение микроделеции при синдроме ДиДжорджи
Слайд 28
Микросателлиты –это фрагменты ДНК с большим количеством –

до сотни и даже выше – тандемно повторяющихся идентичных
«мотивов», обычно называемых «повторами»: короткими последовательностями из нескольких (как обычно принято считать – от одной до шести) пар нуклеотидов.
D1S243
TGAGCCTCCC ACGCCTCAGT TTCCCCTGCA GAAAACACCC TGCATCCAAn ACGGGCCTTG GTGTCCAGCC CTGGGGCGGA AACnCCGnAC GCATGTCCAC ACACGTGtAG GCACGCGGGC ACACACAGGC TCACATGCCT GnACnCATGC GCGCGCGCAC ACACACAC ACACACACAC ACACACACAC ACACACACAC ACACACACGG GTGTTACCAA AACGGCCCCG CCTGAATCGC TGAGGCCTCG ACCCAAGGCC GGAAAAGTCC ATGACGCTGG AGCAGGGATG AGGTnCCATT CCAGCAGGCT GGGGGAGG
D22S1245 GCAGGGTGTGGTGGCGAGTGCCTGTAATCTCAGTTACTTGGGAGGCTGAGGCAGGAGAATTCCTTGAACCTGGGAGGCAGAGGTTGCAGTGAGCTGAGACCCAGCCAGTGCACTTCAGCCTGGGCAACAAGAGTGGAACTGGGACTCAGАAAACАAAACAAAACAAAACAAAACAAAACTGGTTAACATGTAACTAAGTCTAAACAAGCATTTATTTTCCGACAGGGTTAGTAATAACAGAGATGACTAATTGGAGATAACAACATGGACAAAAACCTATATAGGATGAGAGGAGCGAT
D22S368 TTTTTTAAAGAACCAGCTTTTGGTTTCATTGATTACCCTCAACTGTGTATATATTTTTTATTCCATTGATTCTGATCTTTCCTTCTAATTCACTTTTCCCTTTCTTTCTTTTCTTTCTTTTCCTTCTTTCTTTCTTTCTTTCTTTTCCTTCTTTCTTTCTTTCTTTCTTTTCCTTCTTTCTTTCTTTCTTTCTTTCTTTCTTTCTTTCTTTCTTTCTTTCTTTTCCTTCTTTCTTTCTTTCTTTGTCCCTCCCTCTTCCTCTTCCTCTTCCTCTCTCTCTTTTTCTTTCTTTTCTTTCTTTCTGACAGAGTCTCACTCTGTTGCCCAGGCTGGAGTCCAGTGACACTATCACAGCTTACTGCAGCCTTGACCTCCTGGGCTCAAGCGATCCTTCAGCCT
Слайд 30
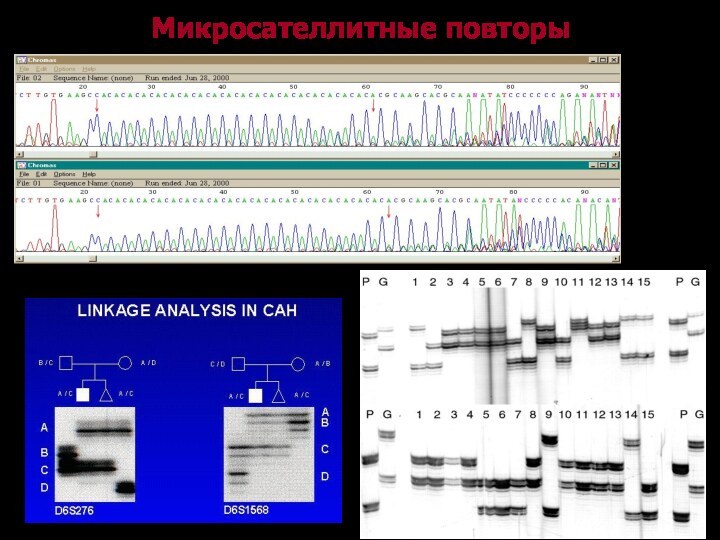
Микросателлитный анализ
Преимущества: простота и доступность метода ПЦР
Объект исследования:
Повторяющиеся
последовательности генома (ди-, три-, тетрануклеотидные)
Высокая гетерозиготность ( выше 80%)
Высокий
полиморфизм (более чем два аллеля)
Необходимость использования для диагностики нескольких маркеров
Правильное расположение маркеров в районе неименьшего перекрывания всех делеций
Расположение маркеров рядом (или внутри) главного гена-кандидата
Сложность: тщательная научная разработка системы маркеров до создания из нее диагностической системы маркеров
Слайд 32
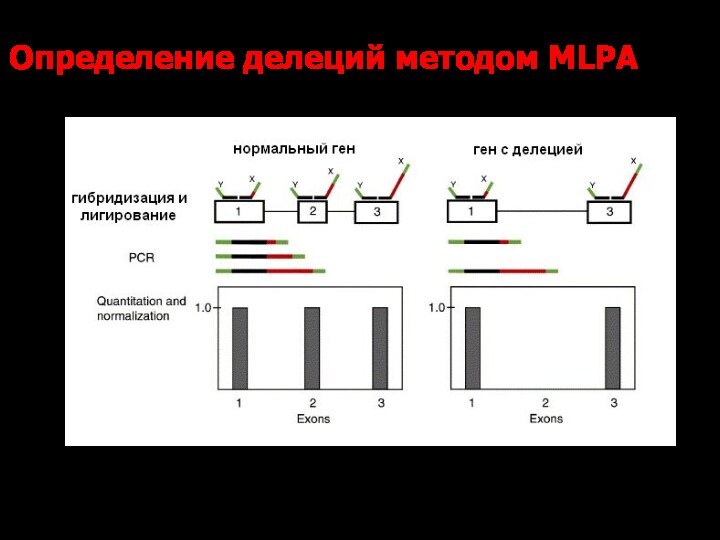
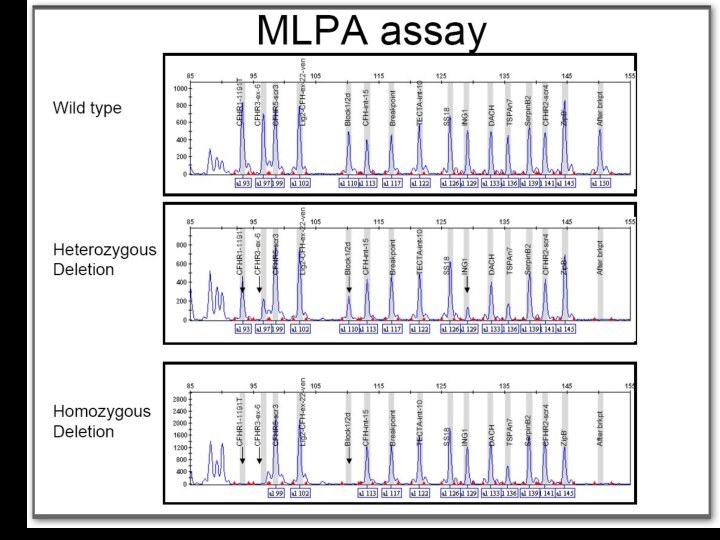
Определение делеций методом МLPA
Слайд 35
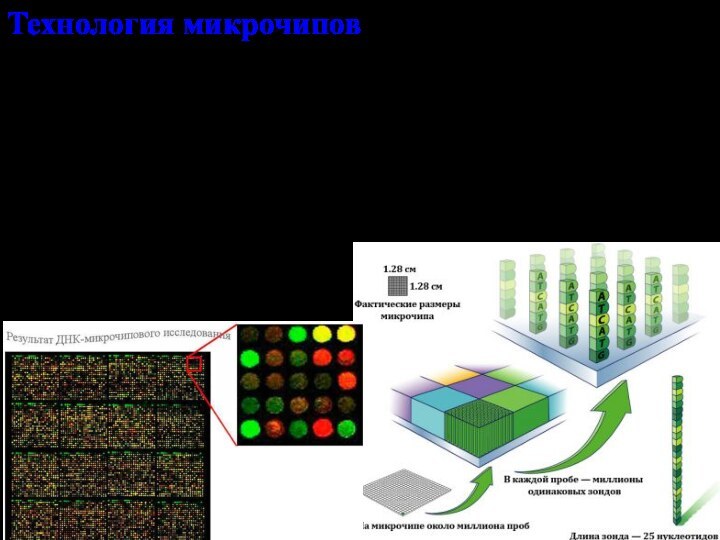
Технология микрочипов.
Микрочип – совокупность ДНК последовательностей генома
человека, закрепленная на твердой подложке в
компьютерные программы для анализа результатов
позволяет исследовать сразу множество генов или продуктов их экспрессии
гибридизация с ДНК
Слайд 37
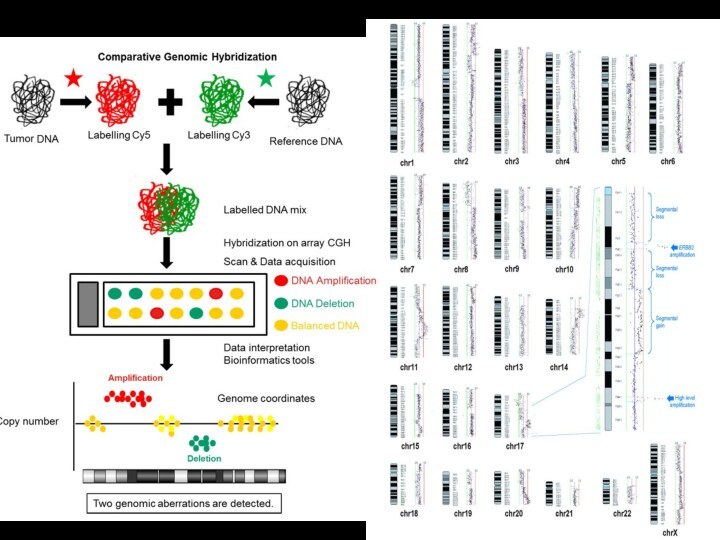
Сравнительная геномная гибрадизация и микроматричный анализ
Позволяет исследовать копийность
хромосомных локусов и определять хромосомные поломки
Позволяет выявить хромосомные
районы, стандартно подвергающиеся перестройкам, с потерей или появлением дополнительного хромосомного материала.
Позволяет выявить новые структурные перестройки, связанные с клиническими синдромами
Слайд 38
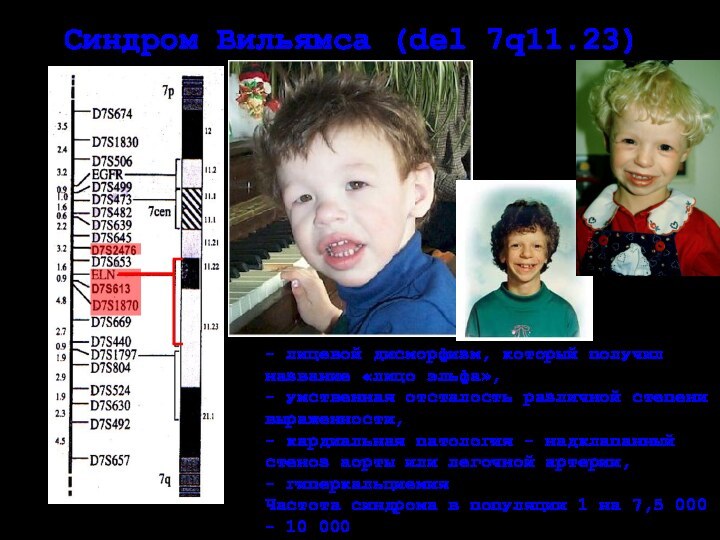
Синдром Вильямса (del 7q11.23)
- лицевой дисморфизм, который получил
название «лицо эльфа»,
- умственная отсталость различной степени выраженности,
-
кардиальная патология - надклапанный стеноз аорты или легочной артерии,
- гиперкальциемия
Частота синдрома в популяции 1 на 7,5 000 - 10 000
Слайд 40
Ген эластина картирован в 7q11.23 и состоит из
34 небольших экзонов. Размер его мРНК - примерно 3,5
т.п.н. 3’- конец этого гена обогащен Alu-повторами, что предрасполагает к участию в перестроечном процессе. Развитие некоторых клинических признаков при синдроме Вильямса напрямую связано с недостатком эластина. Этот белок является основным белком аорты (более 50%). Уменьшение содержания эластина в крупных кровеносных сосудах с возрастом вносит значительный вклад в развитие артериальной гипертензии. Практически все пациенты с синдромом имеют артериальную гипертензию.
Слайд 41
Эластин является основным компонентом развития голосовых связок и
мужских гениталий, поэтому у больных часто отмечается хриплый голос
и гипогенитализм у мужчин.
С дефицитом эластина могут быть также связаны специфические черты лица и раннее старение кожи.
Однако, существуют больные с синдромом Вильямса (10%), у которых локус эластина сохранен. В этом случае, среди клинических проявлений, сохраняется лицевой дисморфизм и умственная отсталость, но отсутствуют пороки развития сердца и сосудов.
ELN является главным геном-кандидатом для развития синдрома Вильямса, однако вклад в развитие клинической картины вносят и другие гены, расположенные в районе делеции.
Слайд 42
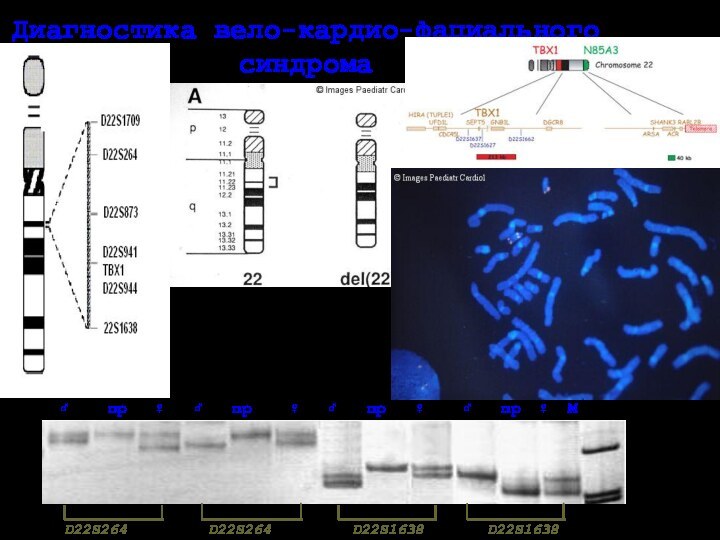
Синдромы ДиДжорджи и вело-кардио-фациальный (del 22q11.2)
Основные клинические признаки
связаны с врожденными пороками сердца,
нарушение межжелудочковой перегородки,
тетрада Фалло, стеноз легочной артерии и.т.п.
некоторая задержка умственного развития,
расщелина или аномалии неба и лицевые аномалии,
гипокальциемия,
отсутствие или гипоплазия тимуса.
Частота микроделеции 1 на 4000 живых новорожденных в популяции.
Слайд 43
Расположение кластеров низкокопийных повторов в критическом районе 22q11.2
Слайд 44
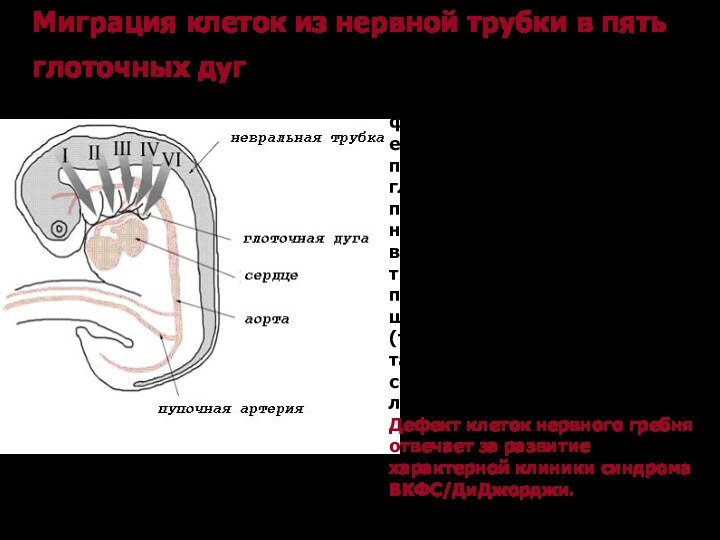
Миграция клеток из нервной трубки в пять глоточных
дуг
Клетки нервного гребня мигрируют из района невральной трубки
для формирования глоточной дуги и ее производных. Эмбрион позвоночных имеет пять пар глоточных дуг, из первых двух пар происходят кости, мышцы и нервы лица, уха, челюсти и верхнего отдела шеи. Последние три пары отвечают за происхождение костей, мышц шеи, эндокринных желез (тимуса и щитовидной железы), а также выносящих магистральных сосудов сердца – аорты и легочной артерии.
Дефект клеток нервного гребня отвечает за развитие характерной клиники синдрома ВКФС/ДиДжорджи.
Слайд 45
Эксперименты на мышиных моделях подтвердили значение гена tbx1
для развития клиники ВКФС/ДиДжорджи синдрома. Ген имеет 9 экзонов,
подвергается альтернативному сплайсингу, с образованием трех сплайс-форм (TBX1A, TBX1B и TBX1C). Все три формы с 1 по 8 экзон высоко-консервативны, и различаются только терминальными экзонами. Значение гена для клинической картины заболевания подтверждено наличием точковых мутаций у пациентов с клиническими проявлениями ВКФС/ДиДжорджи, но без хромосомной патологии. В настоящее время известны около десятка мутаций в гене TBX1, которые приводят к развитию заболевания у пациентов, при этом клинические проявления заболевания у таких больных имеют нетяжелую, частичную форму, при которой обязательно сохраняются дефекты развития сердца и сосудов.
Слайд 46
Диагностика вело-кардио-фациального
синдрома
Слайд 47
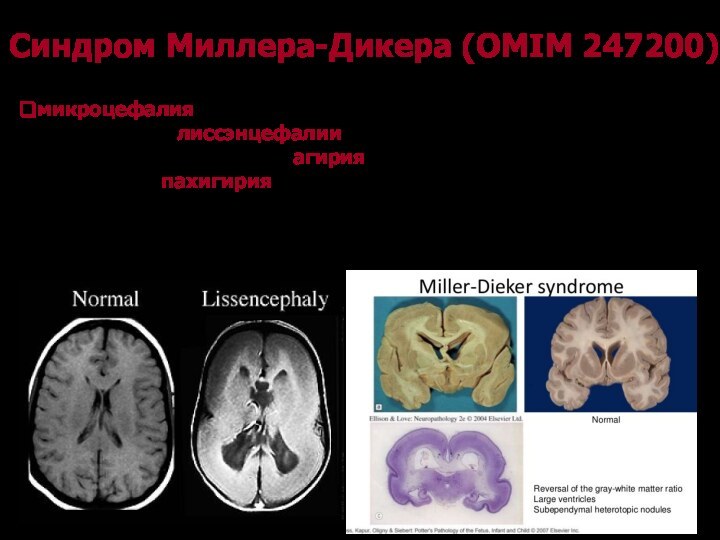
Синдром Миллера-Дикера (OMIM 247200)
Клинические признаками синдрома Миллера-Дикера
микроцефалия и тяжелые нарушения развития головного мозга по типу
лиссэнцефалии, к которым относится отсутствие борозд и извилин мозга (агирия) или уменьшение их количества (пахигирия)
уменьшение толщины коркового слоя головного мозга в результате недоразвития серого вещества.
Слайд 48
типичный внешний вид: высокий лоб, суженый в височных
областях, выступающий затылок, развернутые назад ушные раковины, антимонголоидный разрез
глаз. В некоторых случаях описаны мышечная гипотония и врожденные пороки сердца.
Слайд 49
Причиной лиссэнцефалии является нарушение миграции постмитотических нейронов из
вентрикулярной зоны в кортикальную пластину во время эмбриогенеза. В
результате происходит образование тонкого кортикального слоя, отсутствие или редукция борозд и извилин - агирия и пахигирия. Лиссэнцефалия является диагностическим признаком синдрома Миллера-Дикера, но может выступать и как изолированная форма.
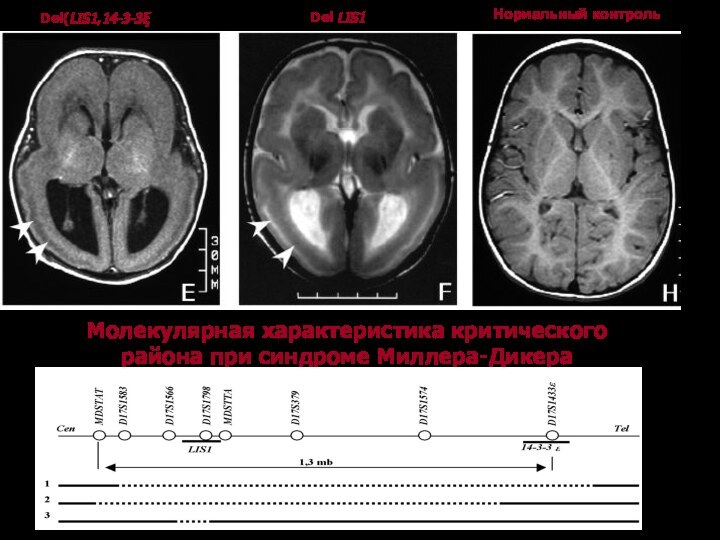
В критическом районе 17р13.3 картирован и клонирован ген LIS1. Если ген LIS1 теряется в результате протяженной делеции в локусе 17р13.3, то развивается синдром Миллера-Дикера с более тяжелым фенотипом и клиническим течением, если же повреждение затрагивает только район локализации гена, то определяется клинически менее тяжелая изолированная лиссэнцефалия.
Слайд 50
Молекулярная характеристика критического района при синдроме Миллера-Дикера
Слайд 51
Ген LIS1, локализованный в критическом районе, отвечает за
нейрональную миграцию в эмбриогенезе, кодирует не каталитическую альфа- субъединицу
внутриклеточной 1b изоформы ацетилгидролазы тромбоцит-активирующего фактора.
Ген содержит 11 экзонов и кодирует транскрипт 1,2 kb. Белок LIS1 экспрессируется в мозге, как в фетальном периоде, так и во взрослом состоянии. Основной из его функций является взаимодействие с тубулином для подавления образования микротрубочек, образующих веретено деления. Этот высоко консервативный белок принимает участие в процессе митоза и хромосомной сегрегации. На сегодняшний день известно, что 65% пациентов с изолированной лиссэнцефалией имеют точковые мутации или внутригенные делеции гена LIS1. Миссенс и нонсенс мутации, а также микроделеции равномерно распределяются по всему гену.
Слайд 53
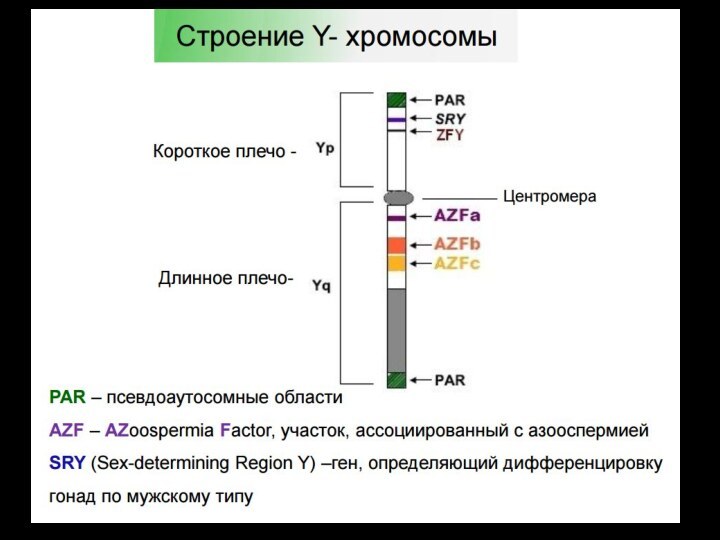
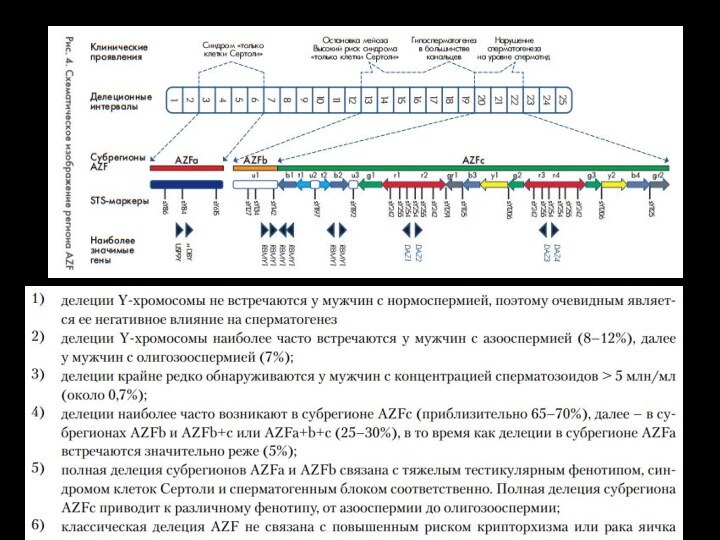
Исследование микроделеций локуса AZF на У-хромосоме
Слайд 54
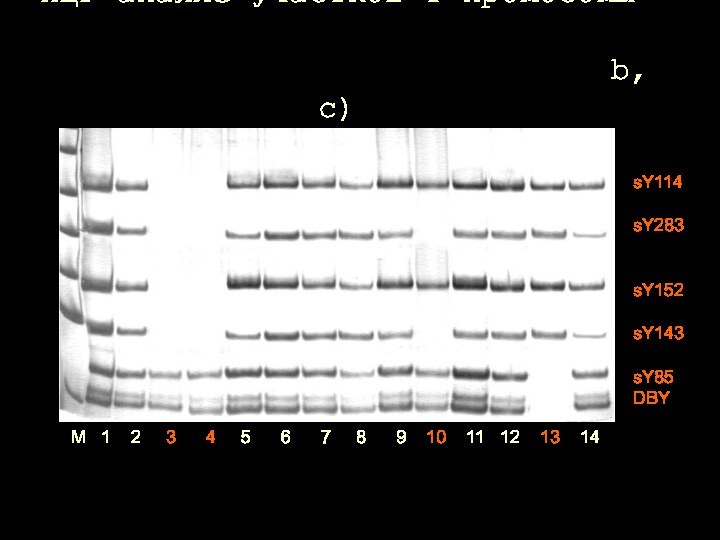
ПЦР-анализ участков Y-хромосомы
ПЦР-анализ участков Y-хромосомы
(области AZFа, b, с)(области
AZFа, b, с)
М-маркер; пробы 1, 2, 5-9, 11, 12,
14 – норма;
3, 4 – del AZFb-c; 10 - del AZFc; 13 – del AZF a
Слайд 55
Критерии отбора пациентов для проведения микроделеционного анализа Y-хромосомы