- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
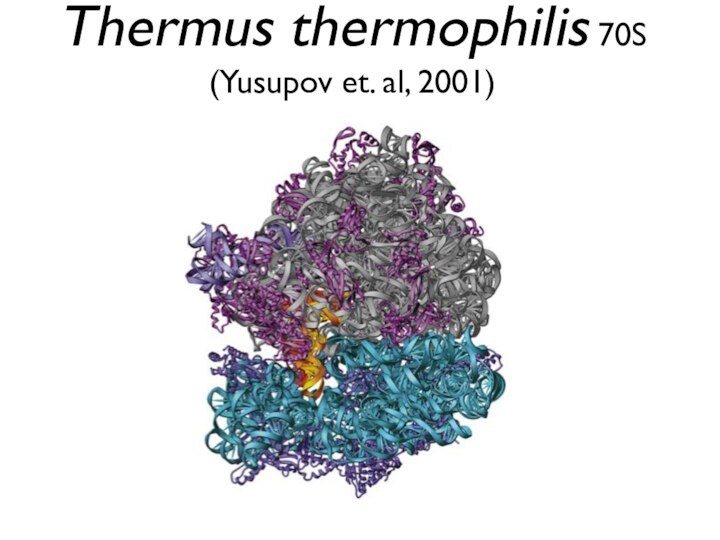
Презентация на тему Каталитический центр рибосомы
Содержание
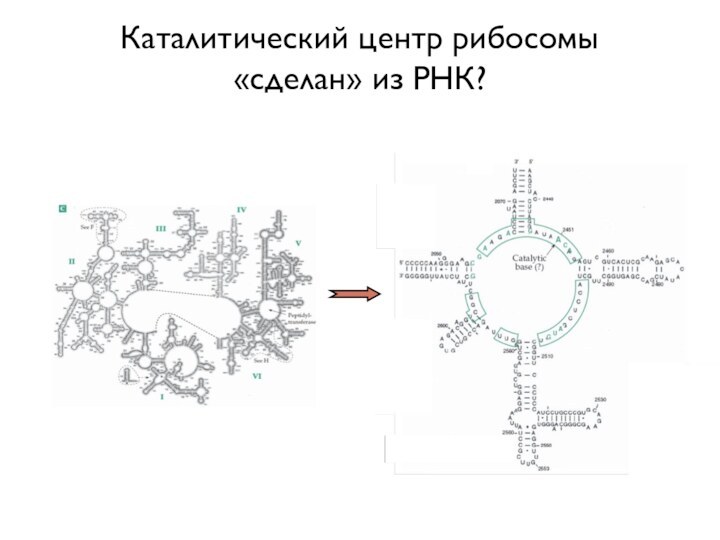
- 2. Каталитический центр рибосомы «сделан» из РНК?
- 3. 50S ribosome
- 4. ВопросВ мРНК всегда есть много триплетов, кодирующих
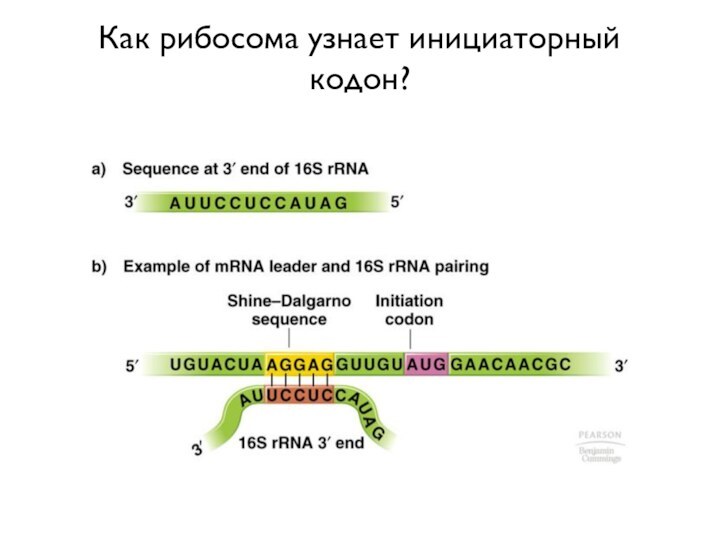
- 5. Как рибосома узнает инициаторный кодон?
- 6. ВопросЧто будет, если удалить последовательность анти-ШД из 16S rRNA?
- 7. Ответ:Грамм-отрицательные бактерии ничего не заметят и будут жить как ни в чем не бывало!
- 8. Рибосомный белок S1Связывается с AU-богатыми участками, расположенными upstream от AUG-кодонаСпособен привлекать рибосому без участия ШД
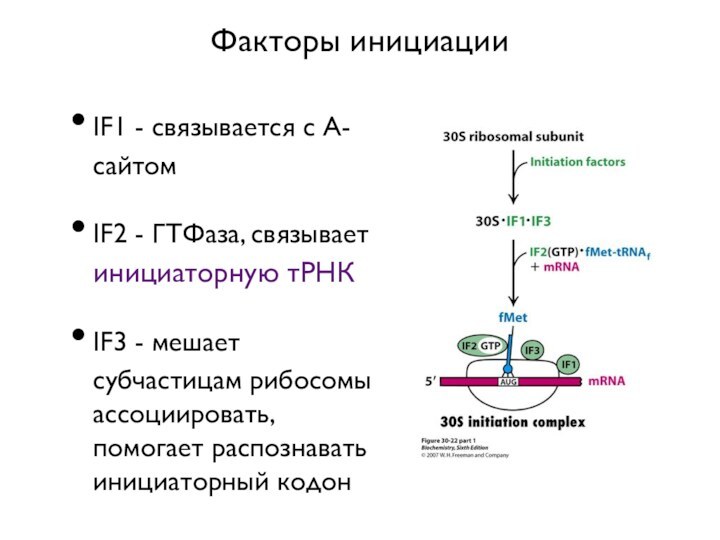
- 9. Факторы инициацииIF1 - связывается с А-сайтомIF2 -
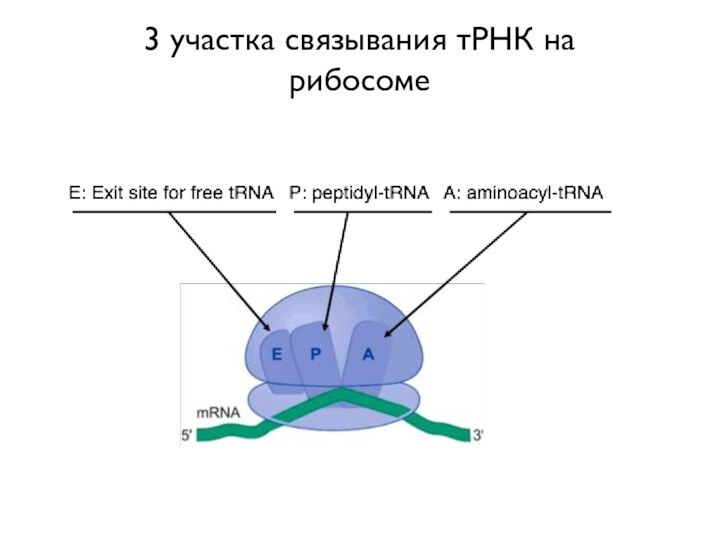
- 10. 3 участка связывания тРНК на рибосоме
- 11. Инициация: тРНК связывается с Р-сайтомЭлонгация: тРНК связывается с А-сайтом
- 12. Элонгация трансляции. Шаг 1.Инициаторная Мет-тРНК или тРНК с пептидом в Р-сайтеА-сайт свободен
- 13. Элонгация трансляции. Шаг II.P-сайт занят пептидил-тРНКВ А-сайт связывается новая аминоацил-тРНК
- 14. Элонгация трансляции. Шаг III.Транспептидация.тРНК в Р-сайте без
- 15. Элонгация трансляции. Шаг IV.Транслокация.Рибосома перемещается по мРНКВ Е-сайте - деацилированная тРНКВ Р-сайте - пептидил-тРНКА-сайт пустой
- 16. GTPase/GAP/GEFGTPase - белок, гидролизующий GTP, активность которого
- 17. Кто «работает» GAP’ом для IF2?
- 18. EF-Tu, EF-TsEF-Tu в комплексе с GTP связывает
- 19. ET-Tu и гидролиз GTPТолько в том случае,
- 20. Образование пептидной связи
- 21. EF-GПосле образования пептидной связи необходимо «сдвинуть» рибосому
- 22. Элонгация трансляции у эукариотeEF-1A - сажает тРНК
- 23. Терминация трансляцииУ бактерий 3 фактора терминацииRF1 -
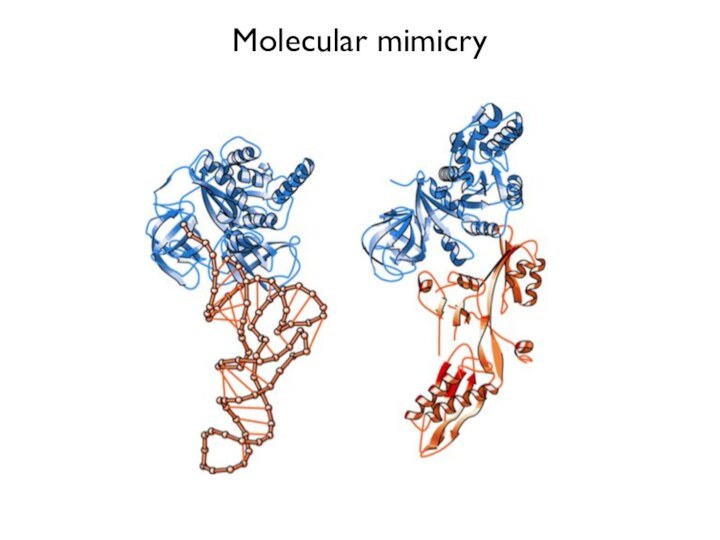
- 24. Molecular mimicry
- 25. Рибосома и антибиотикиТетрациклин - мешает посадки тРНК
- 26. СплайсингПроцесс «вырезания» из пре-мРНК некодирующих частей, интронов
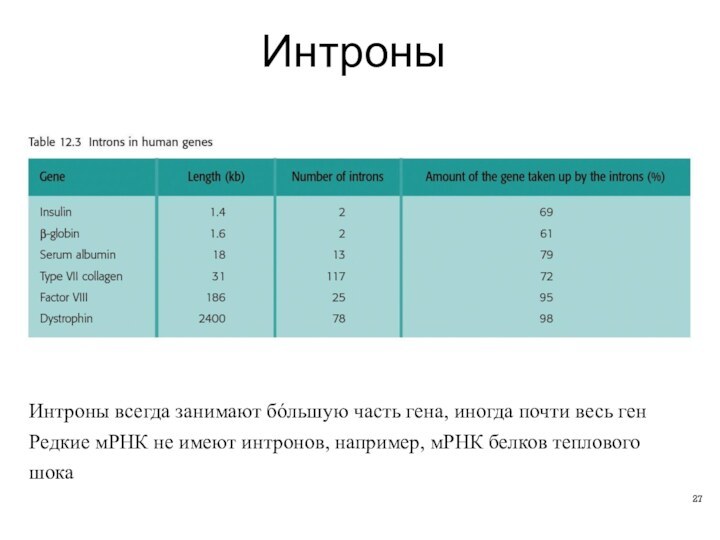
- 27. ИнтроныИнтроны всегда занимают бóльшую часть гена, иногда
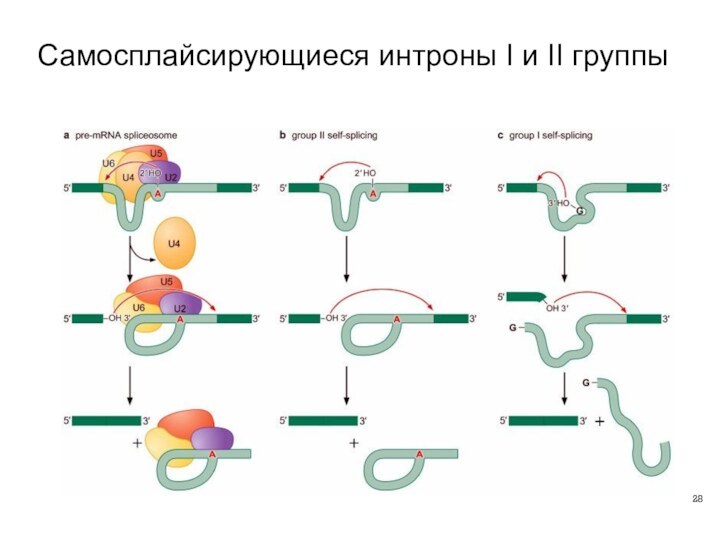
- 28. Самосплайсирующиеся интроны I и II группы
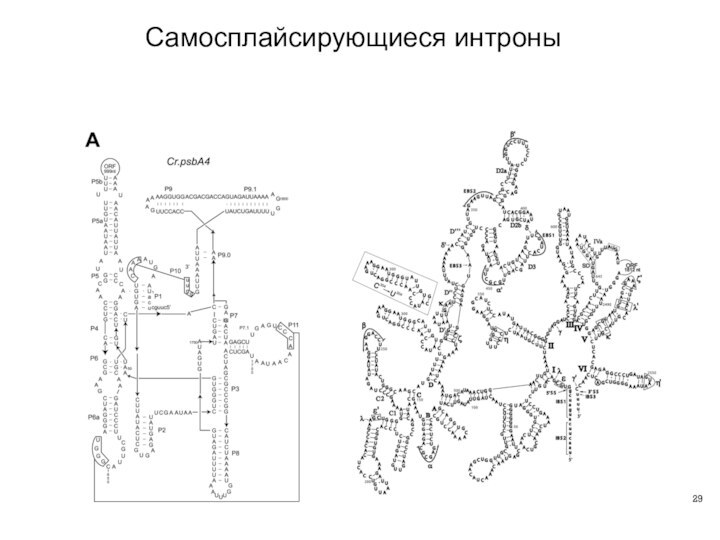
- 29. Самосплайсирующиеся интроны
- 30. СплайсосомаОгромный комплекс, состоящий из ~150 белков и
- 31. snRNA «метят» концы интрона для его вырезания
- 32. Процессинг 5’-конца мРНКАбсолютно все цитоплазматические мРНК эукариот
- 33. Альтернативный сплайсингПо различным оценкам, от 40% до
- 34. мРНК эукариот «зациклены»Wells SE et alCircularization of
- 35. СканированиеРибосома садится на 5’-конец мРНК и ползет
- 36. Kozak context/Kozak sequenceНе каждый первый AUG-кодон узнается
- 37. IRES HCVSiridechadilok B. et alStructural Roles for
- 38. Frameshift - сдвиг рамки считыванияНа повторяющихся последовательностях типа AAAAAAAAAAAСтруктуры в мРНК могут регулировать сдвиг
- 39. Как трансляция может регулировать другие процессы в клетке
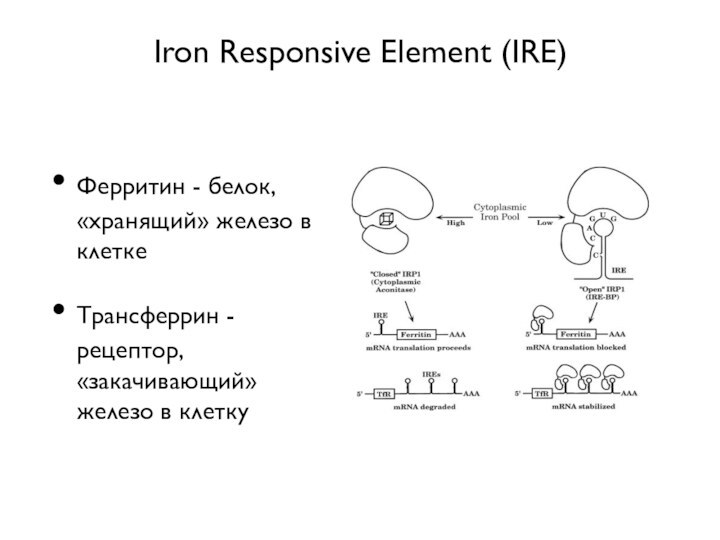
- 40. Iron Responsive Element (IRE)Ферритин - белок, «хранящий» железо в клеткеТрансферрин - рецептор, «закачивающий» железо в клетку
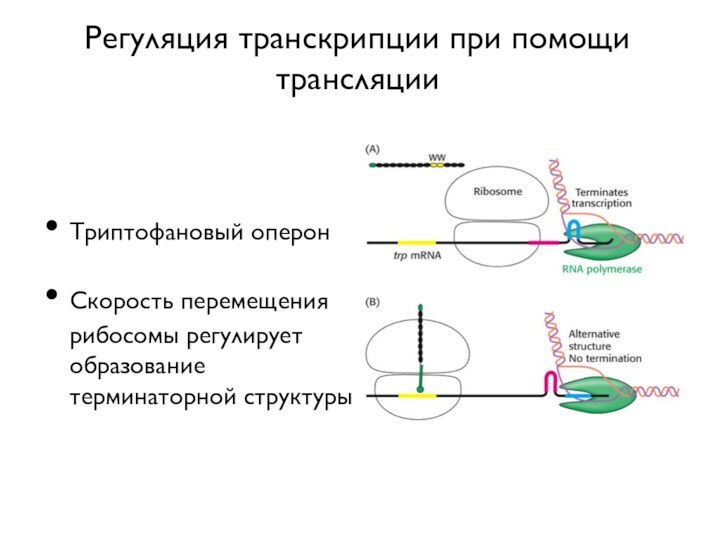
- 41. Регуляция транскрипции при помощи трансляцииТриптофановый оперонСкорость перемещения рибосомы регулирует образование терминаторной структуры
- 42. Триптофановый оперон E.coli
- 43. Что досталось нам от бактерий?
- 44. Скачать презентацию
- 45. Похожие презентации
Каталитический центр рибосомы «сделан» из РНК?
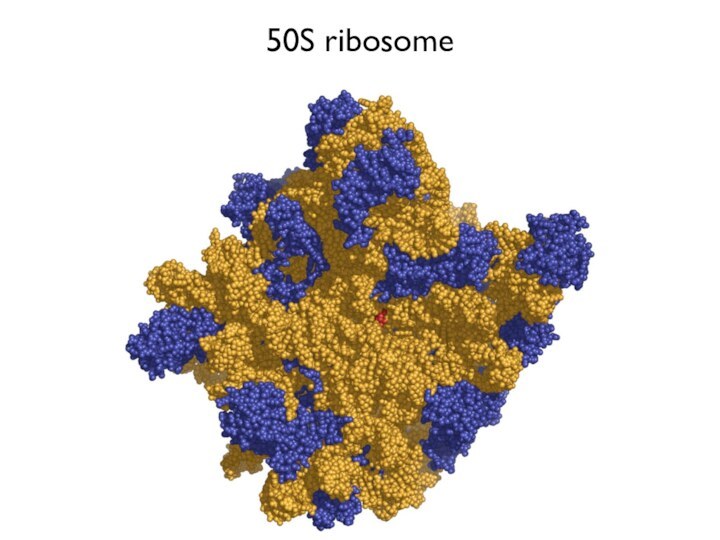
























Слайд 4
Вопрос
В мРНК всегда есть много триплетов, кодирующих метионин,
- как понять, с которого надо начинать синтез белка?
Слайд 8
Рибосомный белок S1
Связывается с AU-богатыми участками, расположенными upstream
от AUG-кодона
Способен привлекать рибосому без участия ШД
Слайд 9
Факторы инициации
IF1 - связывается с А-сайтом
IF2 - ГТФаза,
связывает инициаторную тРНК
IF3 - мешает субчастицам рибосомы ассоциировать, помогает
распознавать инициаторный кодон
Слайд 12
Элонгация трансляции. Шаг 1.
Инициаторная Мет-тРНК или тРНК с
пептидом в Р-сайте
А-сайт свободен
Слайд 13
Элонгация трансляции. Шаг II.
P-сайт занят пептидил-тРНК
В А-сайт связывается
новая аминоацил-тРНК
Слайд 14
Элонгация трансляции. Шаг III.
Транспептидация.
тРНК в Р-сайте без аминокислоты,
но пептид - в Р-сайте
тРНК в А-сайте связана с
пептидом
Слайд 15
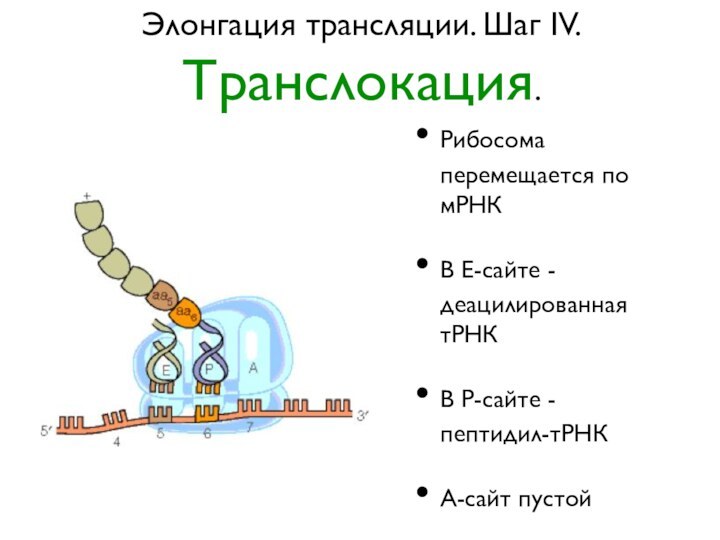
Элонгация трансляции. Шаг IV.
Транслокация.
Рибосома перемещается по мРНК
В Е-сайте
- деацилированная тРНК
В Р-сайте - пептидил-тРНК
А-сайт пустой
Слайд 16
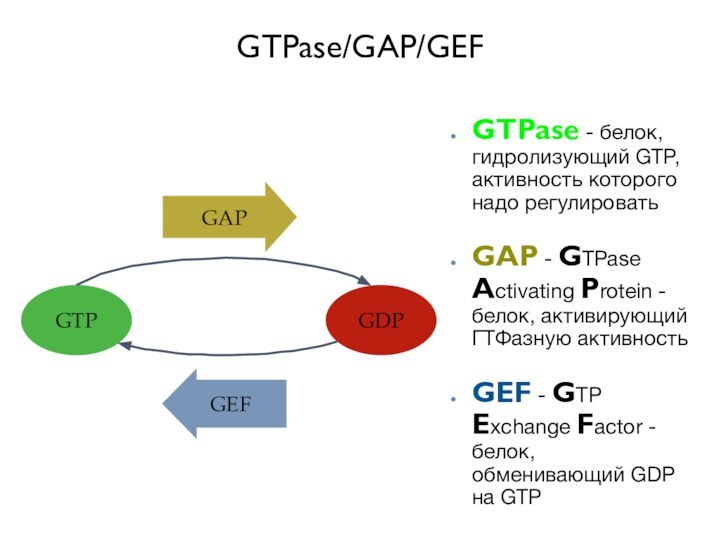
GTPase/GAP/GEF
GTPase - белок, гидролизующий GTP, активность которого надо
регулировать
GAP - GTPase Activating Protein - белок, активирующий ГТФазную
активностьGEF - GTP Exchange Factor - белок, обменивающий GDP на GTP
Слайд 18
EF-Tu, EF-Ts
EF-Tu в комплексе с GTP связывает tRNA
После
доставки tRNA в А-сайт рибосомы GTP гидролизуется и EF-Tu
уходит с рибосомыЧтобы обменять GDP на GTP нужен GEF, EF-Ts
Слайд 19
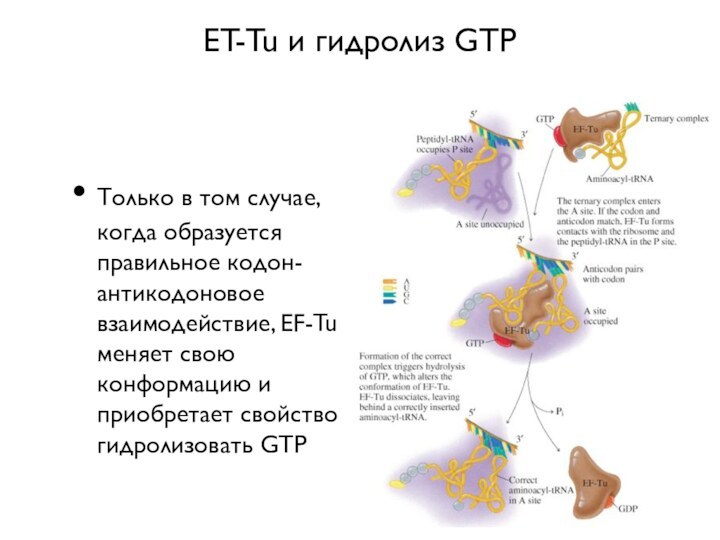
ET-Tu и гидролиз GTP
Только в том случае, когда
образуется правильное кодон-антикодоновое взаимодействие, EF-Tu меняет свою конформацию и
приобретает свойство гидролизовать GTP
Слайд 21
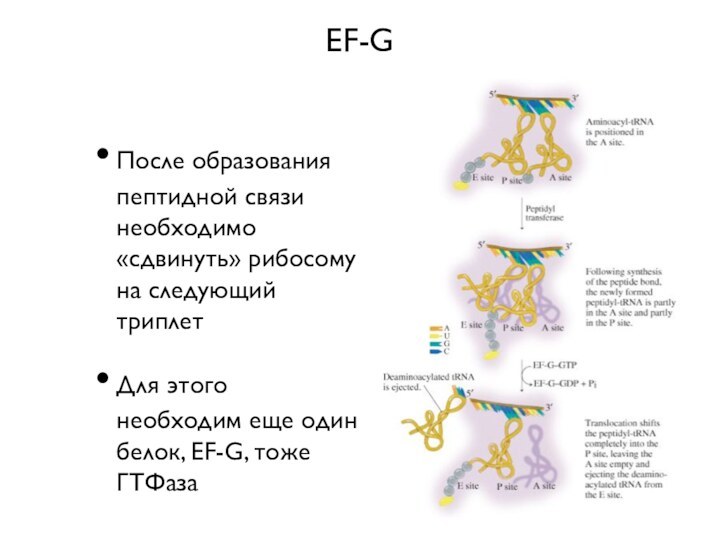
EF-G
После образования пептидной связи необходимо «сдвинуть» рибосому на
следующий триплет
Для этого необходим еще один белок, EF-G, тоже
ГТФаза
Слайд 22
Элонгация трансляции у эукариот
eEF-1A - сажает тРНК в
А-сайт (EF-Tu)
eEF-1B - обменивает GDP на GTP (EF-Ts)
eEF2 -
транслоцирует рибосому (EF-G)
Слайд 23
Терминация трансляции
У бактерий 3 фактора терминации
RF1 - узнает
UAA и UAG
RF2 - узнает UAA и UGA
RF3 -
помогает работать RF1/2, GTPaseRRF - разрушает пост-терминационную рибосому
У эукариот eRF1 узнает все три кодона
eRF3 - аналог RF3, встречается только у грибов
Слайд 25
Рибосома и антибиотики
Тетрациклин - мешает посадки тРНК в
А-сайт
Хлорамфеникол - ингибирует пептидил-трансферазную активность рибосомы
Эритромицин - «забивает» рибосомный
туннельТобрамицин - связывается с А-сайтом, но что делает конкретно не до конца ясно
Слайд 27
Интроны
Интроны всегда занимают бóльшую часть гена, иногда почти
весь ген
Редкие мРНК не имеют интронов, например, мРНК белков
теплового шока
Слайд 30
Сплайсосома
Огромный комплекс, состоящий из ~150 белков и 5
РНК
Эти РНК имеют название snRNA U1, U2, U4, U5
и U6 (потому что в них много остатков U)Существует также минорная сплайсосома в состав которой входят также U11, U12 и несколько других...
Слайд 32
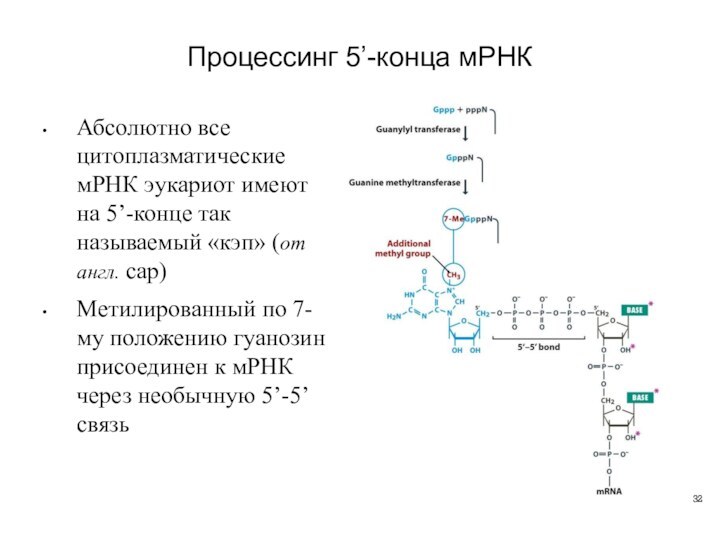
Процессинг 5’-конца мРНК
Абсолютно все цитоплазматические мРНК эукариот имеют
на 5’-конце так называемый «кэп» (от англ. cap)
Метилированный по
7-му положению гуанозин присоединен к мРНК через необычную 5’-5’ связь
Слайд 33
Альтернативный сплайсинг
По различным оценкам, от 40% до 75%
генов человека могут иметь альтернативно сплайсированные транскрипты
Также известны случаи
альтернативного полиаденилирования
Слайд 34
мРНК эукариот «зациклены»
Wells SE et al
Circularization of mRNA
by eukaryotic translation initiation factors.
Mol Cell. 1998 2:135-40.
eIF4F связывается
на 5’-конце мРНКPABP связывается на 3’-конце мРНК
eIF4F связывается с PABP
Слайд 35
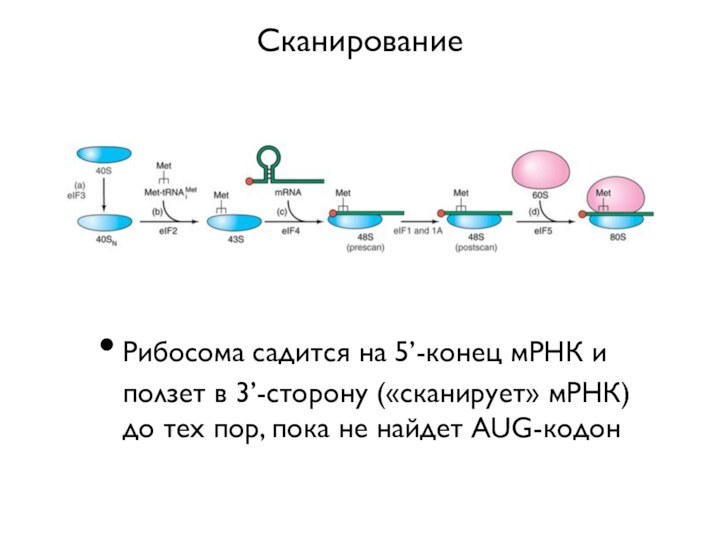
Сканирование
Рибосома садится на 5’-конец мРНК и ползет в
3’-сторону («сканирует» мРНК) до тех пор, пока не найдет
AUG-кодон
Слайд 36
Kozak context/Kozak sequence
Не каждый первый AUG-кодон узнается рибосомой
Самый
хороший AUG-кодон окружен хорошим контекстом: A/GCC AUG A/G
Еще лучше,
если в 10-15 нуклеотидах после AUG есть шпилька
Слайд 37
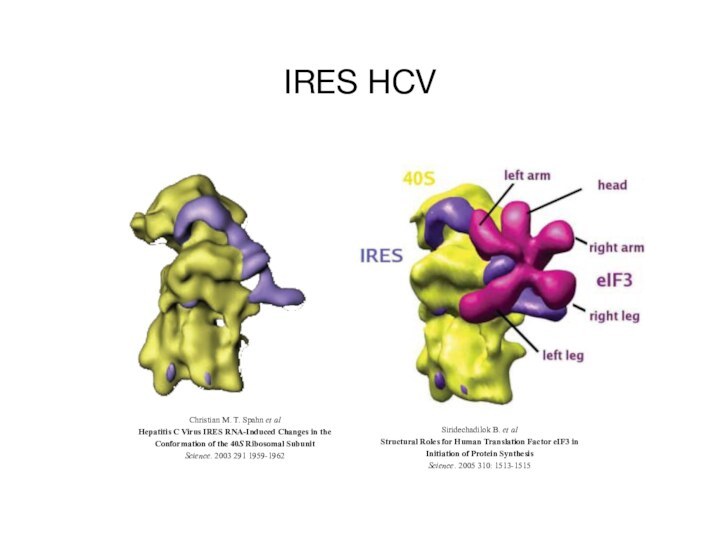
IRES HCV
Siridechadilok B. et al
Structural Roles for Human
Translation Factor eIF3 in
Initiation of Protein Synthesis
Science. 2005 310:
1513-1515Christian M. T. Spahn et al
Hepatitis C Virus IRES RNA-Induced Changes in the
Conformation of the 40S Ribosomal Subunit
Science. 2003 291 1959-1962