- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Обмен белков
Содержание
- 2. Главные научные открытия в области обмена белков принадлежат Российским ученым
- 3. Академик Опарин Александр Иванович (Лауреат
- 4. Академик Баев Александр Александрович. (Лауреат Государственной премии 1969 г)
- 5. Академик Спирин Александр Сергеевич (лауреат Ленинской премии
- 6. Роль белков в организмеСтруктурнаяКаталитическая ТранспортнаяРегуляторнаяЗащитнаяГомеостатическаяДепонирующая Функциональная
- 7. Динамика обновления белковЗа сутки распадается белков ~
- 8. Содержание белка в некоторых продуктахНазвание
- 9. Биологическая ценность аминокислот
- 10. примеры продуктов, содержащие неполноценные белкиназвание продукта1. белки
- 11. Переваривание белков в желудочно-кишечном тракте
- 12. Слизистая оболочка желудка
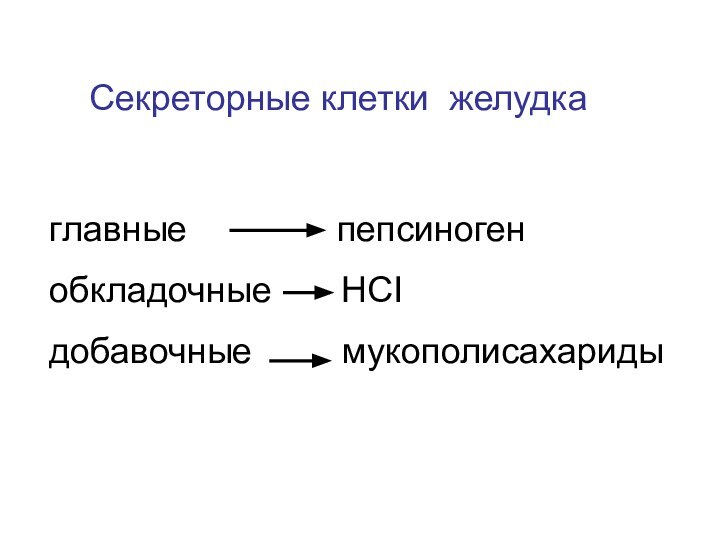
- 13. Секреторные клетки желудкаглавные
- 14. Состав желудочного сокаВода
- 15. Роль НСI в переваривании белков Создает оптимум
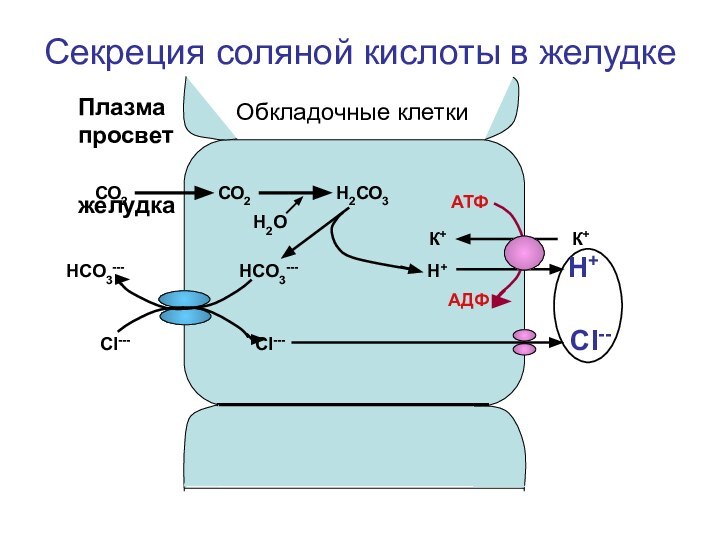
- 16. Секреция соляной кислоты в желудкеОбкладочные клеткиСО2
- 17. Медицинские названия нарушений кислотности желудочного сокаПовышенная кислотность
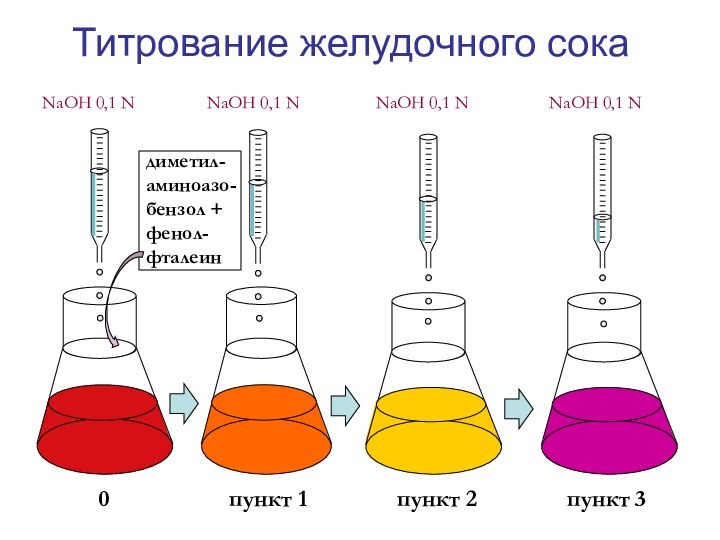
- 18. Титрование желудочного сока NaOH 0,1 N
- 19. Расчет результатов титрованияПункт 1. нейтрализация свободной НСI.
- 20. Показатели кислотности желудочного сока в норме
- 21. Показатели кислотности желудочного сока в норме
- 22. 1 2
- 24. Защита эпителиальных клеток полисахаридным слоем Слизистая оболочка стенки желудка
- 25. Дефект слизистой оболочки при язвенной болезни желудка
- 26. Протеолитические проферменты и ферменты, образующиеся в поджелудочной
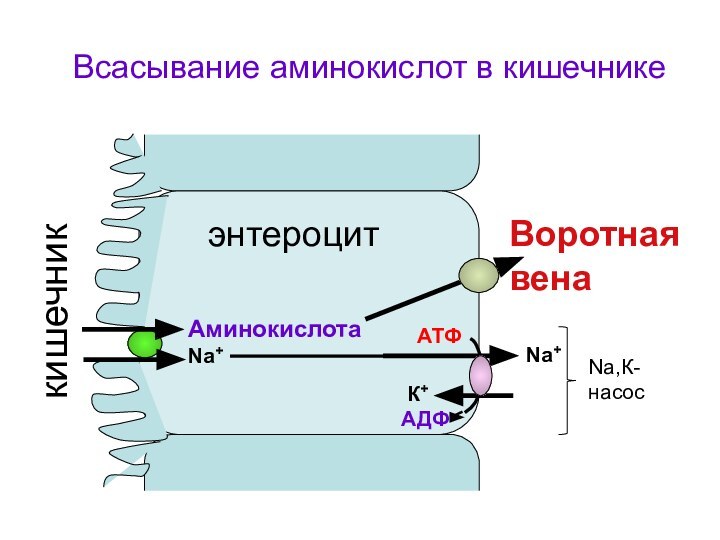
- 29. Аминокислота Na+ Nа+К+АТФАДФВоротная венакишечникВсасывание аминокислот в кишечникеNa,К-насосэнтероцит
- 30. Образование токсичных веществ из аминокислот в кишечнике под влиянием бактерий
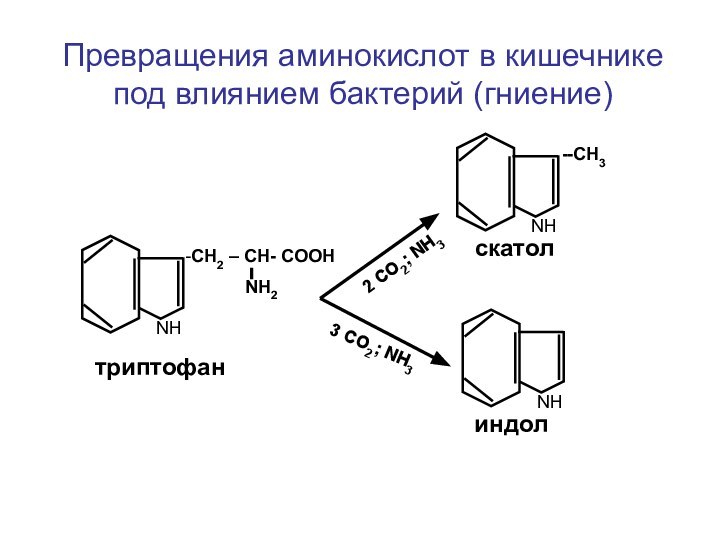
- 31. Превращения аминокислот в кишечнике под влиянием бактерий
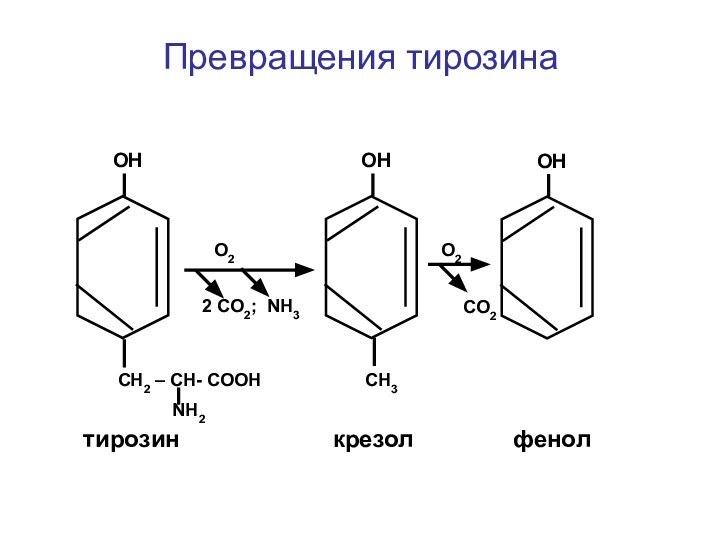
- 32. Превращения тирозинаОН СН2 – СН- СООН
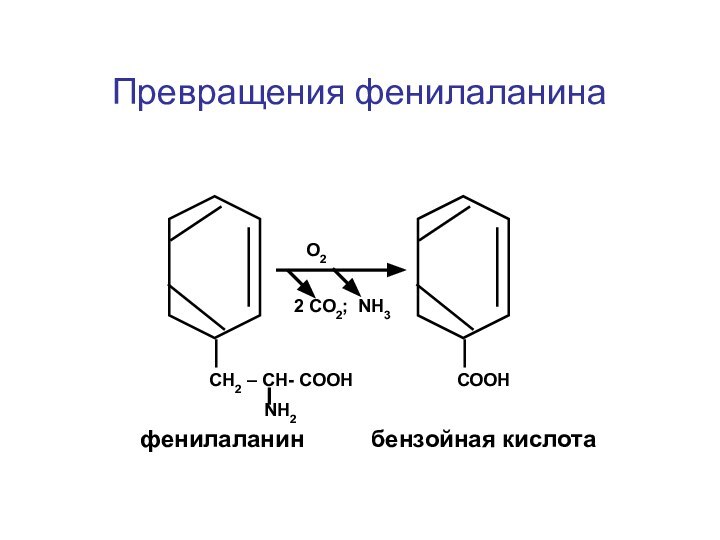
- 33. Превращения фенилаланина СН2 – СН- СООН
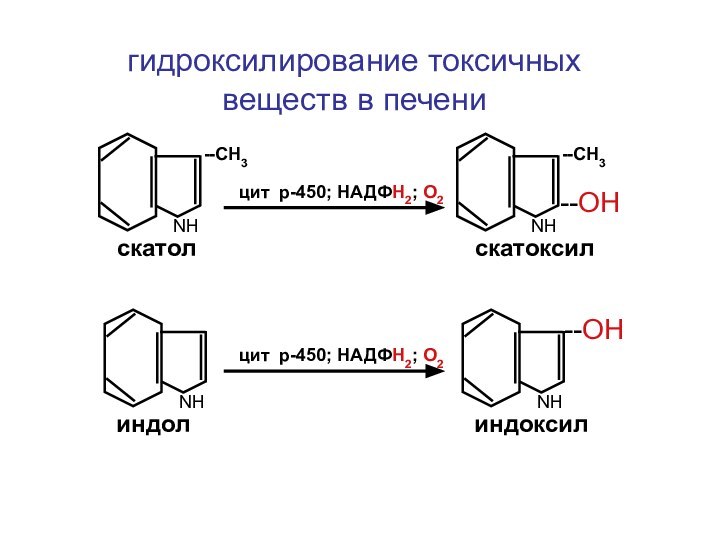
- 34. NНNН--СН3скатолиндолNНNН--СН3скатоксилиндоксил--ОН--ОН цит р-450; НАДФН2; О2 цит р-450; НАДФН2; О2гидроксилирование токсичных веществ в печени
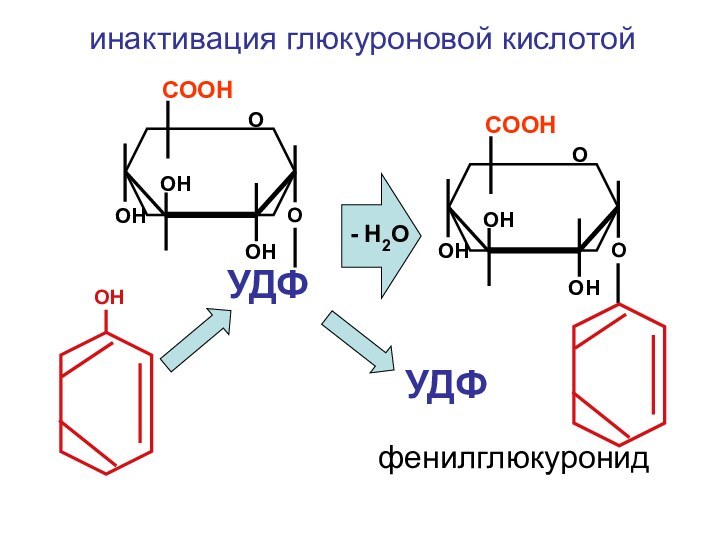
- 35. ОСООНОН ОНОН УДФООНОСООНОН ОНОНОинактивация глюкуроновой кислотойфенилглюкуронид- Н2О УДФ
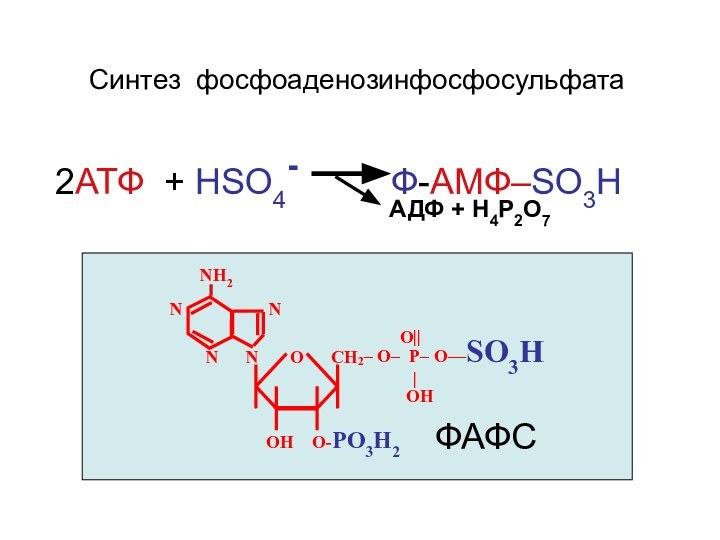
- 36. Синтез фосфоаденозинфосфосульфата2АТФ + НSO4-
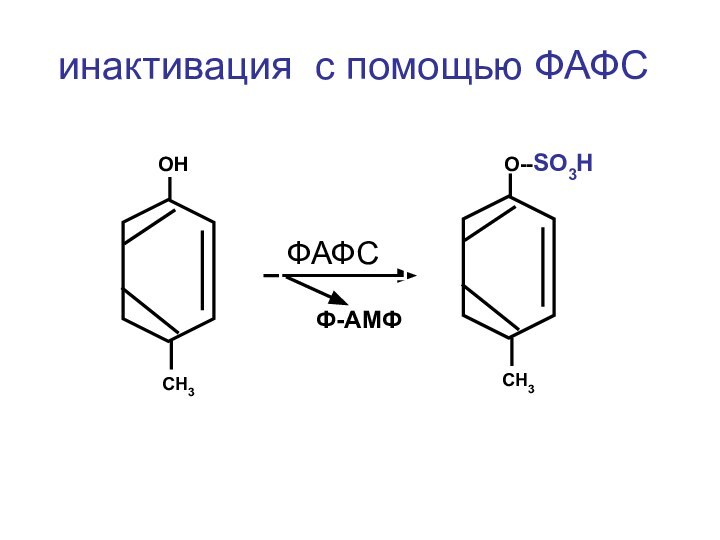
- 37. инактивация с помощью ФАФСОН СН3 О--SO3H СН3ФАФСФ-АМФ
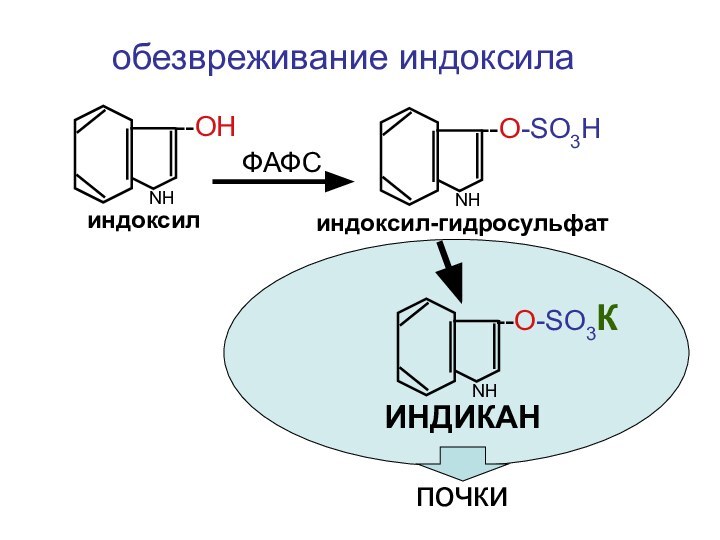
- 38. NНиндоксил--ОНNНиндоксил-гидросульфат--О-SO3HФАФСNН--О-SO3КИНДИКАНобезвреживание индоксилапочки
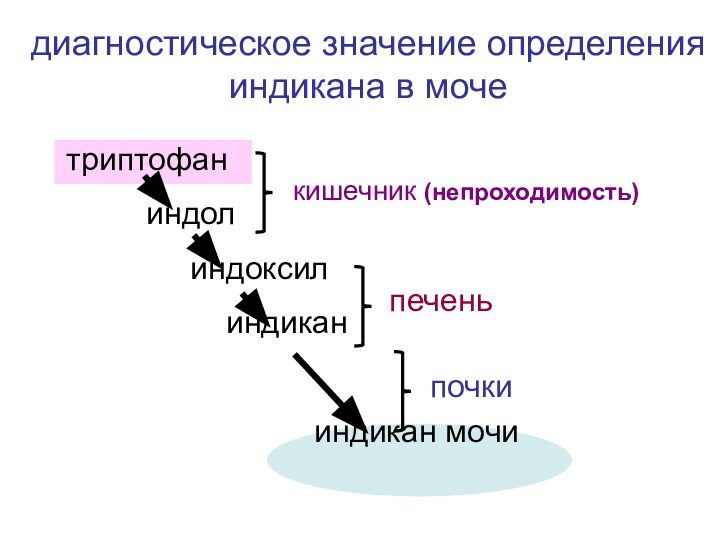
- 39. триптофан индол
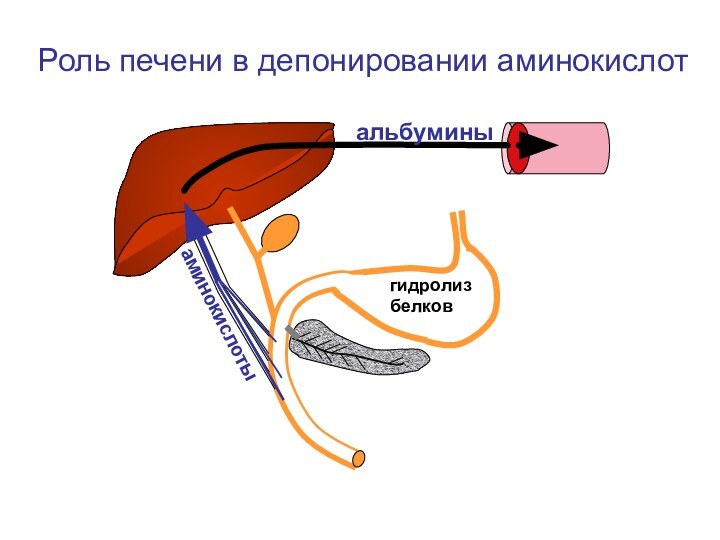
- 40. аминокислотыальбуминыРоль печени в депонировании аминокислотгидролиз белков
- 41. Роль альбуминаЗапасной источник аминокислотКомпонент буферной системыОсмотически активный
- 42. Какому больному можно сделать операцию?Больной № 1Общий
- 43. В аппарат ГольджиМногие белки требуют достраивания.
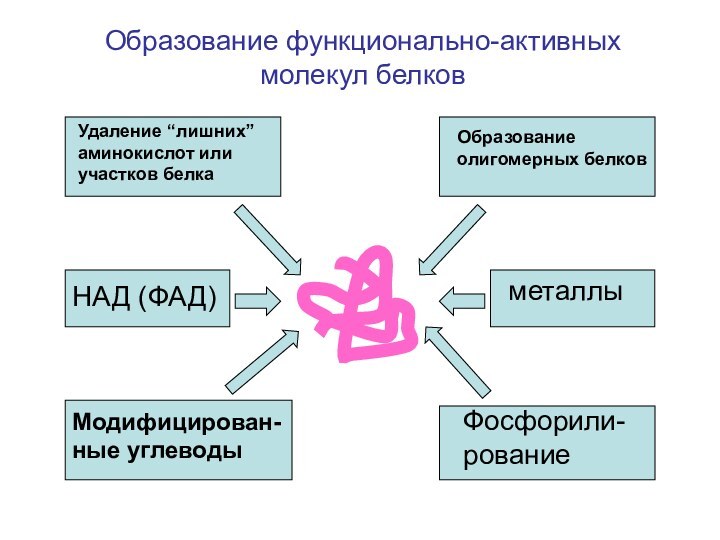
- 44. НАД (ФАД)Модифицирован-ные углеводыметаллыФосфорили-рованиеУдаление “лишних” аминокислот или участков белкаОбразование олигомерных белковОбразование функционально-активных молекул белков
- 45. Присоединение к растущей белковой молекуле углеводных структур
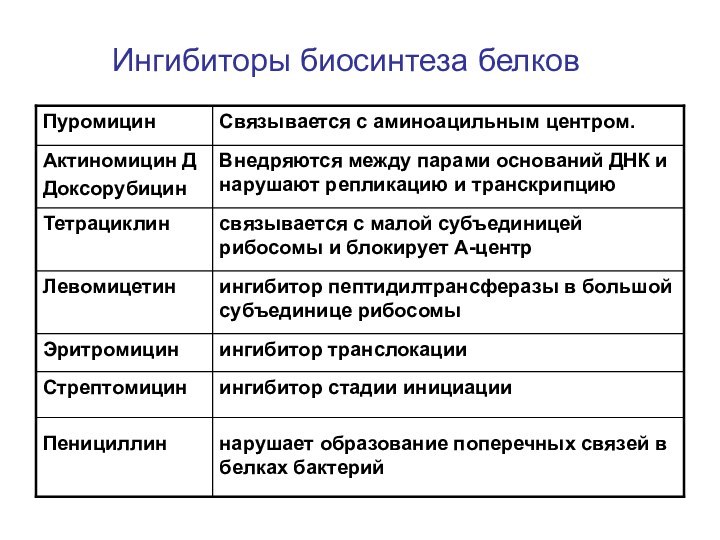
- 46. Ингибиторы биосинтеза белков
- 47. Пути превращений аминокислот в клеткеРеакции поликонденсацииРеакции трансаминированияРеакции декарбоксилированияРеакции окислительного дезаминирования
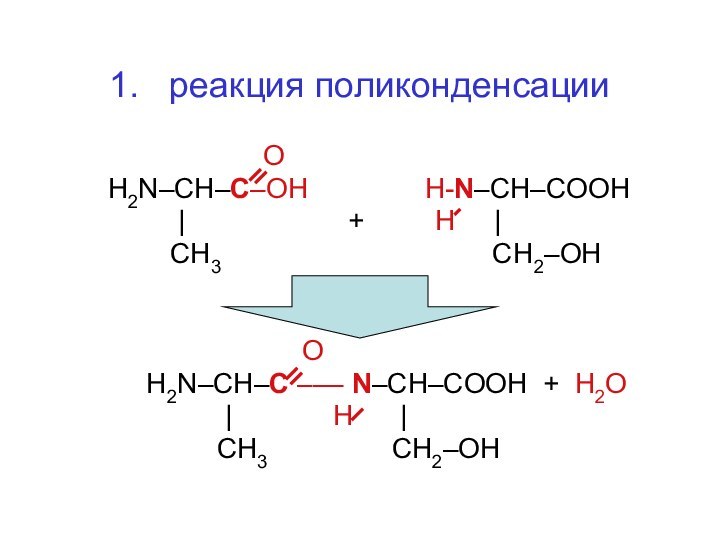
- 48. 1. реакция поликонденсации
- 49. СН3 СООН
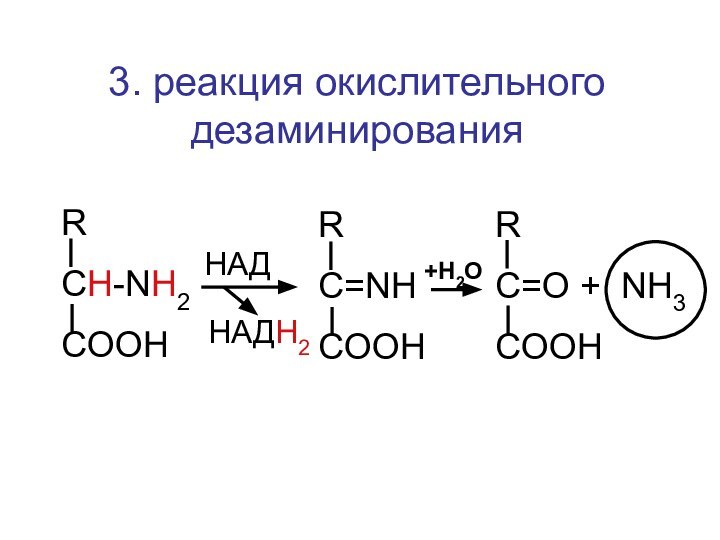
- 50. 3. реакция окислительного дезаминированияRCH-NH2COOHRC=NHCOOHRC=O + NH3COOHHАДHАДН2+Н2О
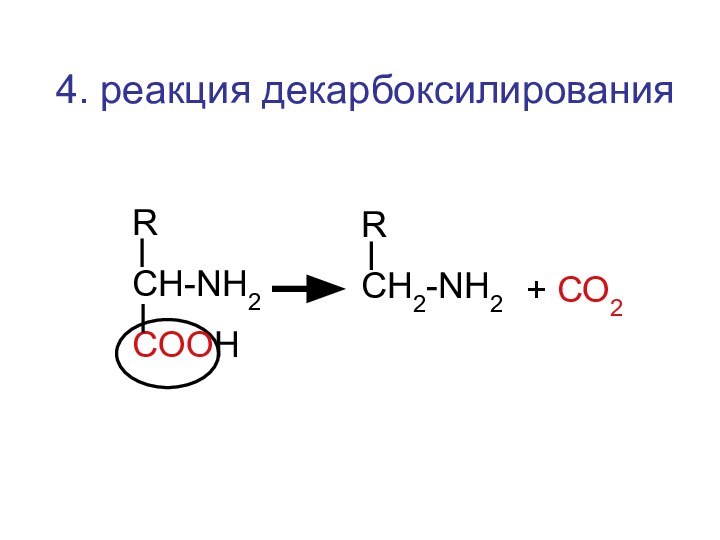
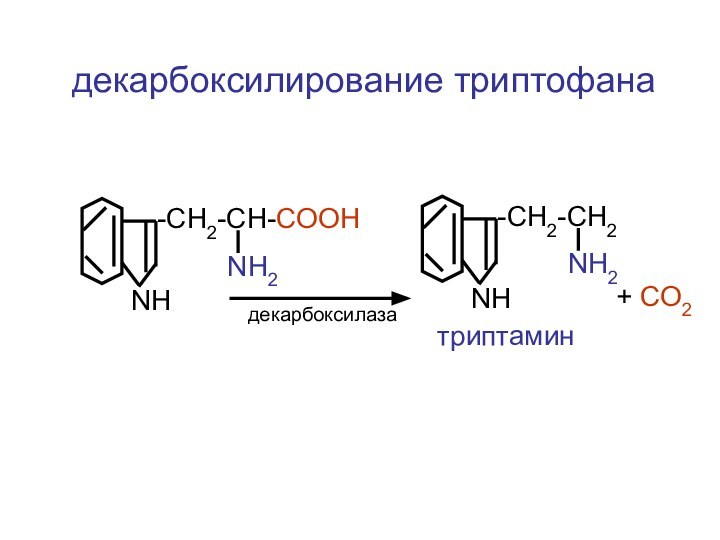
- 51. 4. реакция декарбоксилированияRCH-NH2COOHRCН2-NH2+ СО2
- 52. Биосинтез белка в клетке
- 53. Перечень веществ, необходимых для синтеза белкаи-РНК (зрелая)т-РНК ( 61)20 аминокислотАТФ, ГТФФерментыНебелковые компоненты Рибосомы
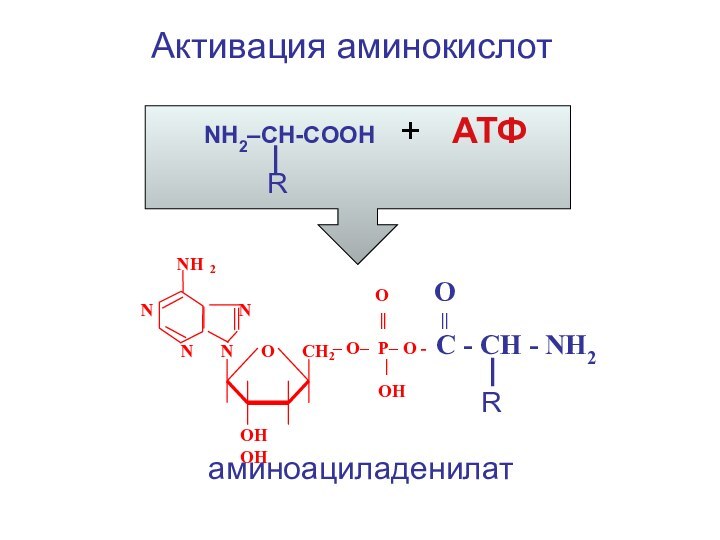
- 54. Активация аминокислот NH2–CH-COOH +
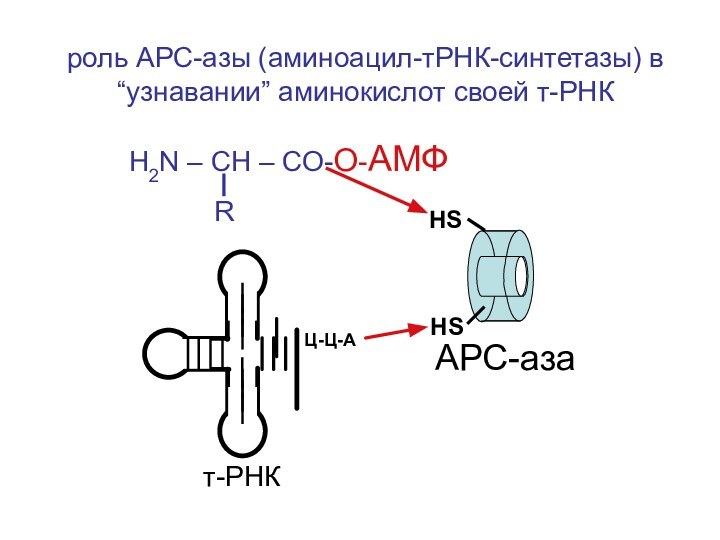
- 55. роль АРС-азы (аминоацил-тРНК-синтетазы) в “узнавании” аминокислот своей
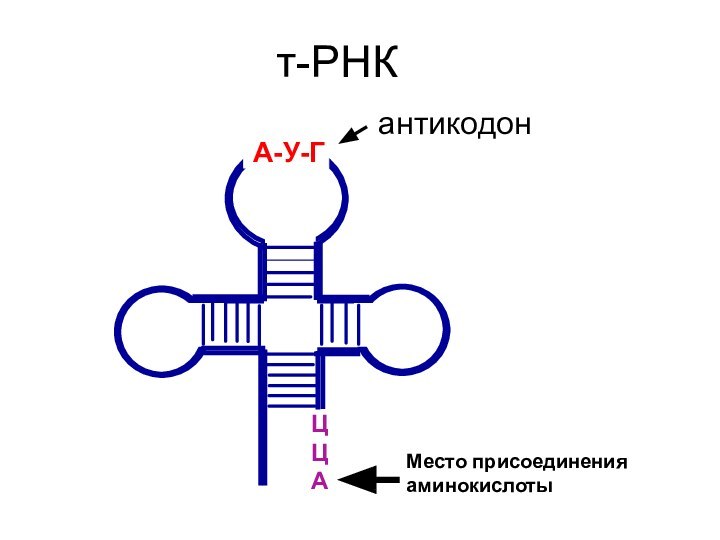
- 56. Ц ЦАт-РНКА-У-ГантикодонМесто присоединения аминокислоты
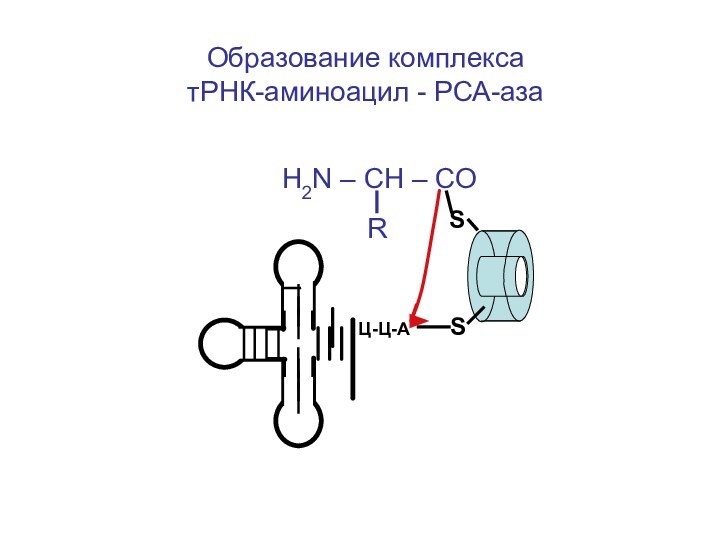
- 57. Образование комплекса
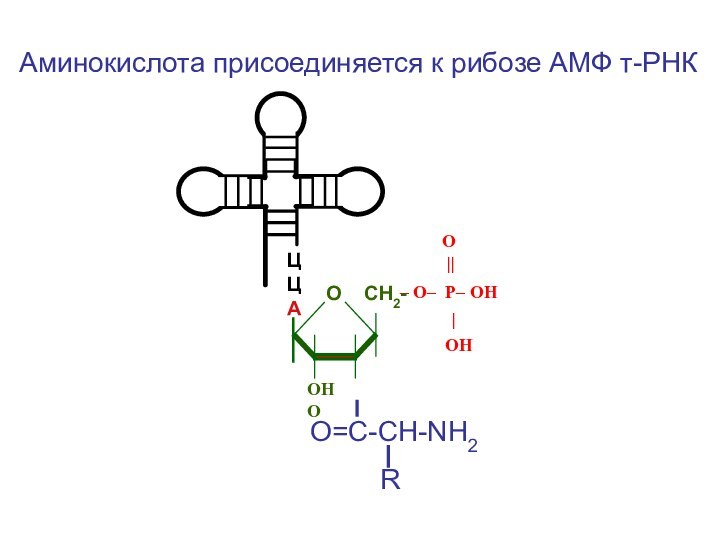
- 58. ЦЦА O
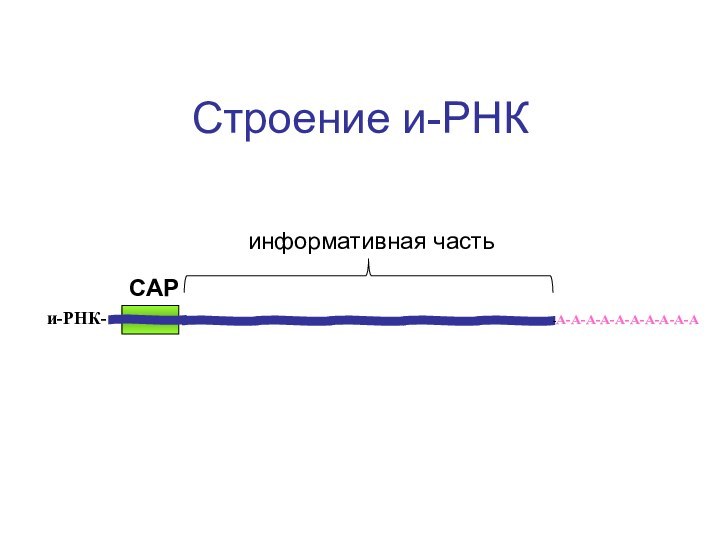
- 59. Строение и-РНК-А-А-А-А-А-А-А-А-А-Аи-РНК-САРинформативная часть
- 60. Стадии синтеза белкаобразование
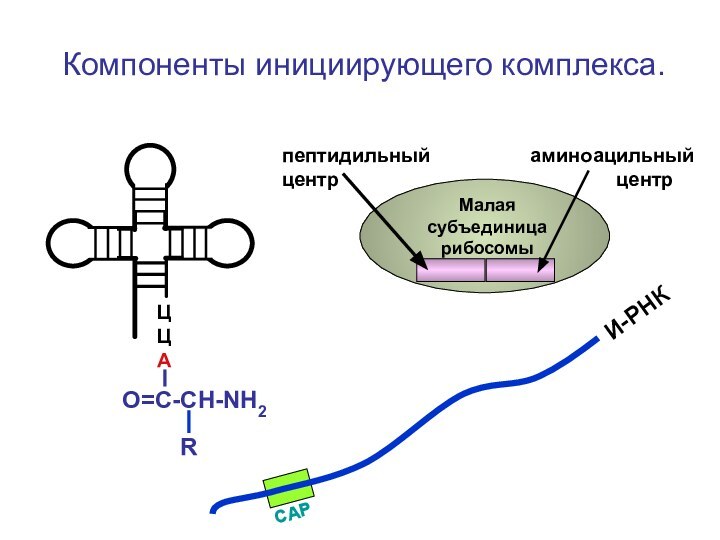
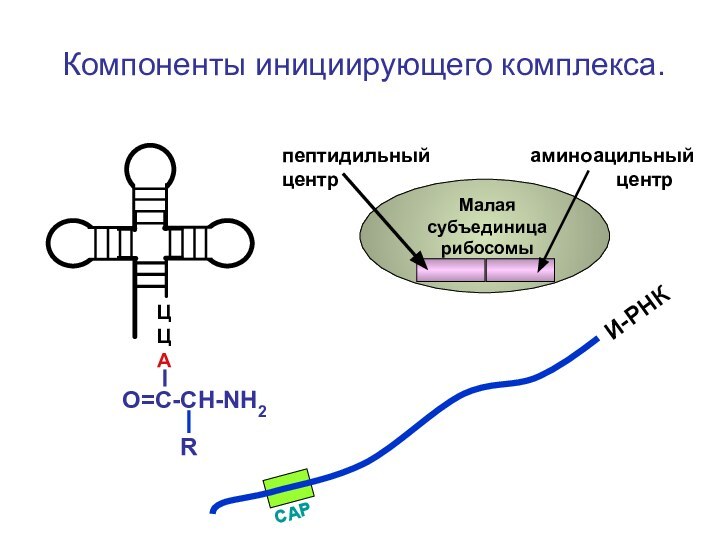
- 61. Компоненты инициирующего комплекса. ЦЦА
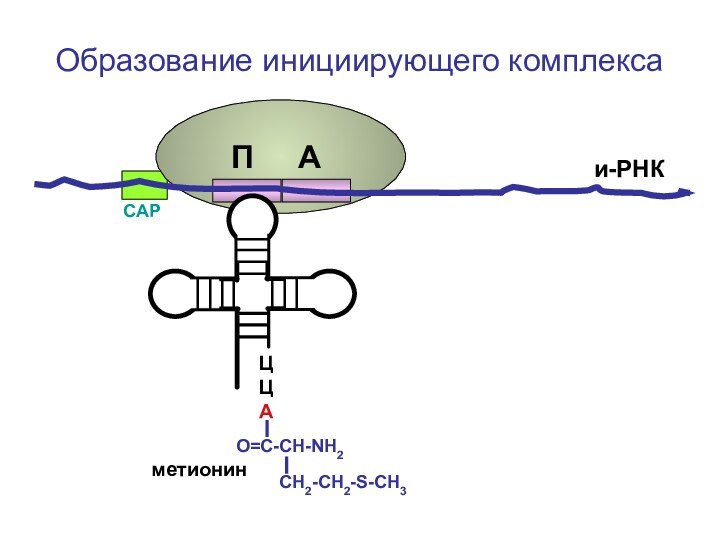
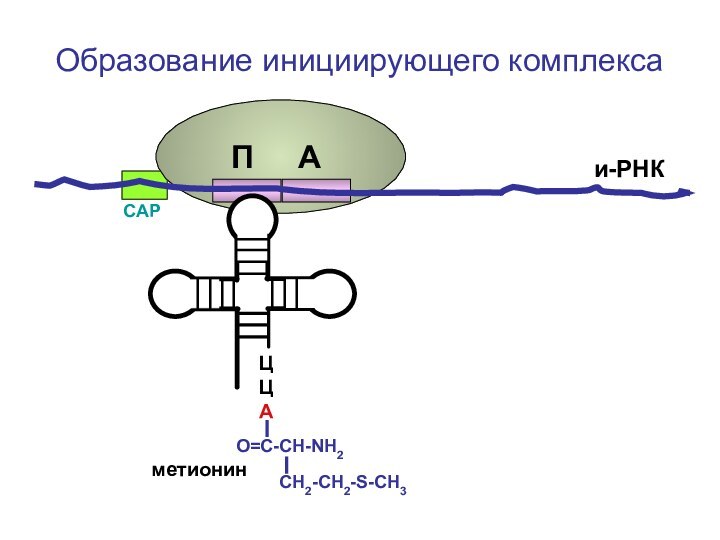
- 62. ЦЦА О=С-СН-NH2 СН2-СН2-S-CH3Образование инициирующего комплексаметионини-РНКСAPП А
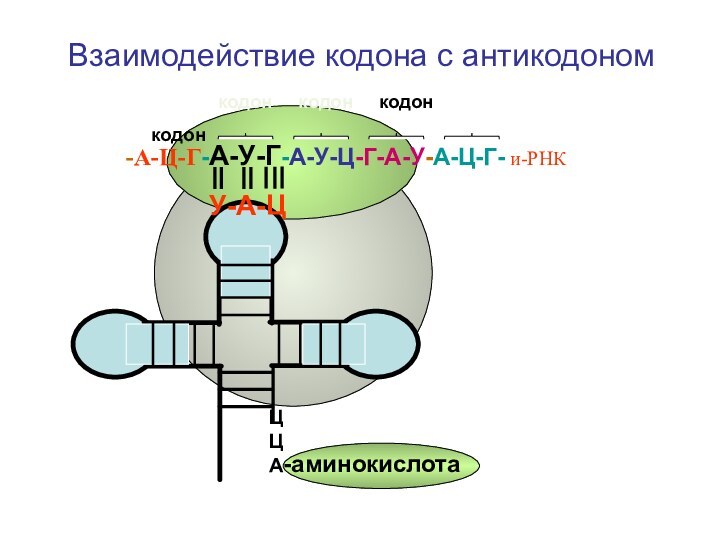
- 63. Взаимодействие кодона с антикодоном кодон
- 64. Биосинтез белка
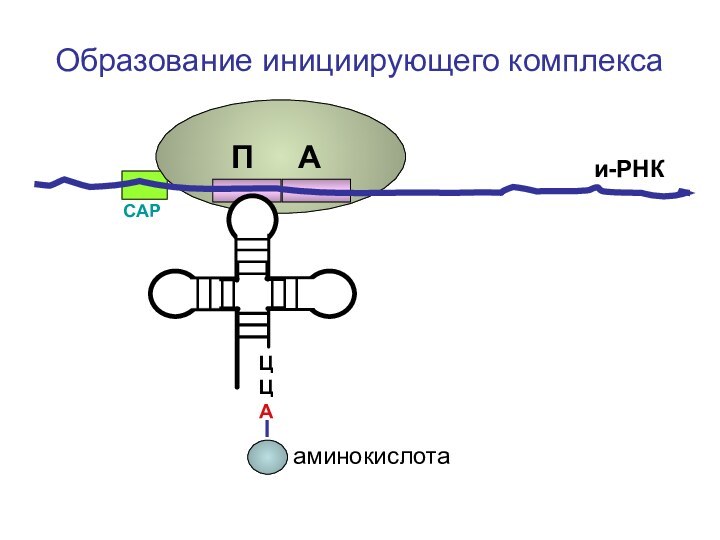
- 65. ЦЦА Образование инициирующего комплексаи-РНКСAPП Ааминокислота
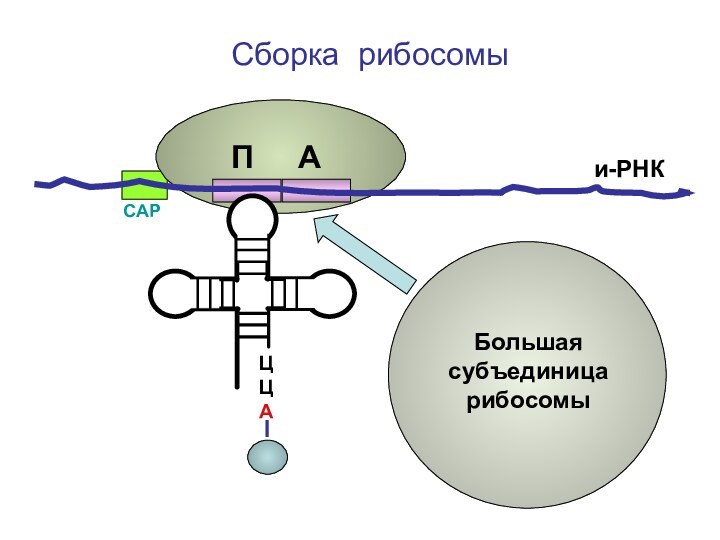
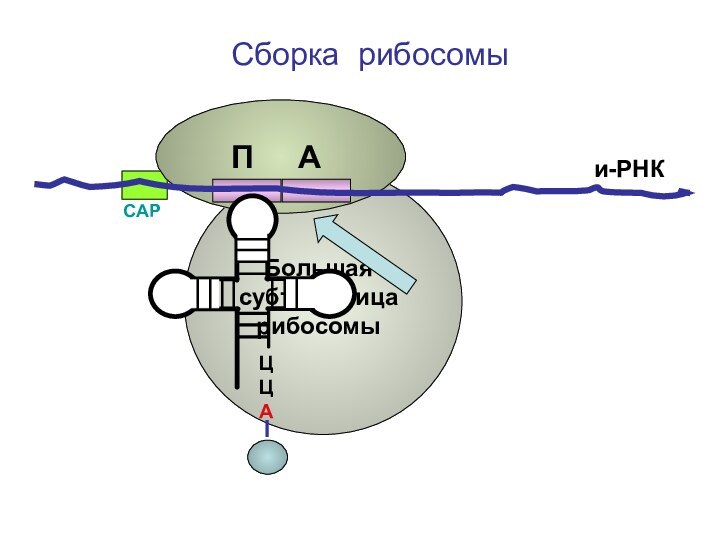
- 66. ЦЦА Сборка рибосомыи-РНКСAPБольшая субъединица рибосомыП А
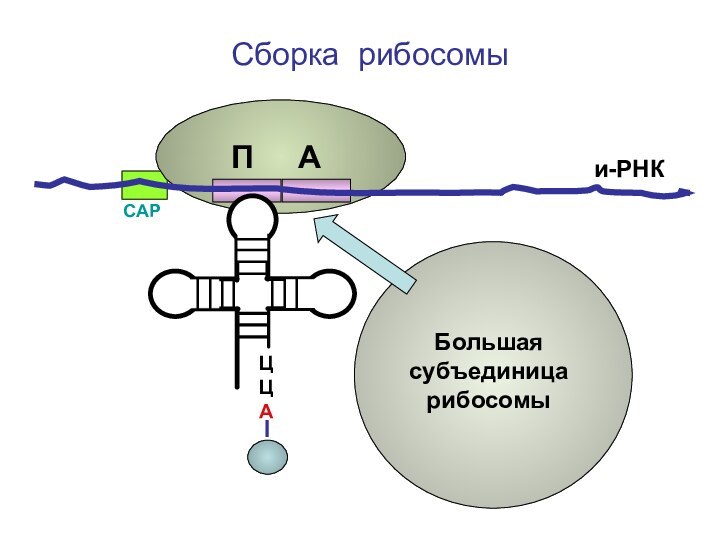
- 67. ЦЦА Сборка рибосомыи-РНКСAPП А
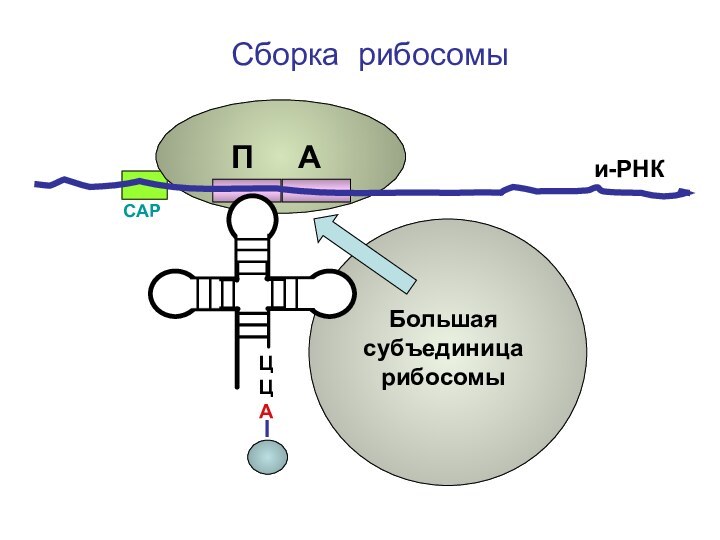
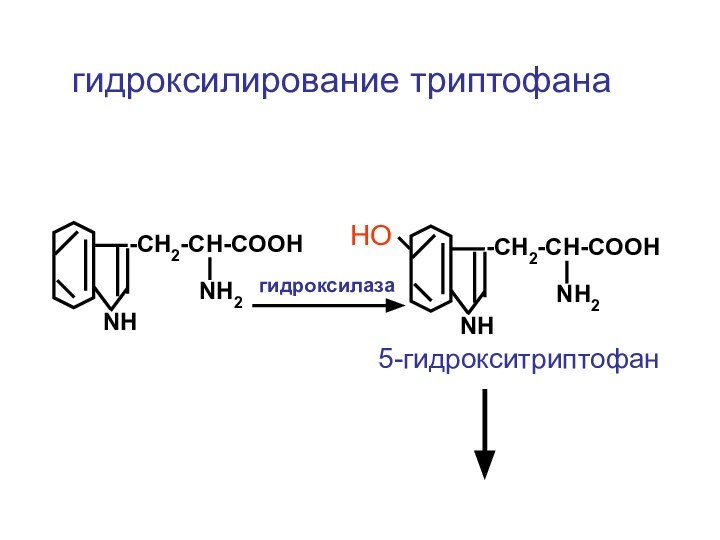
- 68. ЦЦА Сборка рибосомыи-РНКСAPП А
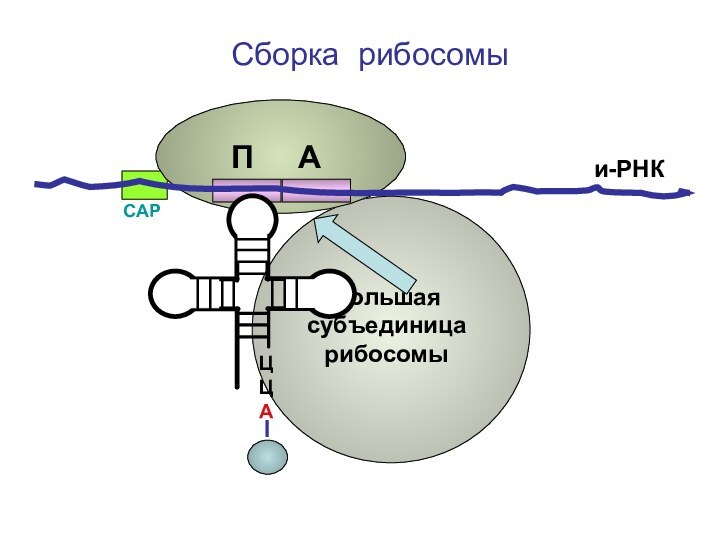
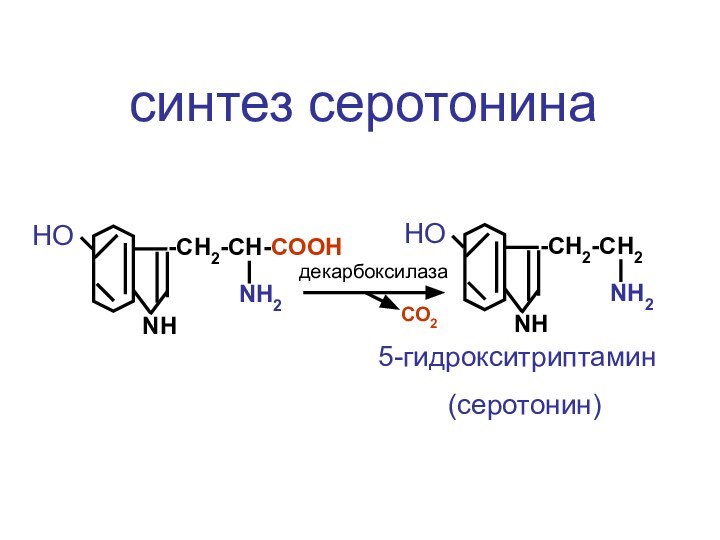
- 69. ЦЦА Сборка рибосомыи-РНКСAPП А
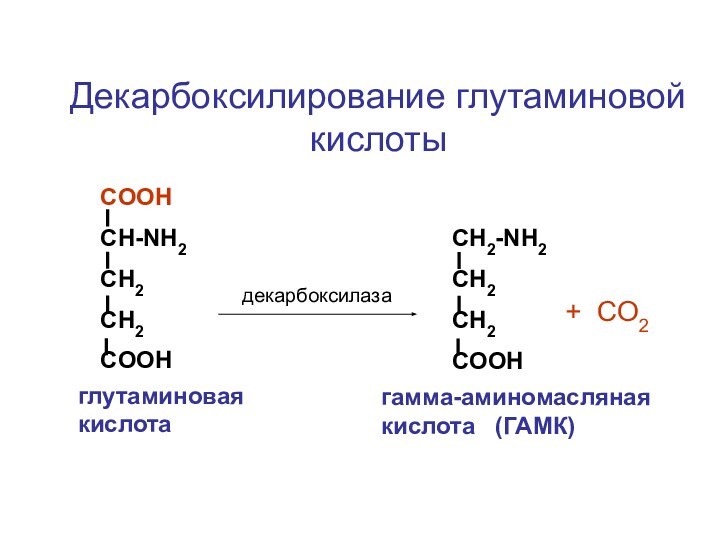
- 70. ЦЦА Сборка рибосомыи-РНКСAPП А
- 71. ЦЦА ЦЦА
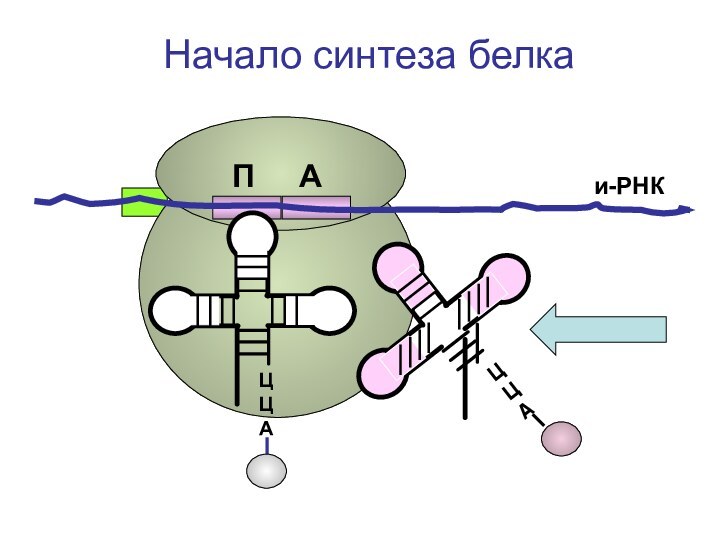
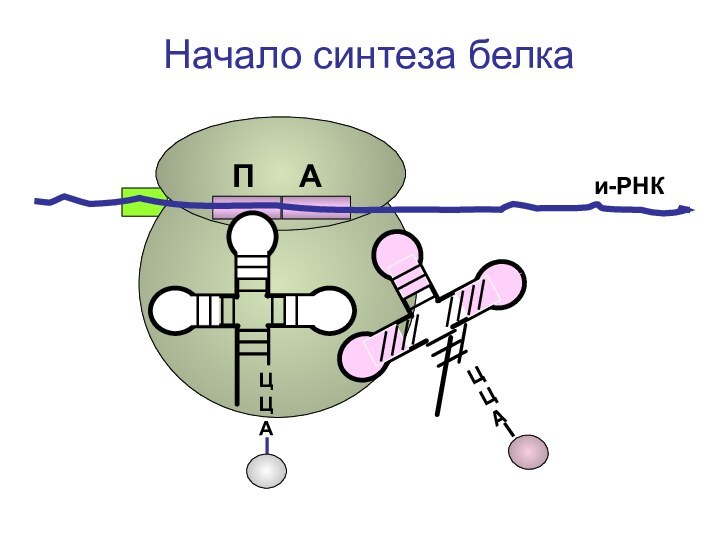
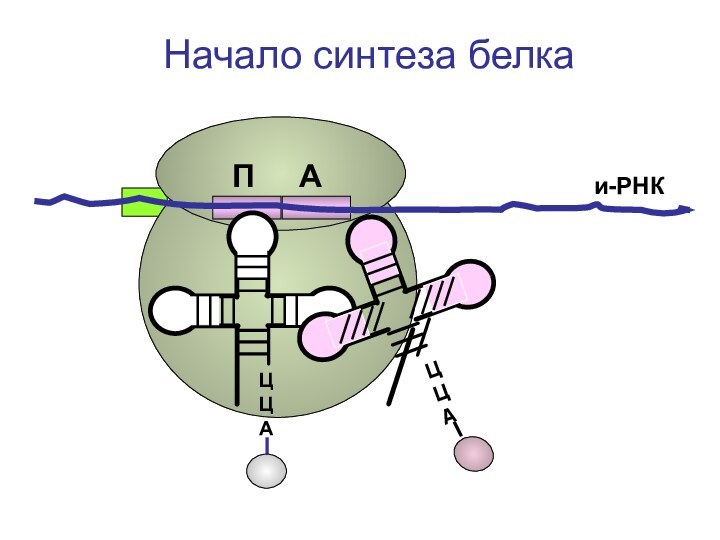
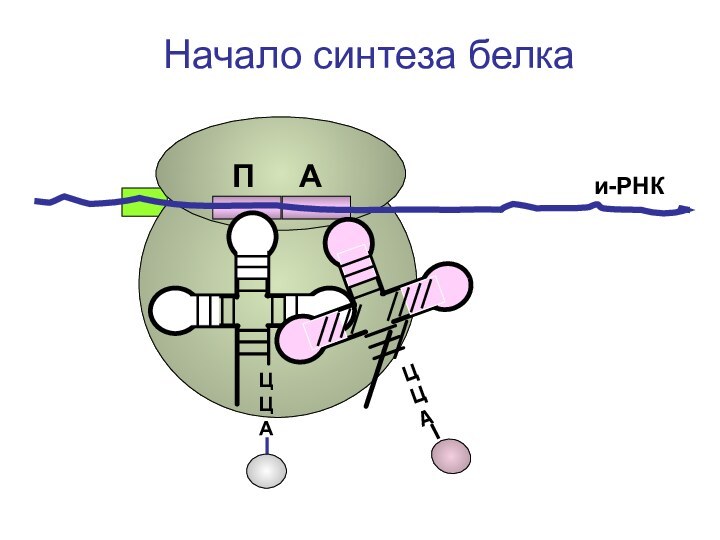
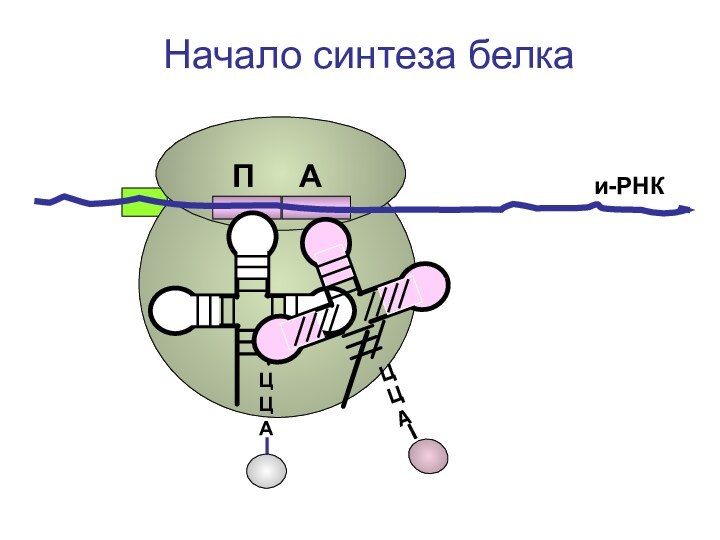
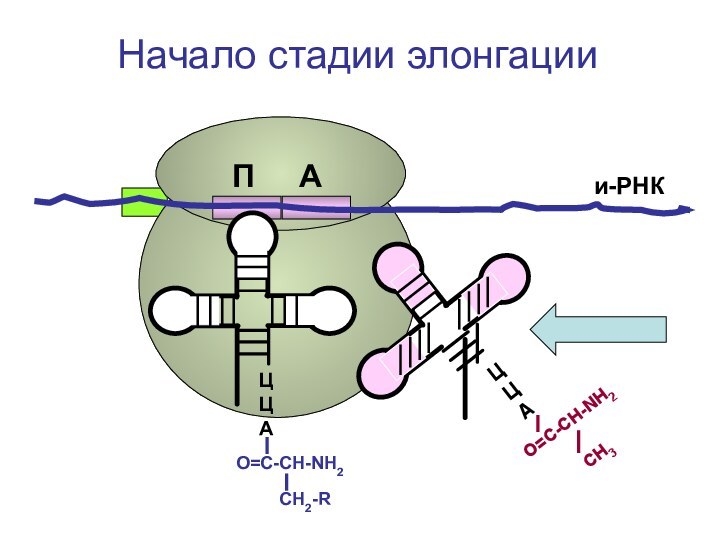
- 72. ЦЦА и-РНКНачало синтеза белкаП А
- 73. ЦЦА и-РНКНачало синтеза белкаП А
- 74. ЦЦА и-РНКНачало синтеза белкаП А
- 75. ЦЦА и-РНКНачало синтеза белкаП А
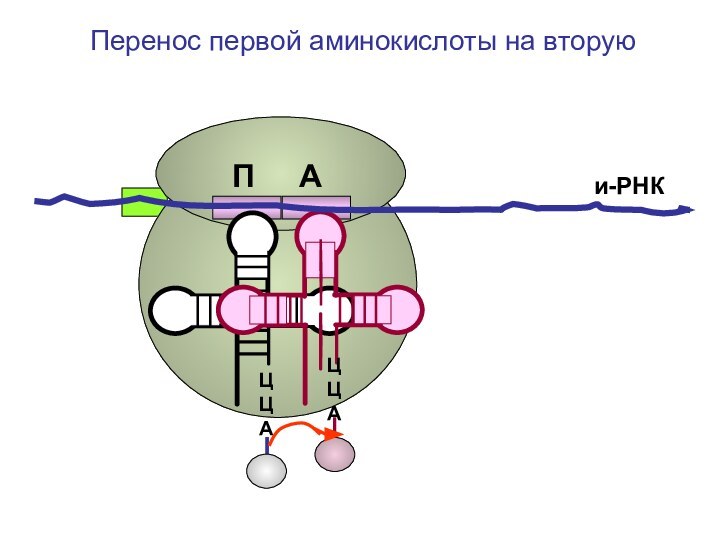
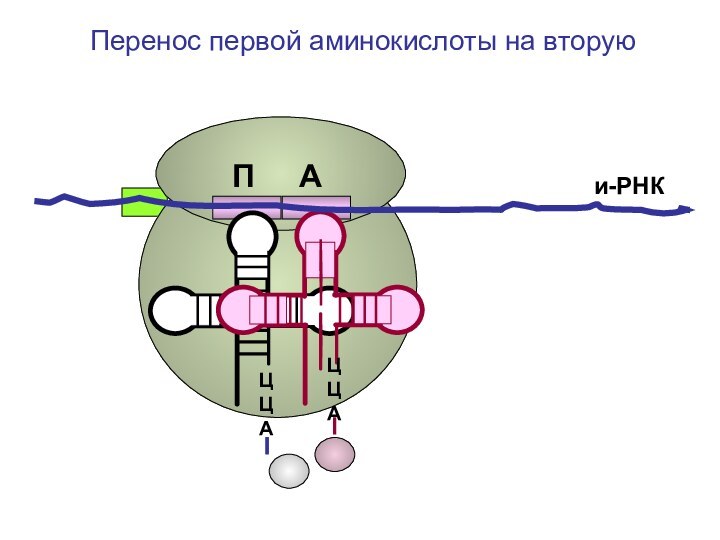
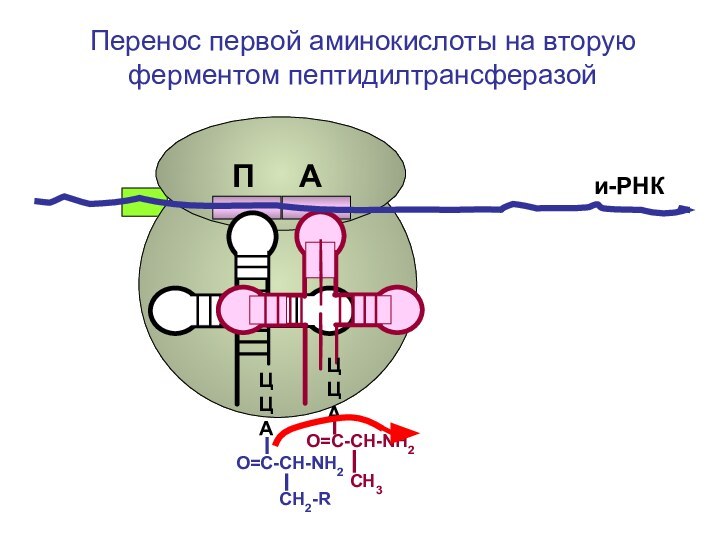
- 76. ЦЦА ЦЦА и-РНКПеренос первой аминокислоты на вторуюП А
- 77. ЦЦА ЦЦА и-РНКПеренос первой аминокислоты на вторуюП А
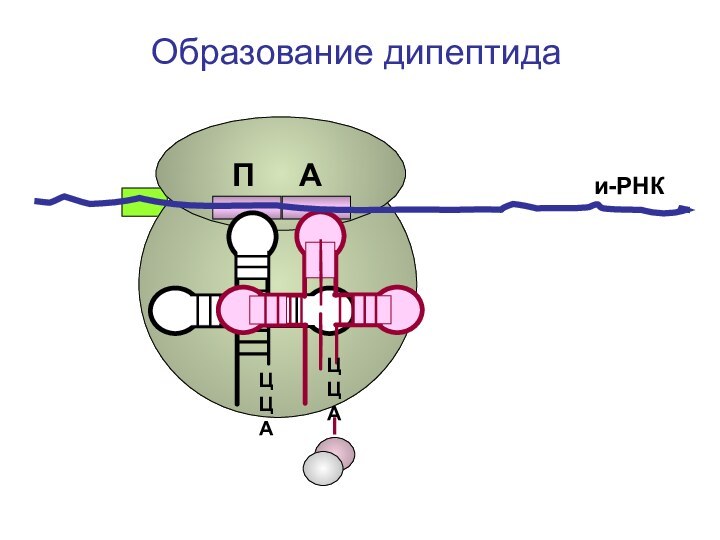
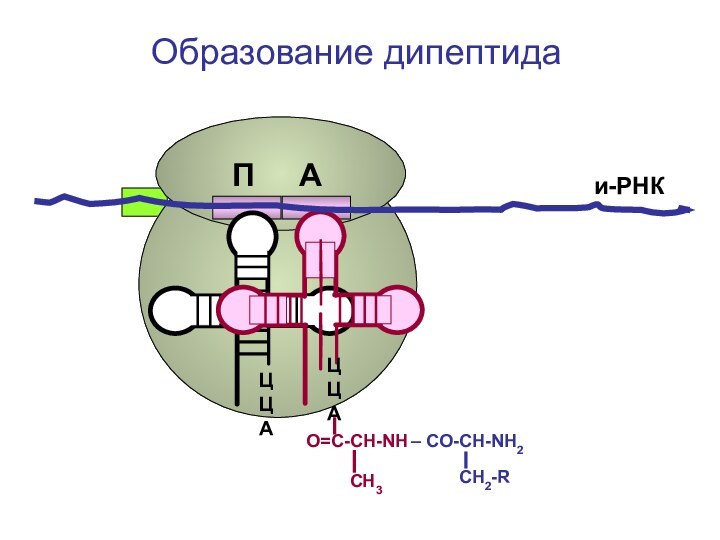
- 78. ЦЦА ЦЦА и-РНКОбразование дипептида П А
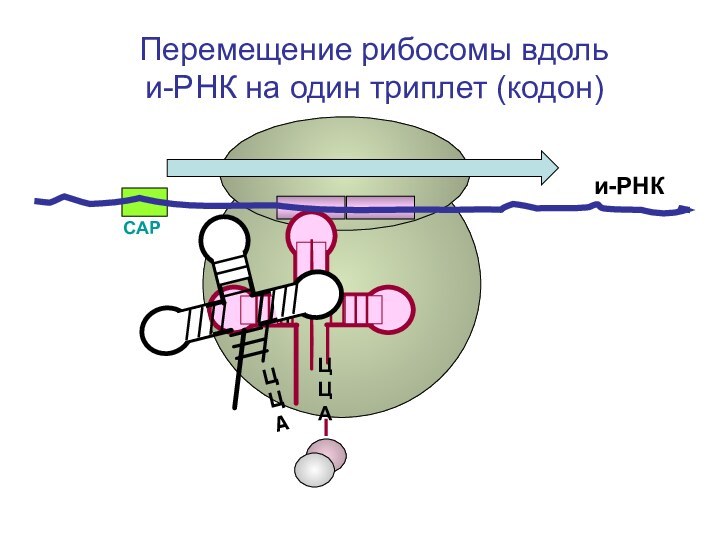
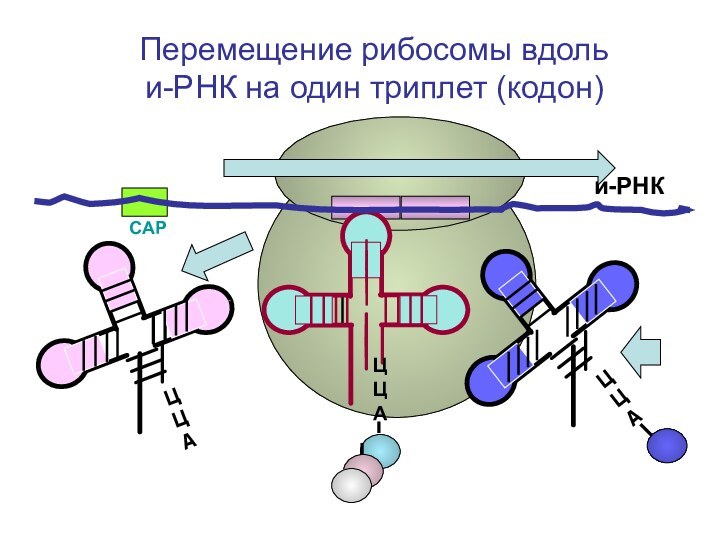
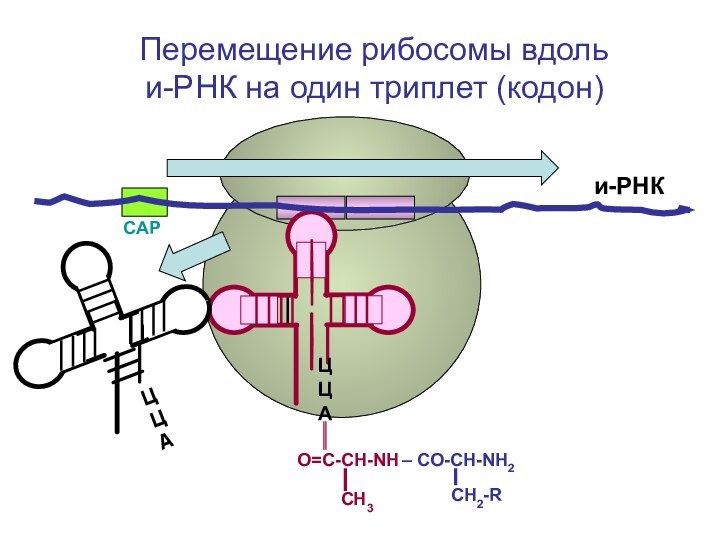
- 79. СAPи-РНКЦЦА Перемещение рибосомы вдоль и-РНК на один триплет (кодон)
- 80. СAPи-РНКЦЦА Перемещение рибосомы вдоль и-РНК на один триплет (кодон)
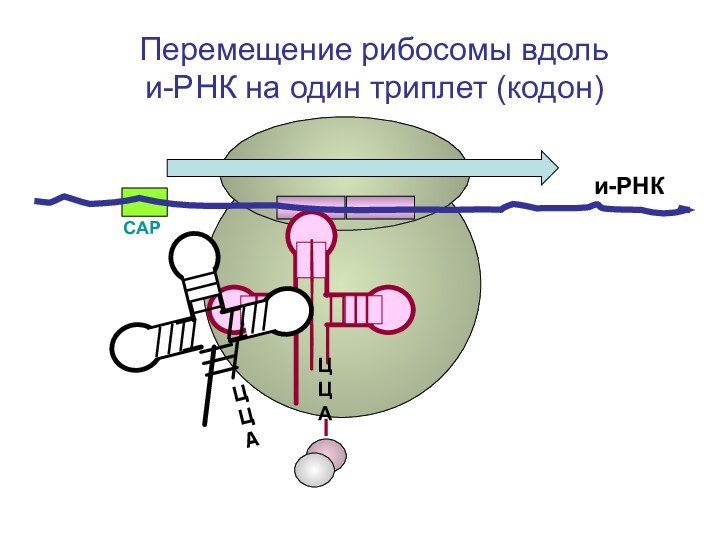
- 81. СAPи-РНКЦЦА Перемещение рибосомы вдоль
- 82. и-РНКЦЦАЦЦА
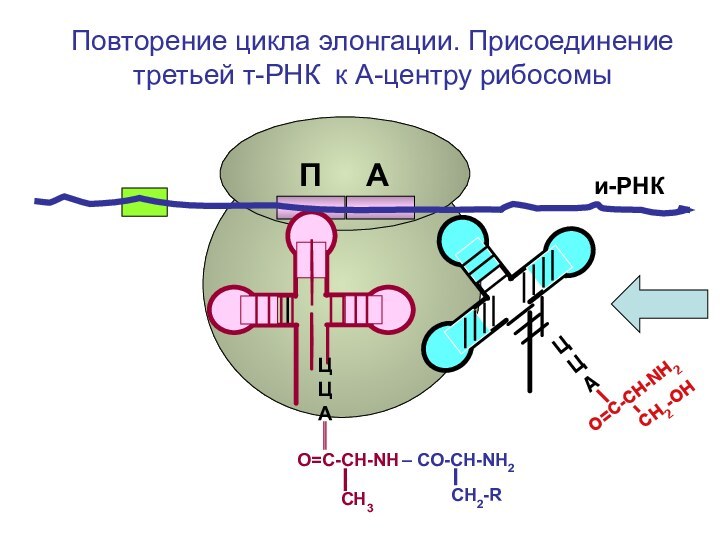
- 83. и-РНКЦЦАПовторение цикла элонгации. Присоединение третьей т-РНКП А
- 84. и-РНКЦЦАПовторение цикла элонгации. Присоединение третьей т-РНКП А
- 85. и-РНКЦЦАПовторение цикла элонгации. Присоединение третьей т-РНКП А
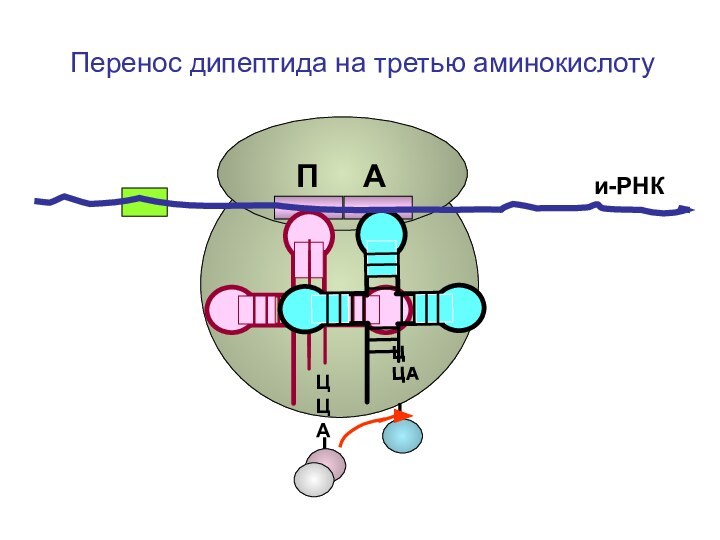
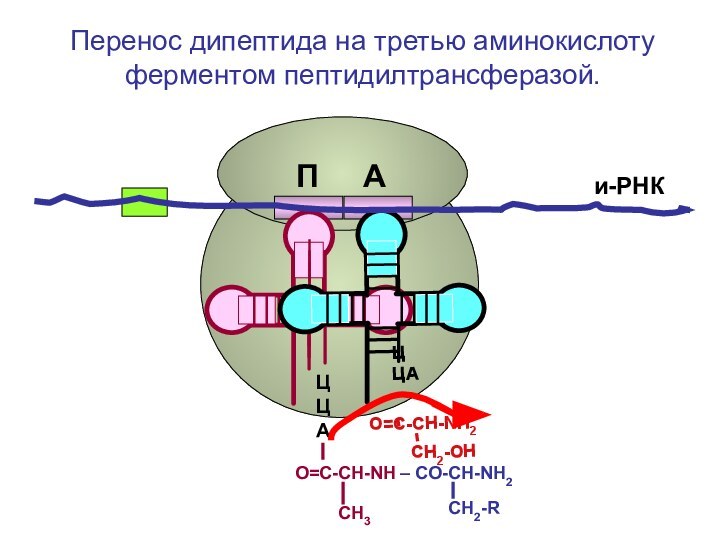
- 86. ЦЦА ЦЦА и-РНКП АПеренос дипептида на третью аминокислоту
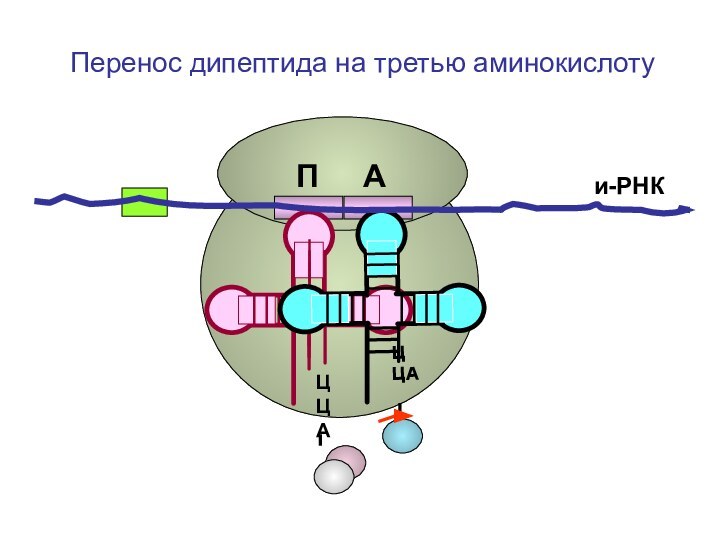
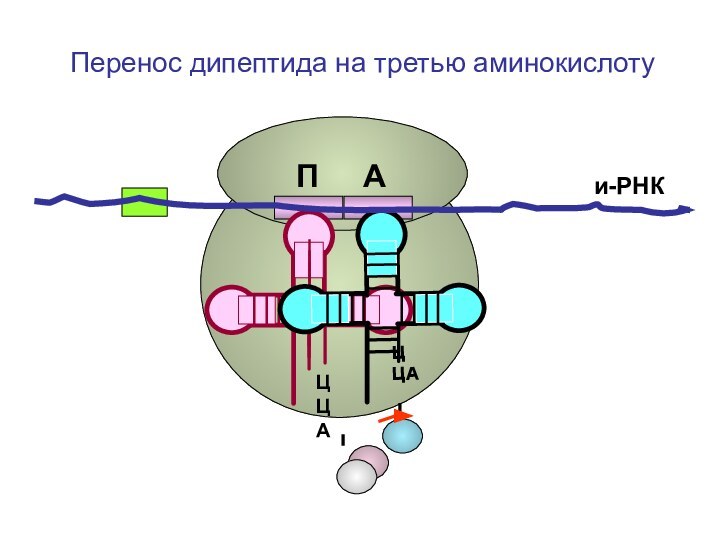
- 87. ЦЦА ЦЦА и-РНКП АПеренос дипептида на третью аминокислоту
- 88. ЦЦА ЦЦА и-РНКП АПеренос дипептида на третью аминокислоту
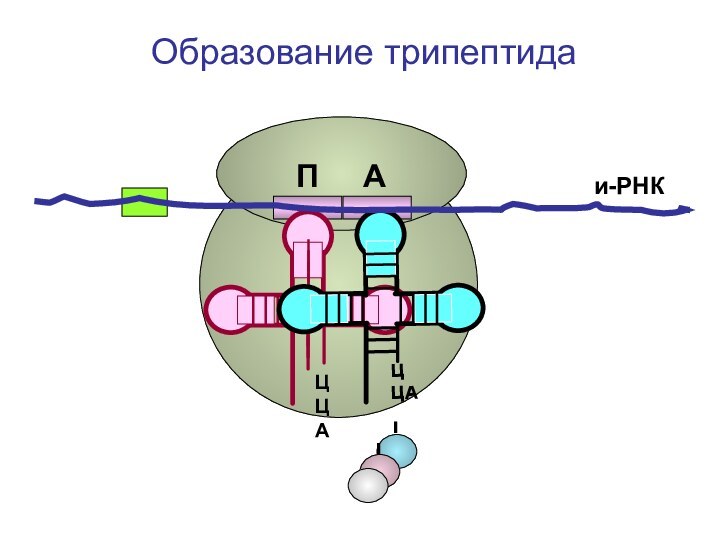
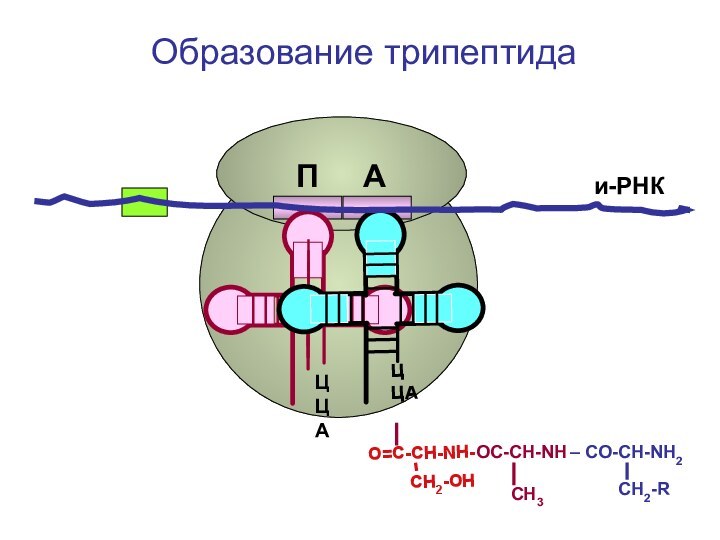
- 89. ЦЦА ЦЦА и-РНКП АОбразование трипептида
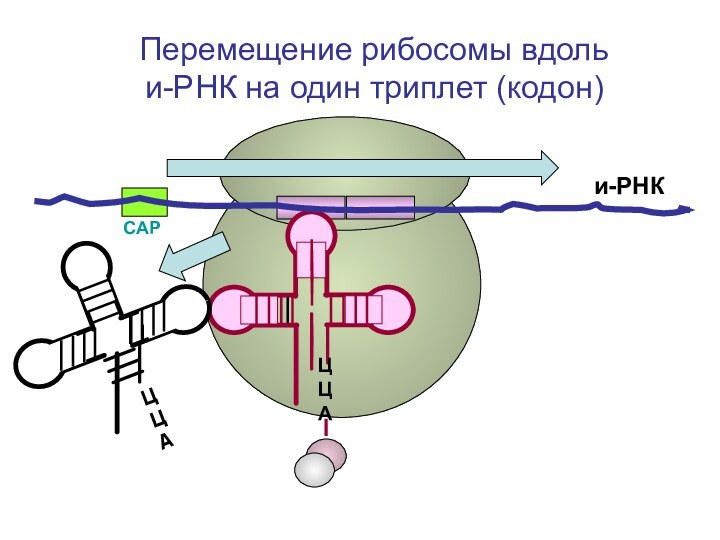
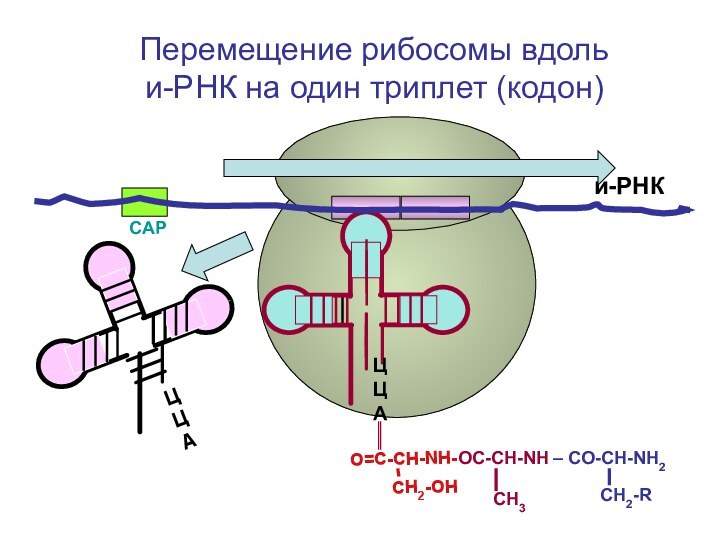
- 90. СAPи-РНКЦЦА Перемещение рибосомы вдоль
- 91. Многократное повторение циклов элонгации, до полного построения белковой молекулы
- 92. Компоненты инициирующего комплекса. ЦЦА
- 93. ЦЦА О=С-СН-NH2 СН2-СН2-S-CH3Образование инициирующего комплексаметионини-РНКСAPП А
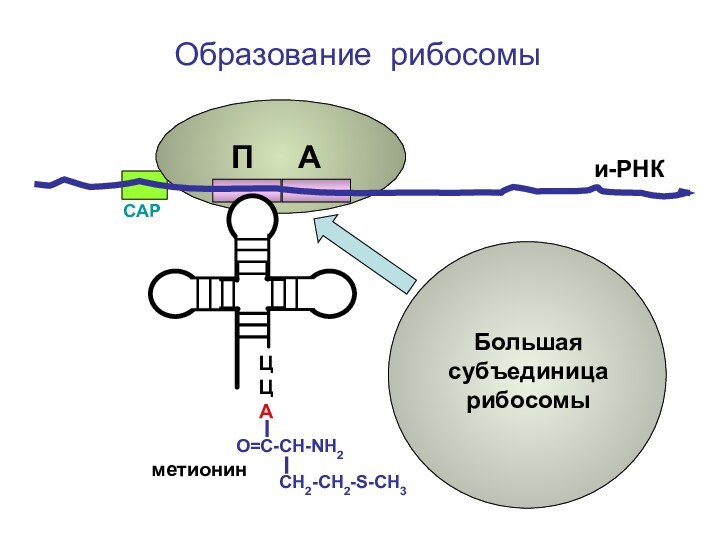
- 94. ЦЦА О=С-СН-NH2 СН2-СН2-S-CH3Образование рибосомыметионини-РНКСAPБольшая субъединица рибосомыП А
- 95. ЦЦА О=С-СН-NH2 СН2-RЦЦА
- 96. ЦЦА О=С-СН-NH2 СН2-RЦЦА
- 97. ЦЦА СН2-RЦЦА
- 98. СAPСН2-Rи-РНКЦЦА О=С-СН-NH – CO-CH-NH2
- 99. СН2-Rи-РНКЦЦА О=С-СН-NH – CO-CH-NH2
- 100. СН2-RЦЦА О=С-СН-NH – CO-CH-NH2 СН3ЦЦА
- 101. СН2-RЦЦА ОС-СН-NH – CO-CH-NH2 СН3ЦЦА
- 102. СAPи-РНКЦЦА Перемещение рибосомы вдоль
- 103. Стадия терминации
- 104. ЦЦА УААА-А-А-А- - Аи-РНКфактор
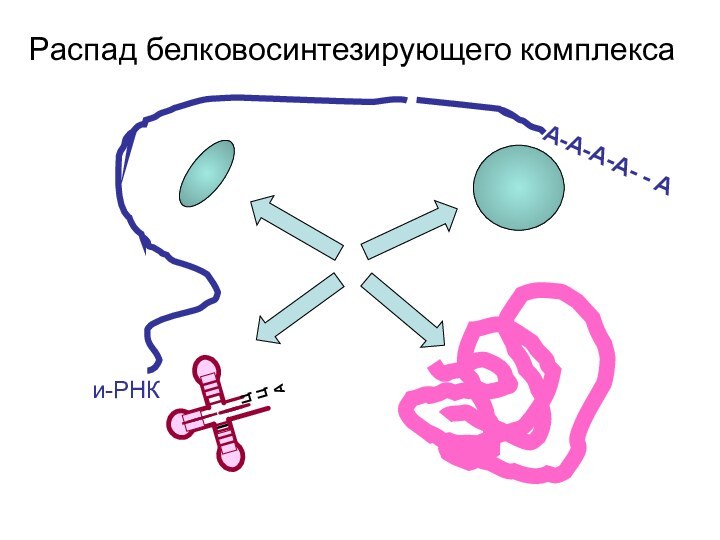
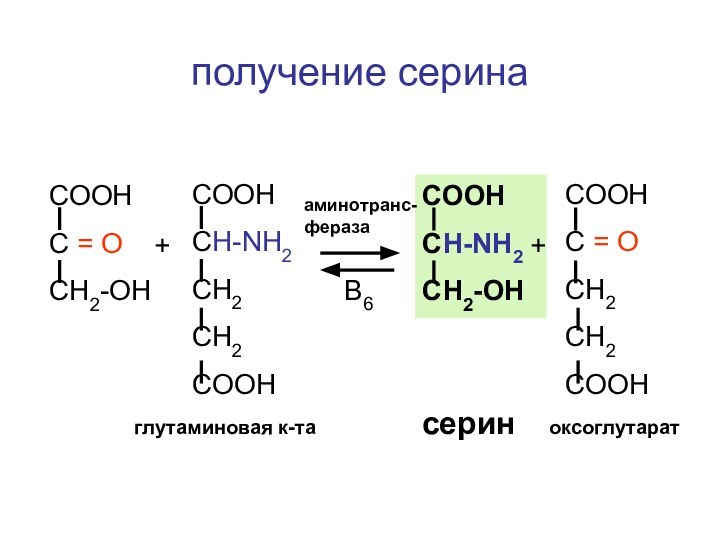
- 105. А-А-А-А- - Аи-РНКРаспад белковосинтезирующего комплекса
- 106. Трансамини-рование аминокислот
- 107. Биологическая ценность аминокислот
- 108. СН3 СООН
- 109. Н О ССН2О-РО3Н2НОН3СN
- 110. Н О ССН2О-РО3Н2НОН3СN
- 111. Дни болезниАктивность ферментов1 2 3
- 112. Декарбоксилирование аминокислот (образование биологически-активных аминов)
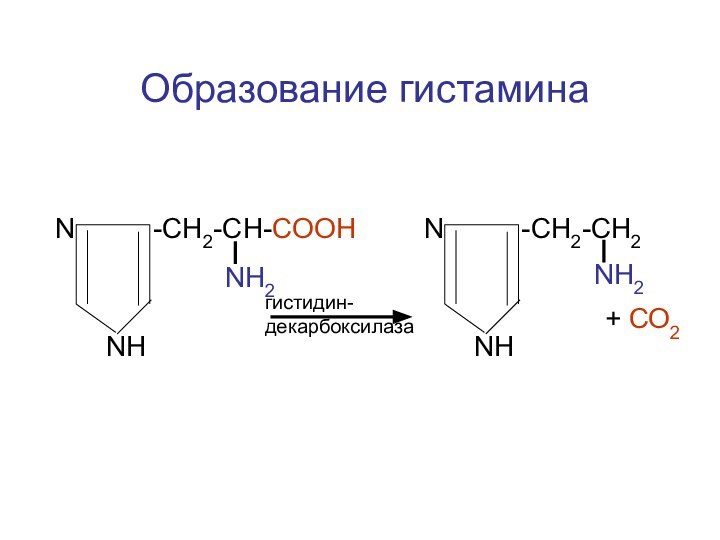
- 113. N -CH2-CH-COOHNH2NHN -CH2-CH2NH2NHгистидин-декарбоксилаза+ СО2Образование гистамина
- 114. N -CH2-CH2NH2NHN
- 115. -CH2-CH-COOHNH2NH-CH2-CH2NH2NHтриптаминдекарбоксилаза+ СО2декарбоксилирование триптофана
- 116. -CH2-CH-COOHNH2NHгидроксилирование триптофана-CH2-CH-COOHNH2NHНОгидроксилаза5-гидрокситриптофан
- 117. -CH2-CH-COOHNH2NHНО-CH2-CH2NH2NHНО5-гидрокситриптамин (серотонин)декарбоксилазасинтез серотонинаСО2
- 118. СOOHCH-NH2CH2CH2COOHCH2-NH2CH2CH2COOHдекарбоксилаза+ CO2глутаминовая кислотагамма-аминомасляная кислота (ГАМК)Декарбоксилирование глутаминовой кислоты
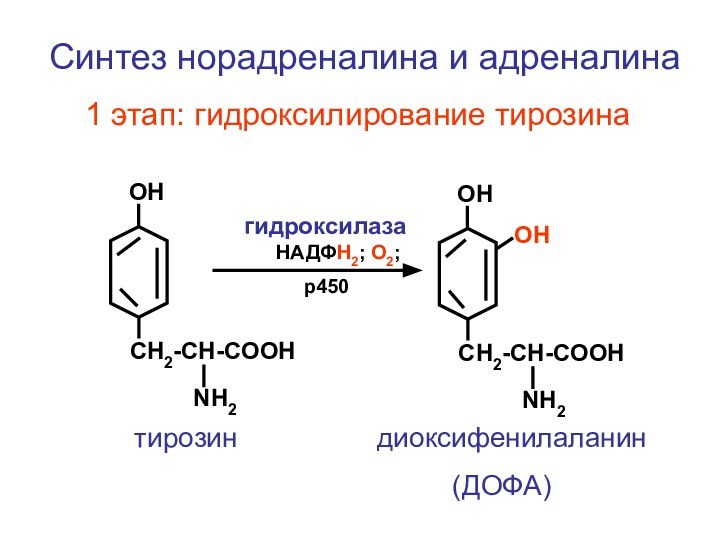
- 119. CH2-CH-COOHNH2ОН CH2-CH-COOHNH2ОНСинтез норадреналина и адреналина
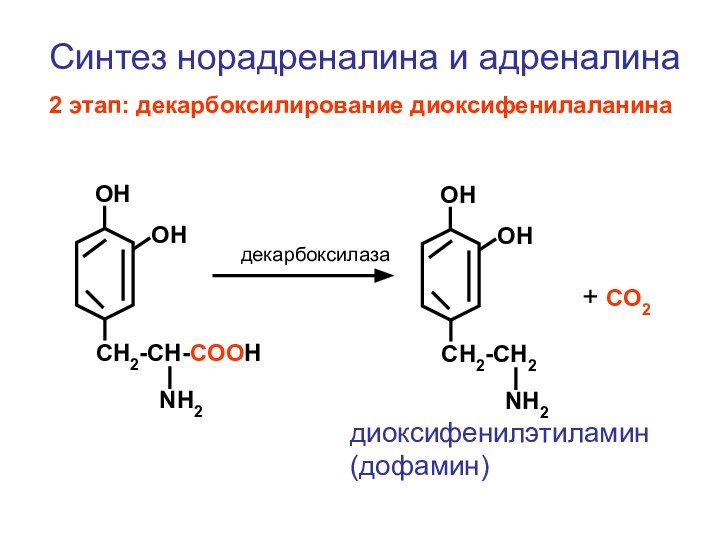
- 120. CH2-CH-COOHNH2ОНОН CH2-CH2NH2ОНОН+ СО2декарбоксилазаСинтез норадреналина и адреналина2 этап: декарбоксилирование диоксифенилаланинадиоксифенилэтиламин (дофамин)
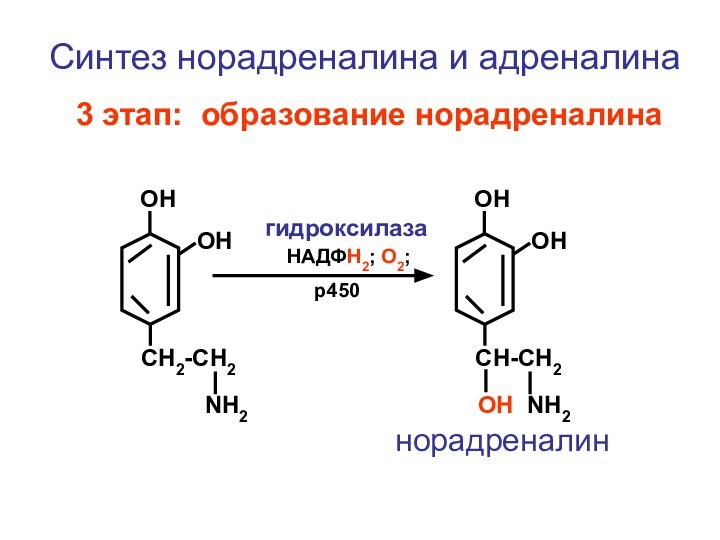
- 121. CH2-CH2NH2ОНОНСинтез норадреналина и адреналина 3 этап: образование норадреналина CH-CH2ОН NH2ОНОННАДФН2; О2; р450гидроксилазанорадреналин
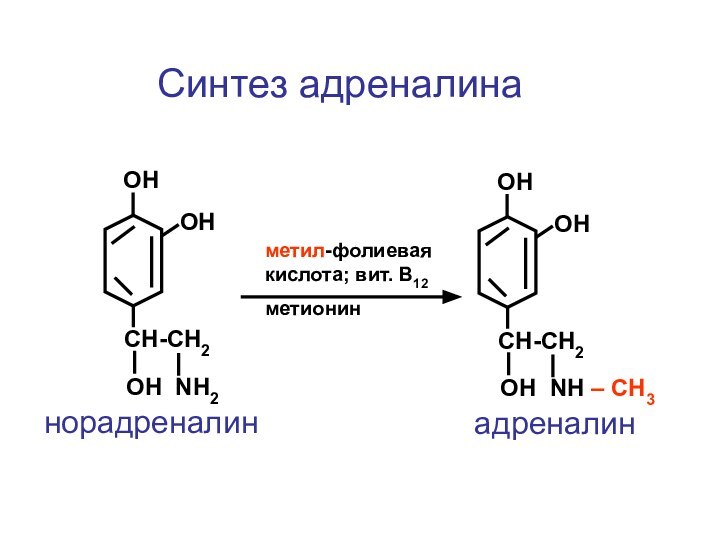
- 122. CH-CH2ОН NH2ОНОНнорадреналин CH-CH2ОН NH – СН3ОНОНадреналинметил-фолиевая кислота; вит. В12метионинСинтез адреналина
- 123. Окислительное дезаминирование аминокислот
- 124. Реакция окислительного дезаминирования глутаминовой кислотыСООНСН2СН2CH-NH2COOHHАДHАДН2+Н2ОСООНСН2СН2C = NHCOOHСООНСН2СН2C = ОCOOH+ NH3
- 125. Реакция окислительного дезаминирования аспарагиновой кислотыСООНСН2CH-NH2COOHHАДHАДН2+Н2ОСООНСН2C = NHCOOHСООНСН2C = ОCOOH+ NH3
- 126. аланин серин цистеин метионин валин
- 127. СН3 СООН
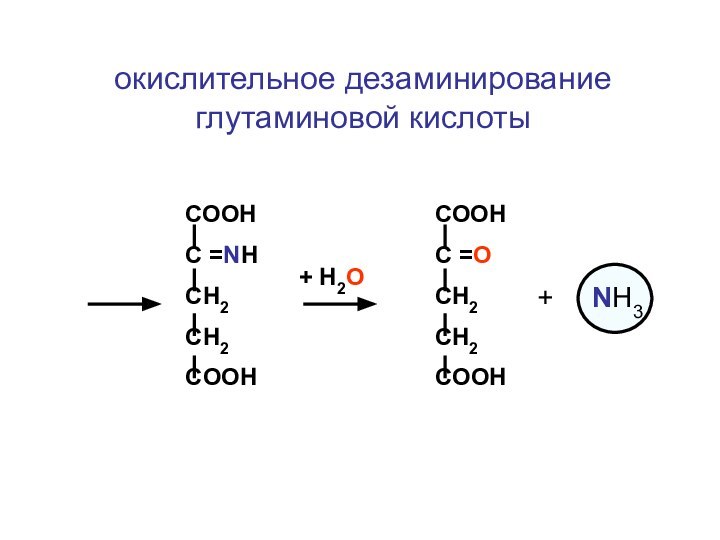
- 128. окислительное дезаминирование глутаминовой кислоты+ Н2ОСООНС =NHСН2CH2COOHСООНС =OСН2CH2COOH+ NH3
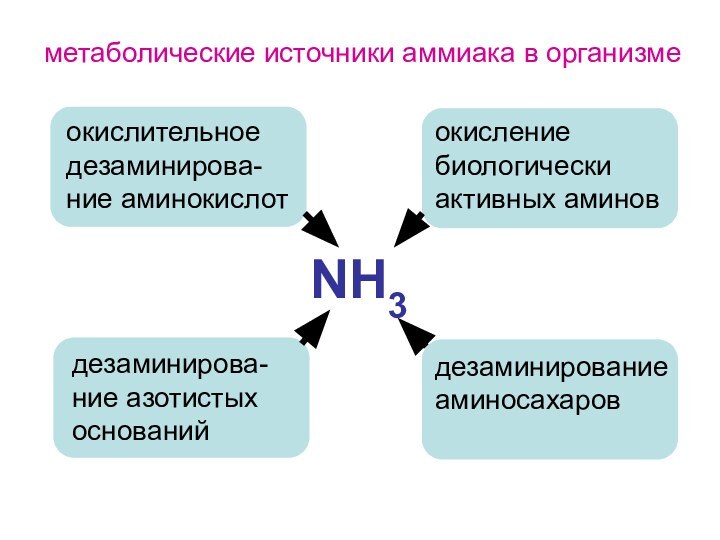
- 129. NH3окислительное дезаминирова-ние аминокислотдезаминирова-ние азотистых основанийокисление биологически активных аминовдезаминирование аминосахаровметаболические источники аммиака в организме
- 130. главный механизм обезвреживания аммиака в организме
- 131. ••Местом обезвреживания аммиака в организме ( 20 г в сутки) является печень
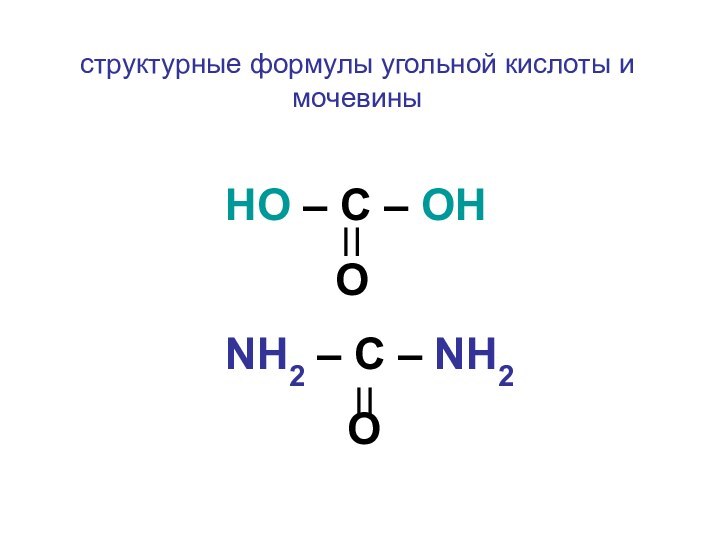
- 132. НО – С – ОН
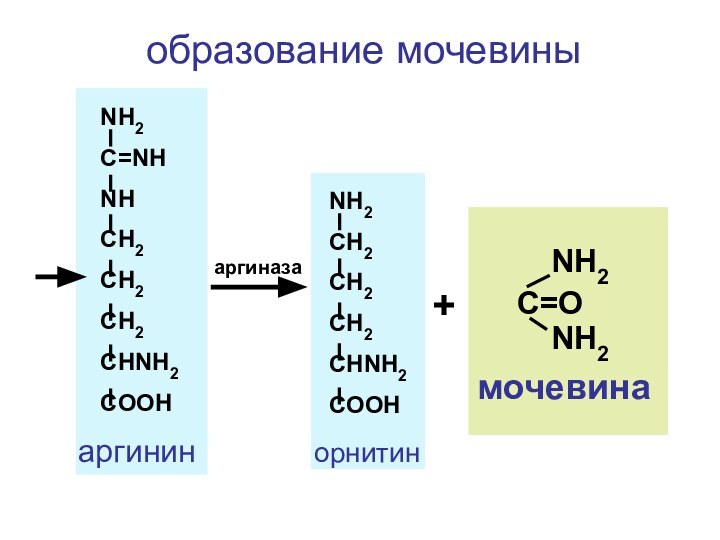
- 133. синтез мочевины
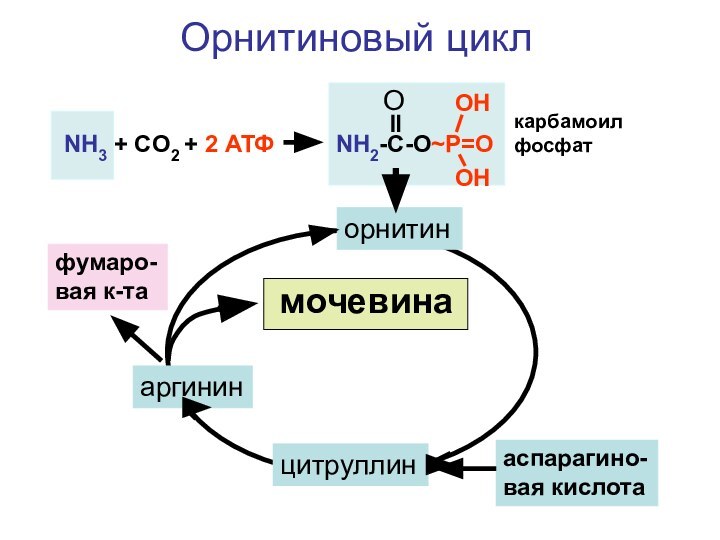
- 134. NH3 + CO2 + 2 АТФNH2-C-O~P=OOOHOHорнитинцитруллинаспарагино-вая кислотааргининфумаро-вая к-тамочевинаОрнитиновый циклкарбамоилфосфат
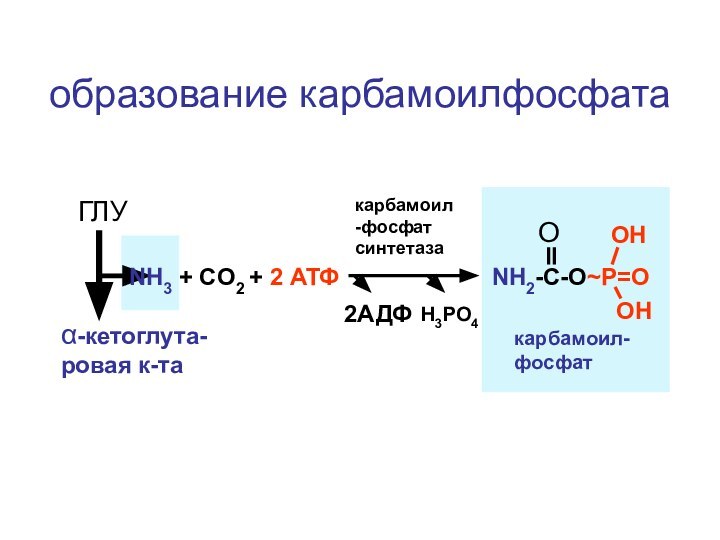
- 135. образование карбамоилфосфата ГЛУα-кетоглута-ровая к-таNH3 + CO2 + 2 АТФкарбамоил-фосфат синтетаза2АДФH3PO4NH2-C-O~P=OOOHOHкарбамоил-фосфат
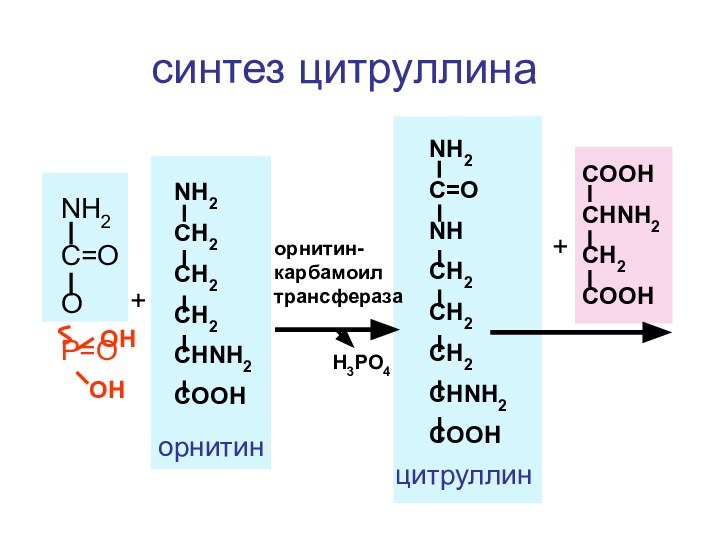
- 136. NH2C=OOP=OOHOH+NH2CH2CH2CH2CHNH2COOHорнитинорнитин-карбамоил трансферазаH3PO4NH2C=ONHCH2CH2CH2CHNH2COOHцитруллинCOOHCHNH2CH2COOH+синтез цитруллина
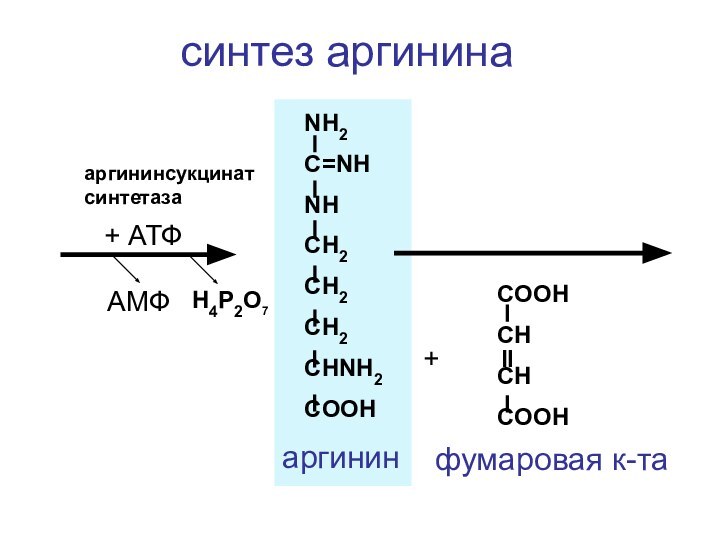
- 137. NH2C=NHNHCH2CH2CH2CHNH2COOH+COOHCHCHCOOHфумаровая к-та+ АТФаргининсукцинатсинтетазаАМФH4P2O7аргининсинтез аргинина
- 138. NH2CH2CH2CH2CHNH2COOHC=ONH2NH2мочевинаNH2C=NHNHCH2CH2CH2CHNH2COOHаргининорнитинаргиназа+образование мочевины
- 139. Вспомогательный, быстрый механизм связывания аммиака внутри клетокСООНСН2СН2CH-NH2COOHNH3+СОNH2СН2СН2CH-NH2COOHАТФ++ H2Oглутаминовая кислотаАДФ Н3РО4глутамин
- 140. СООНСН2СН2CH-NH2COOHNH3+СОNH2СН2СН2CH-NH2COOH+ H2Oглутамино-вая кислотаглутаминглутаминазамочавозвраще-ние в кровьв почкиРесинтез глутаминовой кислоты в почках
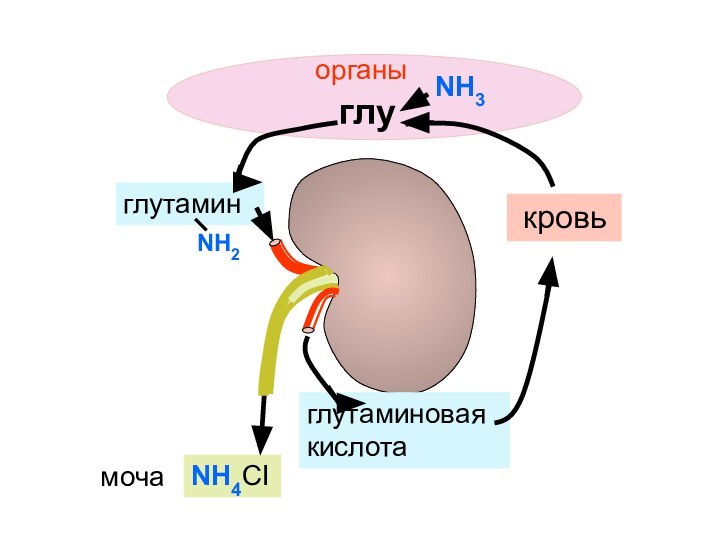
- 141. глутаминглутаминовая кислотаNH4CI кровьорганыглуNH3мочаNH2
- 142. Содержание мочевины в крови2,5 – 8,3 ммоль/л сыворотки(За сутки с мочой выделяется 20-35 г)
- 143. Регуляция обмена белков
- 144. синтез белкаконцентрация и состав аминокислотскорость синтеза и-РНК,т-РНКактивность АРС-азрегуляция гормонамиФакторы, влияющие на скорость синтеза белка
- 145. Влияние некоторых факторов на концентрацию и состав
- 146. Влияние некоторых факторов на активность АРС-азАктивность белково-синтезирующей
- 147. Факторы, влияющие на скорость синтеза и-РНК и
- 148. Гормональная регуляция скорости синтеза белкаСоматотропин, половые гормоны
- 149. На скорость дезаминирования аминокислот влияют:Соотношение НАДН2 /НАД.
- 150. Взаимосвязь между обменом белков, углеводов и липидов.
- 151. триглицериды
- 152. фосфоглицериновая кислотафосфоенол-пируватпируватацетил-КоАЦикл КребсаЩУКВзаимосвязь между обменом аминокислот и углеводовГлюкозаоксоглутаратсерин глициналанинцистеинаспарагиновая к.глутаминовая к-та
- 153. СН2-ОНСН -ОНСН2-ОНСН2-ОНСН -ОНСН2-ОРО3Н2СН2-ОНС = ОСН2-ОРО3Н2АТФНАДНАДН2С = ОСН
- 154. Скачать презентацию
- 155. Похожие презентации













































Слайд 3 Академик Опарин Александр Иванович (Лауреат Ленинской
премии 1974 г.; Премии им. А.Н. Баха, Награжден Золотой
медалью им. М.В. ЛомоносоваСлайд 5 Академик Спирин Александр Сергеевич (лауреат Ленинской премии 1976
г. Награжден медалью им. Ганса Кребса федерации Европейского биохимического
общества)
Слайд 6
Роль белков в организме
Структурная
Каталитическая
Транспортная
Регуляторная
Защитная
Гомеостатическая
Депонирующая
Функциональная
Слайд 7
Динамика обновления белков
За сутки распадается белков ~ 400
г
Из них распадается полностью до СО2; NН3
и Н2О ~ 100 гВ сутки синтезируется белков ~ 400 г
Суточная потребность в белках ~ 100 г
Период полуобновления белков ~ 80 дней
Слайд 8
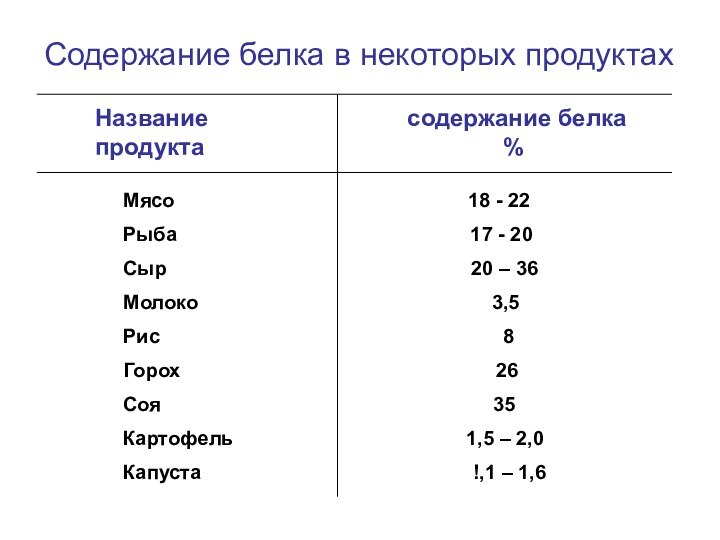
Содержание белка в некоторых продуктах
Название
содержание белка продукта %
Мясо 18 - 22
Рыба 17 - 20
Сыр 20 – 36
Молоко 3,5
Рис 8
Горох 26
Соя 35
Картофель 1,5 – 2,0
Капуста !,1 – 1,6
Слайд 9
Биологическая ценность аминокислот
заменимые
пируват ----------------------→ аланин
глицерин- ---------------------→ серин
серин -------------------------→
глициналанин-----------------------→ цистеин
щук ---------------→ аспарагиновая к-та
оксоглутаровая → глутаминовая к-та
глутаминовая к-та -----→ пролин
глутаминовая к-та ----→ гистидин
фенилаланин --------------→ тирозин
незаменимые
треонин
метионин
валин
лейцин
изолейцин
лизин
фенилаланин
триптофан
аргинин
Слайд 10
примеры продуктов, содержащие неполноценные белки
название продукта
1. белки растительных
несбалансированный
продуктов аминокислотный состав2. белки кукурузы лизин
3. белки соевых бобов триптофан
отсутствующая аминокислота
Слайд 14
Состав желудочного сока
Вода
99%
НСI
0,5-0,6%Соли 0,1%
Пепсин 2 г/сут
Гастриксин
Реннин (у детей)
рН 1,5 – 2,0
Слайд 15
Роль НСI в переваривании белков
Создает оптимум рН
для активности пепсина;
2. Обладает бактерицидным действием;
Разрушая водородные связи
в молекуле белка, способствует его разрыхлению и улучшению взаимодействия пепсина с пептидными связями белка;4. В пилорическом отделе желудка НСI стимулирует образование местных гормонов – секретина и панкреозимина, которые, в свою очередь, стимулируют секрецию сока поджелудочной железы.
Слайд 16
Секреция соляной кислоты в желудке
Обкладочные клетки
СО2
СО2
Н2СО3К+ К+
НСО3--- НСО3--- Н+ Н+
СI--- CI--- CI--
АТФ
АДФ
Н2О
Плазма просвет
желудка
Слайд 17
Медицинские названия нарушений кислотности желудочного сока
Повышенная кислотность
гиперхлоргидрия
Пониженная кислотность гипохлоргидрия
Прекращение
образования соляной кислоты ахлоргидрияНарушение секреции НСI и секреции пепсина ахилия
Слайд 18
Титрование желудочного сока
NaOH 0,1 N
NaOH 0,1 N
NaOH 0,1 N NaOH 0,1 Nдиметил-аминоазо-бензол + фенол-фталеин
0 пункт 1 пункт 2 пункт 3
Слайд 19
Расчет результатов титрования
Пункт 1. нейтрализация свободной НСI.
(мл х 10 = Т.Е.)
Пункт 3. нейтрализация всех кислот
желудочного сока. Общая кислотность (мл х 10 = Т.Е.)Пункт 2 и 3. расчет общей HСI (мл п. 2 + мл. п 3) х 10
4. Расчет связанной НСI: Общая HCI - свободная НСI = cвязанная HCI
2
= Т.E.
Слайд 20 Показатели кислотности желудочного сока в норме
(после стимуляции секреции отваром капусты)
Общая кислотность - 40 - 60 Т.Е.
Общая НСI - 25 - 50 Т.Е.
Свободная НСI - 20 - 40 Т.Е.
Связанная НСI - 5 - 10 Т.Е.
Слайд 21 Показатели кислотности желудочного сока в норме
(после стимуляции секреции гистамином)
Общая кислотность - 100 - 120 Т.Е.
Свободная НСI - 90 - 110 Т.Е.
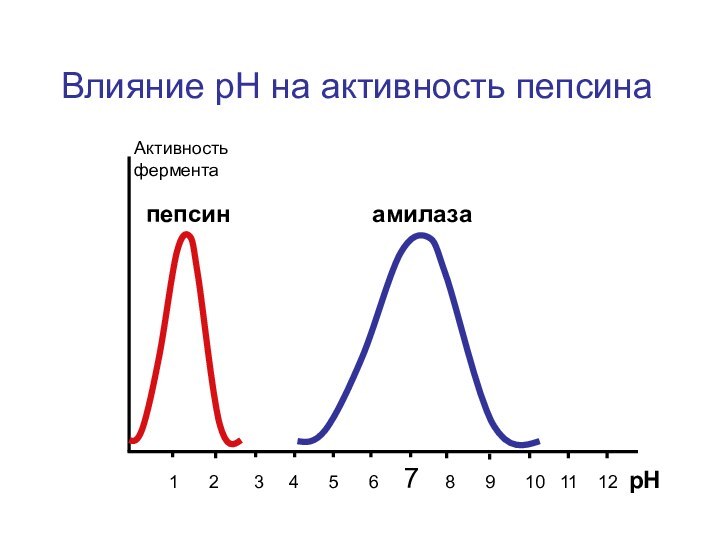
Слайд 22
1 2
3 4 5
6 7 8 9 10 11 12 рНАктивность фермента
Влияние рН на активность пепсина
амилаза
пепсин
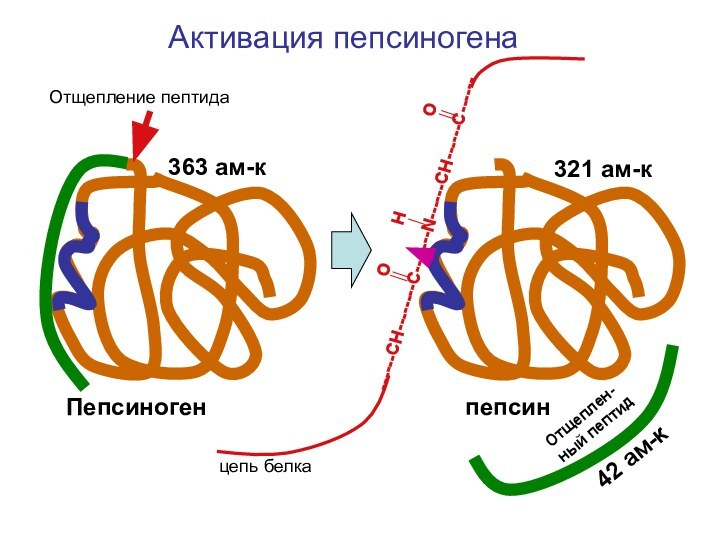
Слайд 23
O H
O------CH--------С-------N------CH------C------
цепь белка
Пепсиноген пепсин
Отщепление пептида
Отщеплен-ный пептид
Активация пепсиногена
363 ам-к
321 ам-к
42 ам-к
Слайд 26 Протеолитические проферменты и ферменты, образующиеся в поджелудочной железе
и механизм их активации
трипсиноген
трипсинхимотрипсиноген химотрипсин
карбоксипептидазы
аминопептидазы
дипептидазы
энтерокиназа (кишечная)
трипсин
229 ам-к 223 ам-к
245 ам-к 230 ам-к
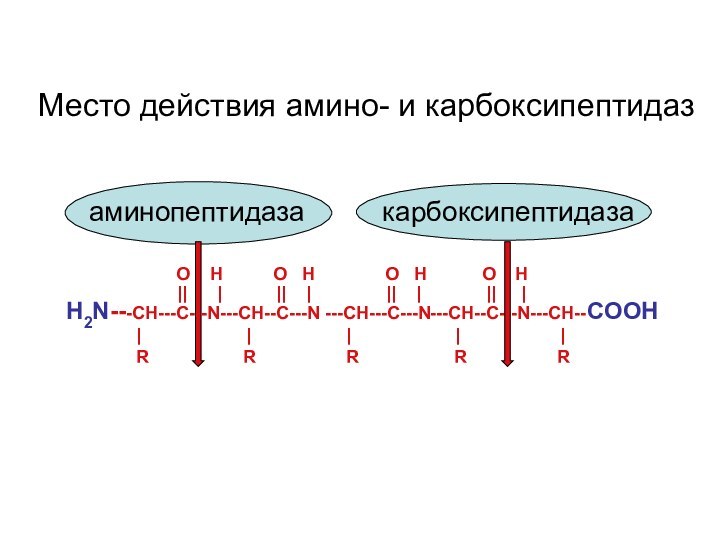
Слайд 27
O H
O H O H O HН2N---CH---С---N---CH--C---N ---CH---С---N---CH--C---N---CH--COOH
|| | || | || | || |
R R R R R
| | | | |
аминопептидаза карбоксипептидаза
Место действия амино- и карбоксипептидаз
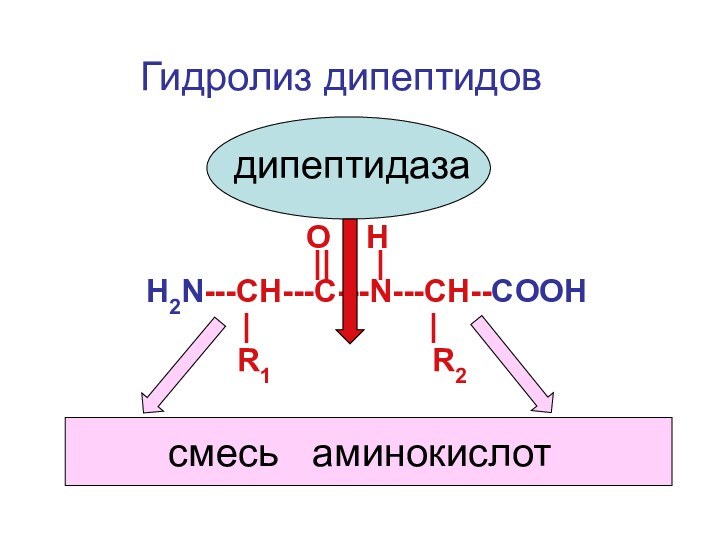
Слайд 28
O H
Н2N---CH---С---N---CH--COOH
||
| R1 R2
| |
дипептидаза
Гидролиз дипептидов
смесь аминокислот
Слайд 29
Аминокислота Na+
Nа+
К+
АТФ
АДФ
Воротная вена
кишечник
Всасывание аминокислот в кишечнике
Na,К-насос
энтероцит
Слайд 31
Превращения аминокислот в кишечнике под влиянием бактерий (гниение)
-СН2
– СН- СООН
NН2
NН
NН
NН
--СН3
скатол
индол
3
СО2; NH32 СО2; NH3
триптофан
Слайд 34
NН
NН
--СН3
скатол
индол
NН
NН
--СН3
скатоксил
индоксил
--ОН
--ОН
цит р-450; НАДФН2; О2
цит р-450; НАДФН2;
О2
гидроксилирование токсичных веществ в печени
Слайд 36
Синтез фосфоаденозинфосфосульфата
2АТФ + НSO4-
Ф-АМФ–SO3H
АДФ + Н4Р2О7
NH2 N N
О
||
N N O CH
2
– O– P– O—SO3H
|
ОН
ОН О-PO3H2
ФАФС
Слайд 38
NН
индоксил
--ОН
NН
индоксил-гидросульфат
--О-SO3H
ФАФС
NН
--О-SO3К
ИНДИКАН
обезвреживание индоксила
почки
Слайд 39
триптофан
индол
индоксил
индиканиндикан мочи
кишечник (непроходимость)
печень
почки
диагностическое значение определения индикана в моче
Слайд 41
Роль альбумина
Запасной источник аминокислот
Компонент буферной системы
Осмотически активный белок
Переносчик
жирных кислот
Переносчик жирорастворимых витаминов
Переносчик жирорастворимых гормонов
Са-связывающий белок в сыворотке
крови
Слайд 42
Какому больному можно сделать операцию?
Больной № 1
Общий белок
– 65 г/л
Альбумины - 40 г/л
- глобулины –
18 г/лБольной № 2
Общий белок – 68 г/л
Альбумины - 60 г/л
- глобулины – 11 г/л
Слайд 44
НАД (ФАД)
Модифицирован-ные углеводы
металлы
Фосфорили-рование
Удаление “лишних” аминокислот или участков белка
Образование
олигомерных белков
Образование функционально-активных молекул белков
Слайд 47
Пути превращений аминокислот в клетке
Реакции поликонденсации
Реакции трансаминирования
Реакции декарбоксилирования
Реакции
окислительного дезаминирования
Слайд 48
1. реакция поликонденсации
О
H2N–CH–C–OH H-N–CH–CООH
| + H |
СН3 СН2–ОН
О
H2N–CH–C ––– N–CH–CОOH + Н2О
| H |
СН3 СН2–ОН
Слайд 49
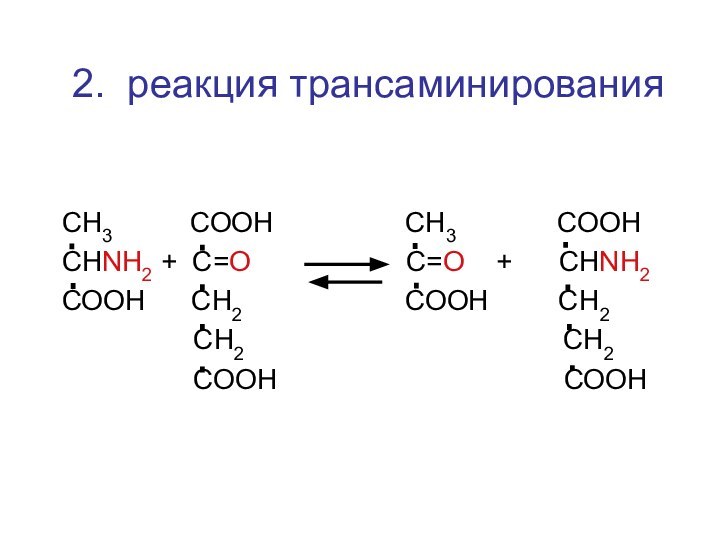
СН3 СООН
СН3
СООНСНNH2 + C=О С=О + СНNH2
СООН СН2 СООН СН2
СН2 СН2
СООН СООН
2. реакция трансаминирования
Слайд 53
Перечень веществ, необходимых для синтеза белка
и-РНК (зрелая)
т-РНК (
61)
20 аминокислот
АТФ, ГТФ
Ферменты
Небелковые компоненты
Рибосомы
Слайд 54
Активация аминокислот
NH2–CH-COOH + АТФ
R
NH2
N N
O O
|| ||
N N O CH
2
– O– P– O - C - CH - NH2
|
ОН
ОН ОН
R
аминоациладенилат
Слайд 55
роль АРС-азы (аминоацил-тРНК-синтетазы) в “узнавании” аминокислот своей т-РНК
H2N
– CH – CO-O-АМФ
R
НS
HS
АРС-аза
т-РНК
Ц-Ц-А
Слайд 58
ЦЦА
O
||
– O– P– OН
|
ОН
ОН О
О СН2-
О=С-СН-NH2
R
Аминокислота присоединяется к рибозе АМФ т-РНК
Слайд 60
Стадии синтеза белка
образование инициирующего
комплекса;
элонгация (удлинение полипептидной цепи);
терминация (завершение синтеза);
процессинг (окончательное достраивание молекулы
белка).
Слайд 61
Компоненты инициирующего комплекса.
ЦЦА
О=С-СН-NH2
И-РНК
Малая субъединица
рибосомыпептидильный аминоацильный центр центр
R
Слайд 63
Взаимодействие кодона с антикодоном
кодон
кодон кодон кодон
-А-Ц-Г-А-У-Г-А-У-Ц-Г-А-У-А-Ц-Г- и-РНК
У-А-Ц
ЦЦА
-аминокислота
Слайд 92
Компоненты инициирующего комплекса.
ЦЦА
О=С-СН-NH2
И-РНК
Малая субъединица
рибосомыпептидильный аминоацильный центр центр
R
Слайд 94
ЦЦА
О=С-СН-NH2
СН2-СН2-S-CH3
Образование рибосомы
метионин
и-РНК
СAP
Большая субъединица
рибосомы
П А
Слайд 96
ЦЦА
О=С-СН-NH2
СН2-R
ЦЦА
О=С-СН-NH2
СН3
и-РНК
Перенос первой аминокислоты на вторую ферментом пептидилтрансферазой
П
А
Слайд 98
СAP
СН2-R
и-РНК
ЦЦА
О=С-СН-NH – CO-CH-NH2
СН3
Перемещение
рибосомы вдоль и-РНК на один триплет (кодон)
ЦЦА
Слайд 99
СН2-R
и-РНК
ЦЦА
О=С-СН-NH – CO-CH-NH2
СН3
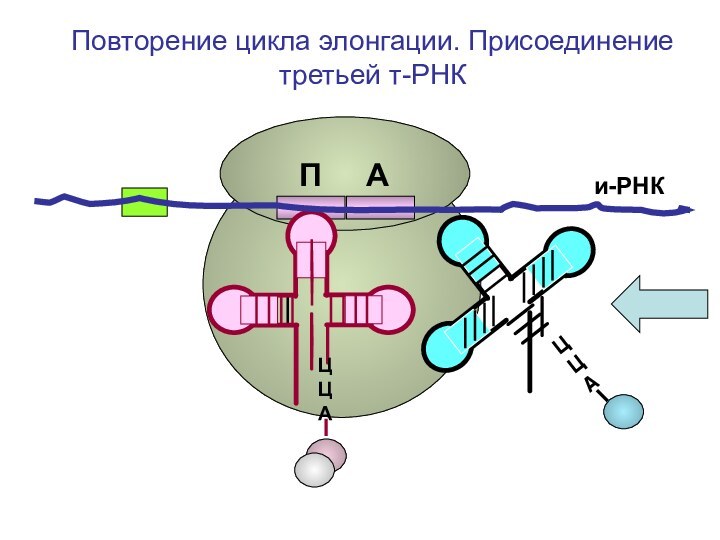
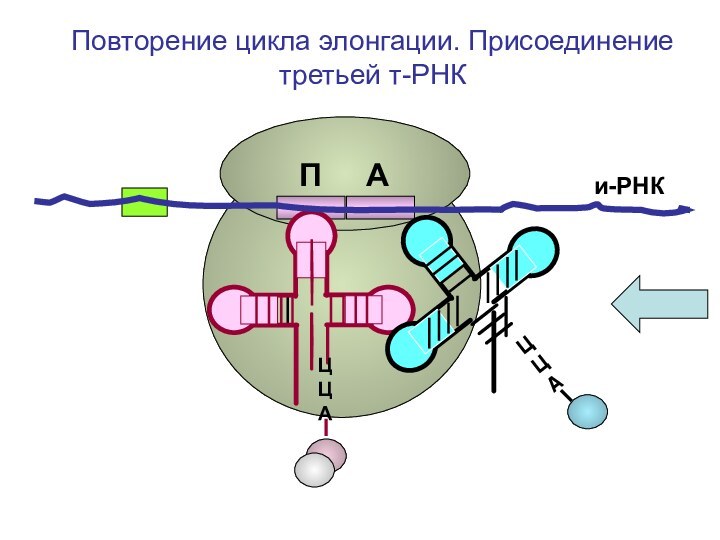
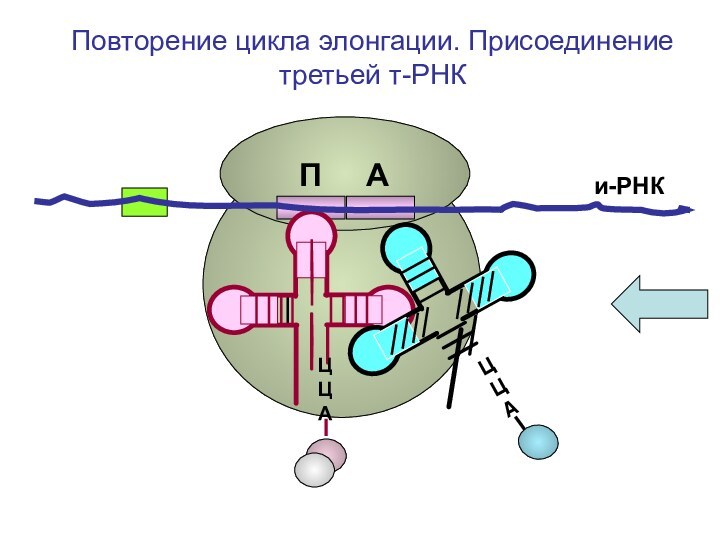
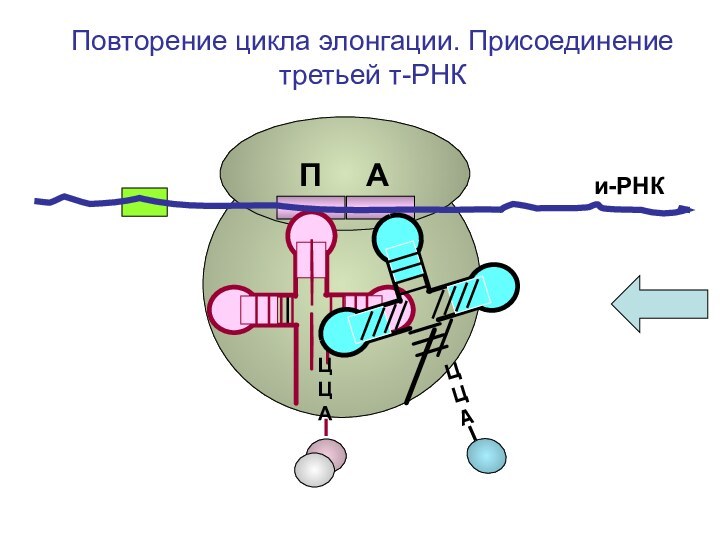
ЦЦА
О=С-СН-NH2
CH2-OH
Повторение цикла
элонгации. Присоединение третьей т-РНК к А-центру рибосомыП А
Слайд 100
СН2-R
ЦЦА
О=С-СН-NH – CO-CH-NH2
СН3
ЦЦА
О=С-СН-NH2
CH2-OH
и-РНК
П А
Перенос дипептида
на третью аминокислоту ферментом пептидилтрансферазой.
Слайд 102
СAP
и-РНК
ЦЦА
Перемещение рибосомы вдоль
и-РНК на один триплет (кодон)
ЦЦА
СН2-R
ОС-СН-NH – CO-CH-NH2
СН3
О=С-СН-NH-
CH2-OH
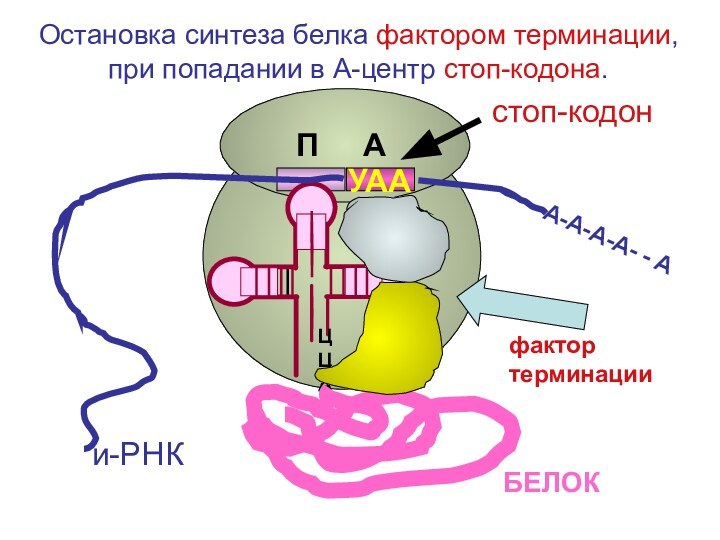
Слайд 104
ЦЦА
УАА
А-А-А-А- - А
и-РНК
фактор терминации
БЕЛОК
стоп-кодон
Остановка
синтеза белка фактором терминации, при попадании в А-центр стоп-кодона.
П
А
Слайд 107
Биологическая ценность аминокислот
заменимые
пируват ----------------------→ аланин
глицерин- ---------------------→ серин
серин -------------------------→
глициналанин-----------------------→ цистеин
щук ---------------→ аспарагиновая к-та
оксоглутаровая → глутаминовая к-та
глутаминовая к-та -----→ пролин
глутаминовая к-та ----→ гистидин
фенилаланин --------------→ тирозин
незаменимые
треонин
метионин
валин
лейцин
изолейцин
лизин
фенилаланин
триптофан
аргинин
Слайд 108
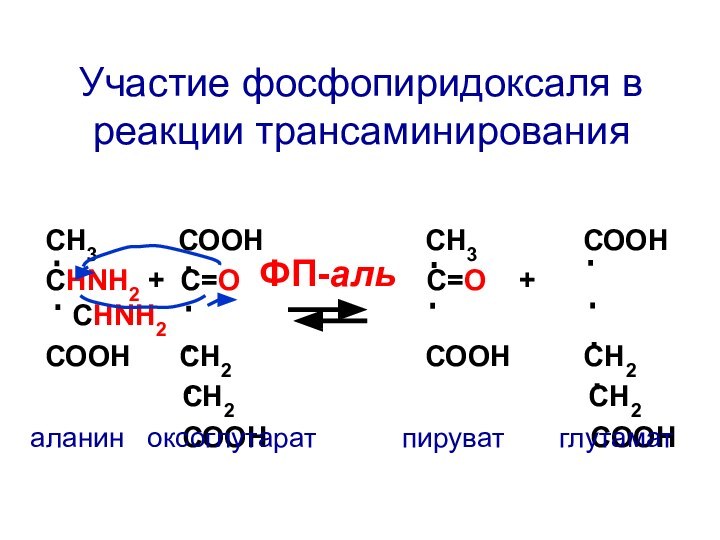
СН3 СООН
СН3
СООНСНNH2 + C=О С=О + СНNH2
СООН СН2 СООН СН2
СН2 СН2
СООН СООН
ФП-аль
аланин оксоглутарат пируват глутамат
Участие фосфопиридоксаля в реакции трансаминирования
Слайд 109
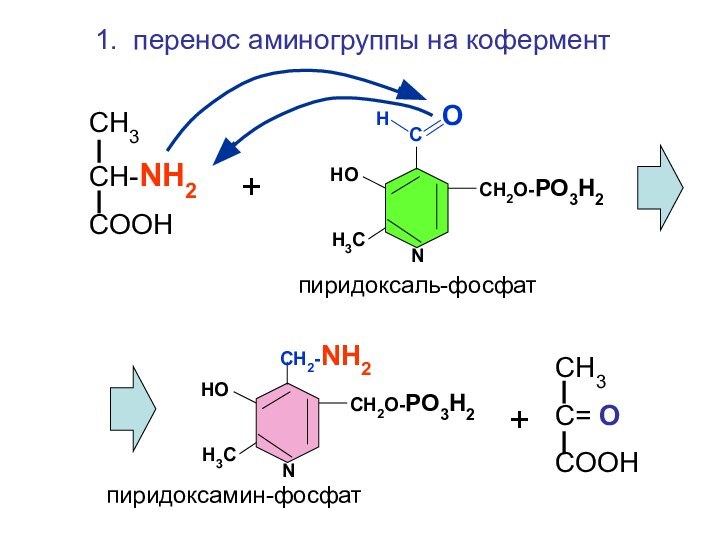
Н О
С
СН2О-РО3Н2
НО
Н3С
N
СН2-NH2
СН2О-РО3Н2
НО
Н3С
N
пиридоксаль-фосфат
пиридоксамин-фосфат
СН3
СН-NH2
COOH
+
СН3
С= O
COOH
+
1. перенос аминогруппы на
кофермент
Слайд 110
Н О
С
СН2О-РО3Н2
НО
Н3С
N
СН2-NH2
СН2О-РО3Н2
НО
Н3С
N
пиридоксаль-фосфат
пиридоксамин-фосфат
СООН
С=О
СН2
СН2
COOH
+
+
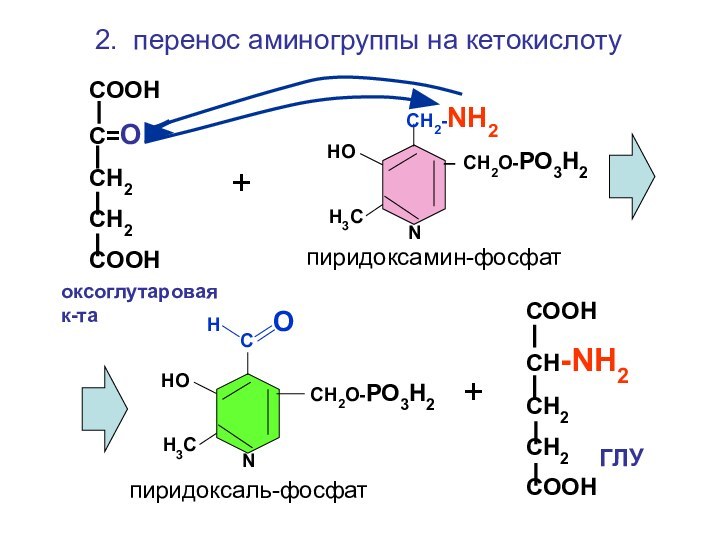
2. перенос аминогруппы на кетокислоту
СООН
СН-NH2
СН2
СН2
COOH
оксоглутаровая
к-таГЛУ
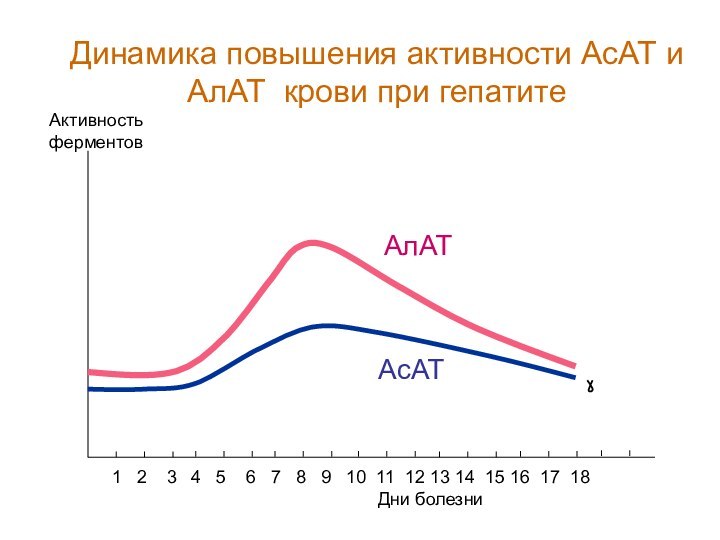
Слайд 111
Дни болезни
Активность ферментов
1 2 3
4 5 6 7 8
9 10 11 12 13 14 15 16 17 18АлАТ
Динамика повышения активности АсАТ и АлАТ крови при гепатите
АсАТ
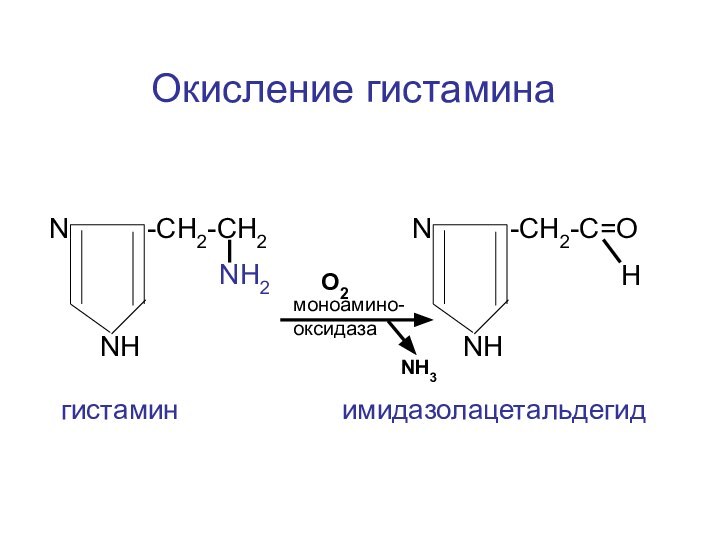
Слайд 114
N -CH2-CH2
NH2
NH
N
-CH2-C=О
НNH
моноамино-оксидаза
гистамин имидазолацетальдегид
Окисление гистамина
NH3
O2
Слайд 116
-CH2-CH-COOH
NH2
NH
гидроксилирование триптофана
-CH2-CH-COOH
NH2
NH
НО
гидроксилаза
5-гидрокситриптофан
Слайд 117
-CH2-CH-COOH
NH2
NH
НО
-CH2-CH2
NH2
NH
НО
5-гидрокситриптамин
(серотонин)
декарбоксилаза
синтез серотонина
СО2
Слайд 118
СOOH
CH-NH2
CH2
CH2
COOH
CH2-NH2
CH2
CH2
COOH
декарбоксилаза
+ CO2
глутаминовая кислота
гамма-аминомасляная кислота (ГАМК)
Декарбоксилирование глутаминовой кислоты
Слайд 119
CH2-CH-COOH
NH2
ОН
CH2-CH-COOH
NH2
ОН
Синтез норадреналина и адреналина
1
этап: гидроксилирование тирозина
НАДФН2; О2;
р450
ОН
тирозин
диоксифенилаланин(ДОФА)
гидроксилаза
Слайд 120
CH2-CH-COOH
NH2
ОН
ОН
CH2-CH2
NH2
ОН
ОН
+ СО2
декарбоксилаза
Синтез норадреналина и адреналина
2 этап:
декарбоксилирование диоксифенилаланина
диоксифенилэтиламин (дофамин)
Слайд 121
CH2-CH2
NH2
ОН
ОН
Синтез норадреналина и адреналина
3 этап:
образование норадреналина
CH-CH2
ОН NH2
ОН
ОН
НАДФН2; О2;
р450
гидроксилаза
норадреналин
Слайд 122
CH-CH2
ОН NH2
ОН
ОН
норадреналин
CH-CH2
ОН NH – СН3
ОН
ОН
адреналин
метил-фолиевая кислота;
вит. В12
метионин
Синтез адреналина
Слайд 124
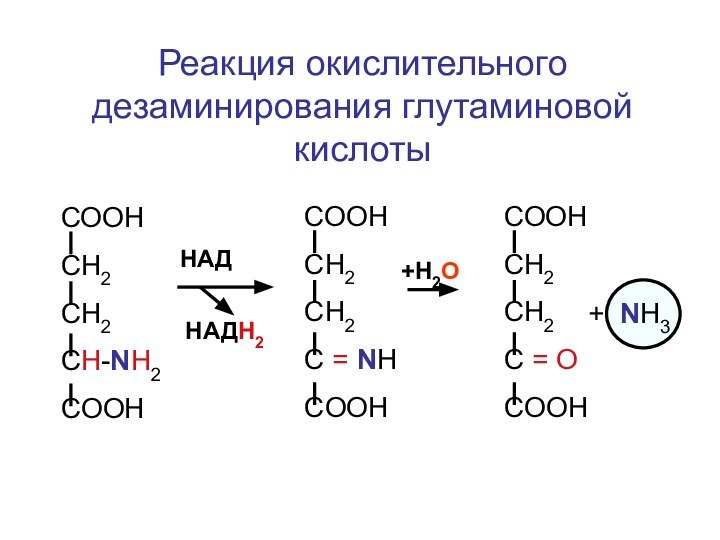
Реакция окислительного дезаминирования глутаминовой кислоты
СООН
СН2
СН2
CH-NH2
COOH
HАД
HАДН2
+Н2О
СООН
СН2
СН2
C = NH
COOH
СООН
СН2
СН2
C =
О
COOH
+ NH3
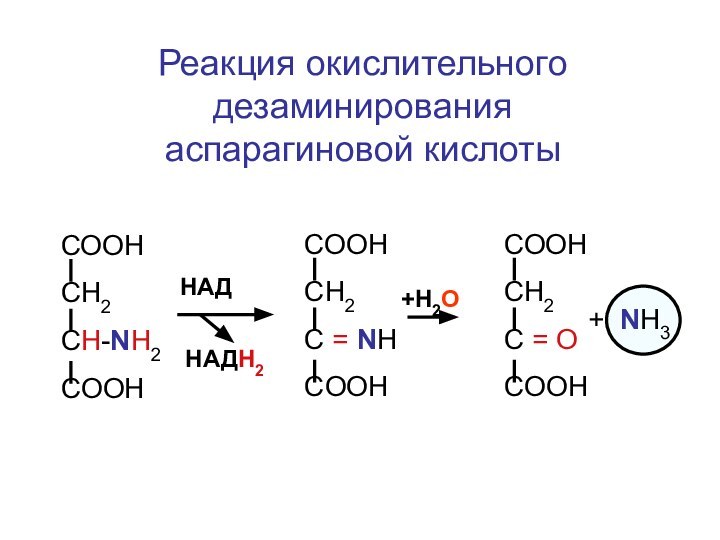
Слайд 125
Реакция окислительного дезаминирования аспарагиновой кислоты
СООН
СН2
CH-NH2
COOH
HАД
HАДН2
+Н2О
СООН
СН2
C = NH
COOH
СООН
СН2
C =
О
COOH
+ NH3
Слайд 126
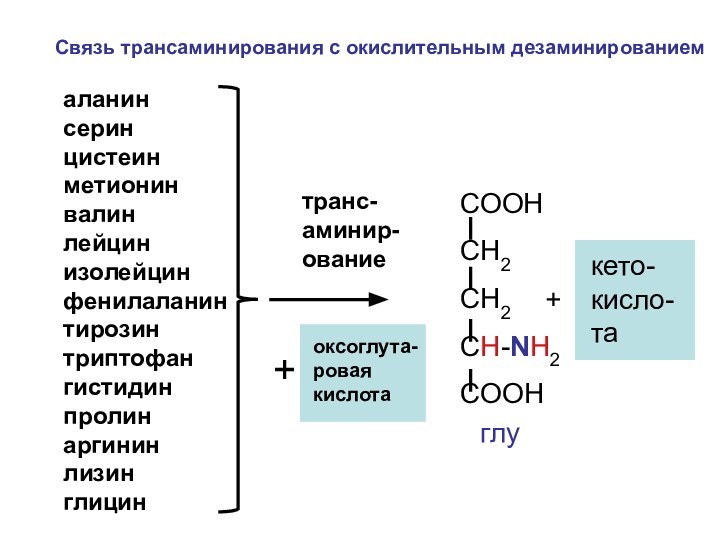
аланин серин цистеин метионин валин
лейцин изолейцин фенилаланин тирозин триптофан гистидин
пролин аргинин лизин глицинтранс-аминир-ование
оксоглута-ровая кислота
+
СООН
СН2
СН2
CH-NH2
COOH
+
кето-кисло-та
Связь трансаминирования с окислительным дезаминированием
глу
Слайд 127
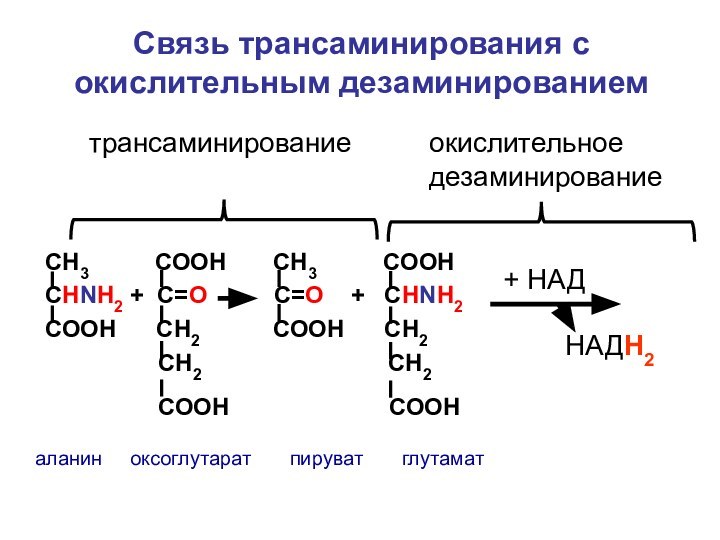
СН3 СООН
СН3 СООН
СНNH2 + C=О
С=О + СНNH2СООН СН2 СООН СН2
СН2 СН2
СООН СООН
аланин оксоглутарат пируват глутамат
+ НАД
НАДН2
трансаминирование
окислительное дезаминирование
Связь трансаминирования с окислительным дезаминированием
Слайд 128
окислительное дезаминирование глутаминовой кислоты
+ Н2О
СООН
С =NH
СН2
CH2
COOH
СООН
С =O
СН2
CH2
COOH
+
NH3
Слайд 129
NH3
окислительное дезаминирова-ние аминокислот
дезаминирова-ние азотистых оснований
окисление биологически активных аминов
дезаминирование
аминосахаров
метаболические источники аммиака в организме
Слайд 134
NH3 + CO2 + 2 АТФ
NH2-C-O~P=O
O
OH
OH
орнитин
цитруллин
аспарагино-вая кислота
аргинин
фумаро-вая к-та
мочевина
Орнитиновый
цикл
карбамоилфосфат
Слайд 135
образование карбамоилфосфата
ГЛУ
α-кетоглута-ровая к-та
NH3 + CO2 + 2
АТФ
карбамоил-фосфат синтетаза
2АДФ
H3PO4
NH2-C-O~P=O
O
OH
OH
карбамоил-фосфат
Слайд 136
NH2
C=O
O
P=O
OH
OH
+
NH2
CH2
CH2
CH2
CHNH2
COOH
орнитин
орнитин-карбамоил трансфераза
H3PO4
NH2
C=O
NH
CH2
CH2
CH2
CHNH2
COOH
цитруллин
COOH
CHNH2
CH2
COOH
+
синтез цитруллина
Слайд 137
NH2
C=NH
NH
CH2
CH2
CH2
CHNH2
COOH
+
COOH
CH
CH
COOH
фумаровая к-та
+ АТФ
аргининсукцинатсинтетаза
АМФ
H4P2O7
аргинин
синтез аргинина
Слайд 138
NH2
CH2
CH2
CH2
CHNH2
COOH
C=O
NH2
NH2
мочевина
NH2
C=NH
NH
CH2
CH2
CH2
CHNH2
COOH
аргинин
орнитин
аргиназа
+
образование мочевины
Слайд 139
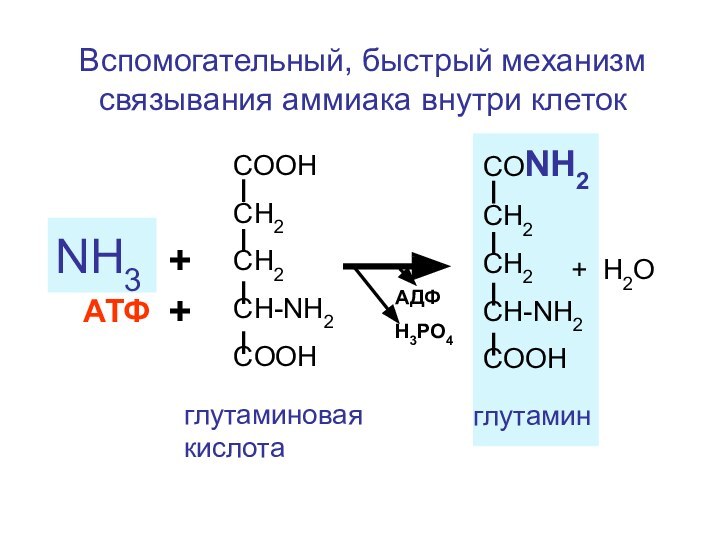
Вспомогательный, быстрый механизм связывания аммиака внутри клеток
СООН
СН2
СН2
CH-NH2
COOH
NH3
+
СОNH2
СН2
СН2
CH-NH2
COOH
АТФ
+
+ H2O
глутаминовая
кислота
АДФ
Н3РО4
глутамин
Слайд 140
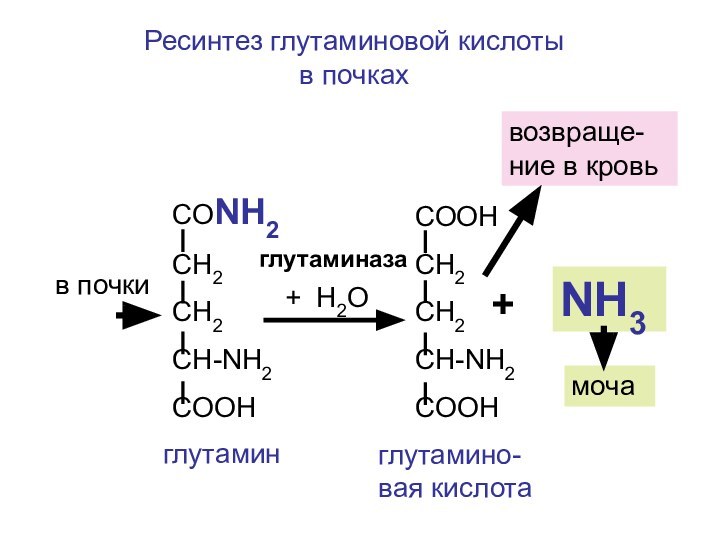
СООН
СН2
СН2
CH-NH2
COOH
NH3
+
СОNH2
СН2
СН2
CH-NH2
COOH
+ H2O
глутамино-вая кислота
глутамин
глутаминаза
моча
возвраще-ние в кровь
в почки
Ресинтез глутаминовой кислоты
в почках
Слайд 142
Содержание мочевины в крови
2,5 – 8,3 ммоль/л сыворотки
(За
сутки с мочой выделяется 20-35 г)
Слайд 144
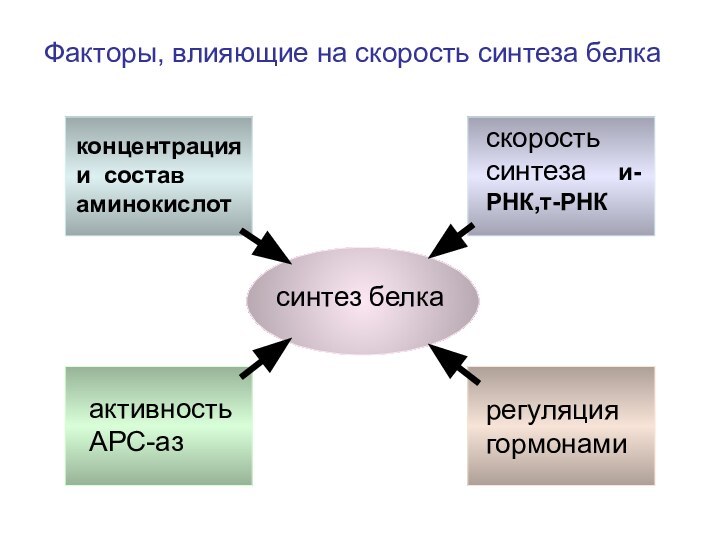
синтез белка
концентрация и состав аминокислот
скорость синтеза и-РНК,т-РНК
активность
АРС-аз
регуляция гормонами
Факторы, влияющие на скорость синтеза белка
Слайд 145
Влияние некоторых факторов на концентрацию и состав аминокислот
Доступность
в белковой диете;
2. Наличие полноценных белков в продуктах;
2.
Содержание альбумина в крови;3. Заболевания органов пищеварения;
4. Нарушения всасывания аминокислот;
5. Заболевания почек, печени, поджелудочной железы;
6. Гиповитаминоз (В6; фолиевой кислоты, В12)
Слайд 146
Влияние некоторых факторов на активность АРС-аз
Активность белково-синтезирующей системы;
2.
Кислотно-основное состояние в организме;
3. Состояние биоэнергетических процессов.
Слайд 147
Факторы, влияющие на скорость синтеза и-РНК и т-РНК
Наличие нуклеотидного фонда;
Состояние биоэнергетических процессов;
3. Влияние факторов роста
на процесс транскрипции (индукция и репрессия генов).
Слайд 148
Гормональная регуляция скорости синтеза белка
Соматотропин, половые гормоны (индукторы
транскрипции и биосинтеза белка);
2. Тироксин (активатор транскрипции ферментов, осуществляющих
липолиз и протеолиз); 3. Инсулин (активатор транскрипции ферментов, участвующих в углеводном обмене);
4. Глюкокортикоиды (репрессоры транскрипции генов, контролирующих синтез белков и липидов. Индукторы транскрипции и биосинтеза ферментов глюконеогенеза).
Слайд 149
На скорость дезаминирования аминокислот влияют:
Соотношение НАДН2 /НАД. При
гипоксии увеличивается концентрация НАДН2. Недостаток НАД служит причиной замедления
скорости дезаминирования аминокислот.2. Концентрация NH3. Увеличение концентрации аммиака замедляет процесс дезаминирования.
3. Снижение концентрации глутаминовой кислоты или аспарагиновой кислоты понижает скорость окислительного дезаминирования.
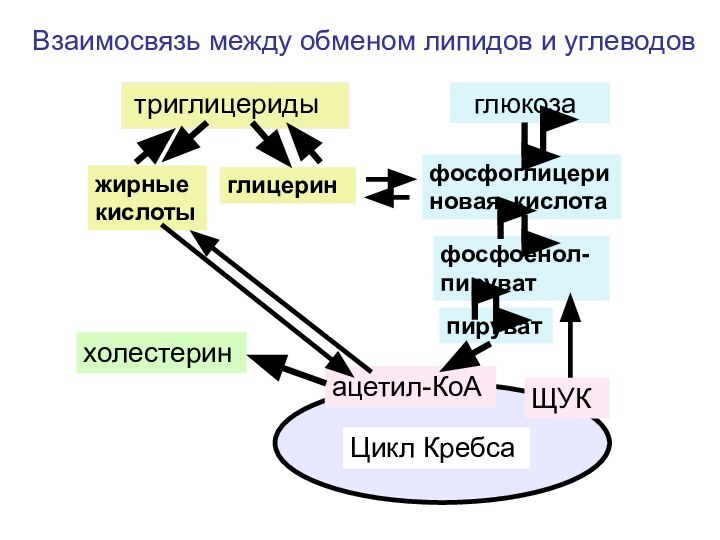
Слайд 151
триглицериды
глюкоза
жирные кислоты
глицерин
фосфоглицериновая кислота
фосфоенол-пируват
пируват
ацетил-КоА
холестерин
Цикл Кребса
ЩУК
Взаимосвязь между обменом липидов
и углеводов
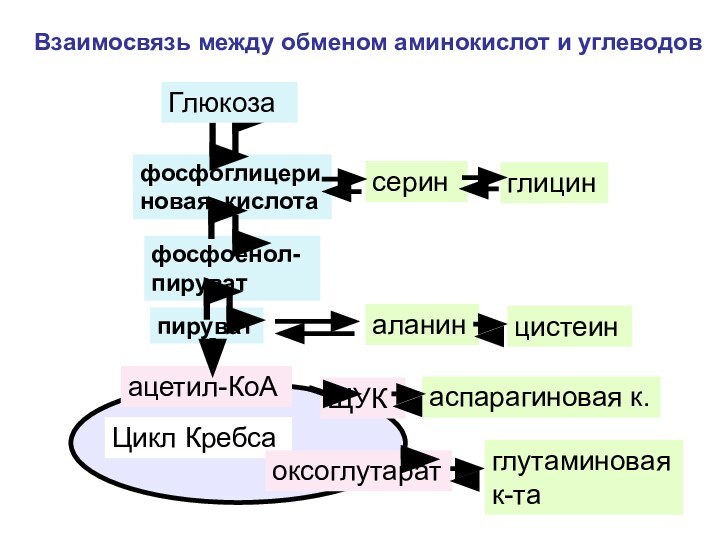
Слайд 152
фосфоглицериновая кислота
фосфоенол-пируват
пируват
ацетил-КоА
Цикл Кребса
ЩУК
Взаимосвязь между обменом аминокислот и углеводов
Глюкоза
оксоглутарат
серин
глицин
аланин
цистеин
аспарагиновая к.
глутаминовая к-та
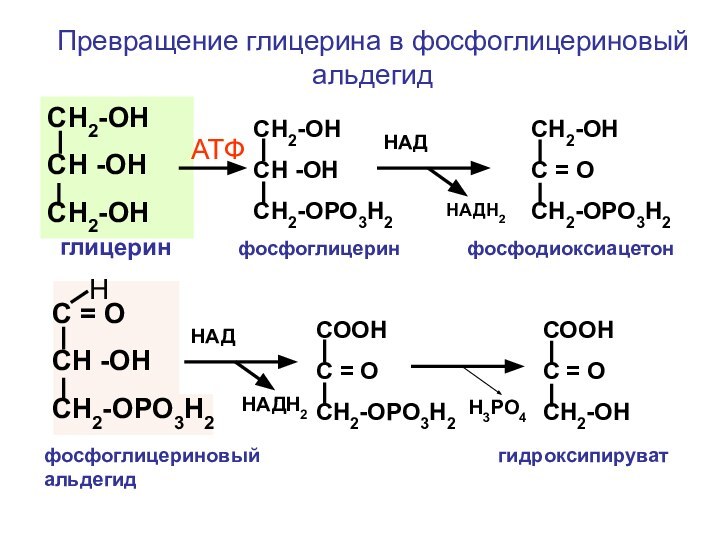
Слайд 153
СН2-ОН
СН -ОН
СН2-ОН
СН2-ОН
СН -ОН
СН2-ОРО3Н2
СН2-ОН
С = О
СН2-ОРО3Н2
АТФ
НАД
НАДН2
С = О
СН -ОН
СН2-ОРО3Н2
Н
СООН
С
= О
СН2-ОРО3Н2
СООН
С = О
СН2-ОН
НАД
НАДН2
Н3РО4
Превращение глицерина в фосфоглицериновый альдегид
глицерин
фосфоглицерин фосфодиоксиацетон фосфоглицериновый гидроксипируват альдегид