- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Обмен,синтез,мобилизация гликогена. (Лекция 7)
Содержание
- 2. СИНТЕЗ ГЛИКОГЕНА (ГЛИКОГЕНОГЕНЕЗ), МОБИЛИЗАЦИЯ ГЛИКОГЕНА (ГЛИКОГЕНОЛИЗ). РЕГУЛЯЦИЯ ПРОЦЕССОВ
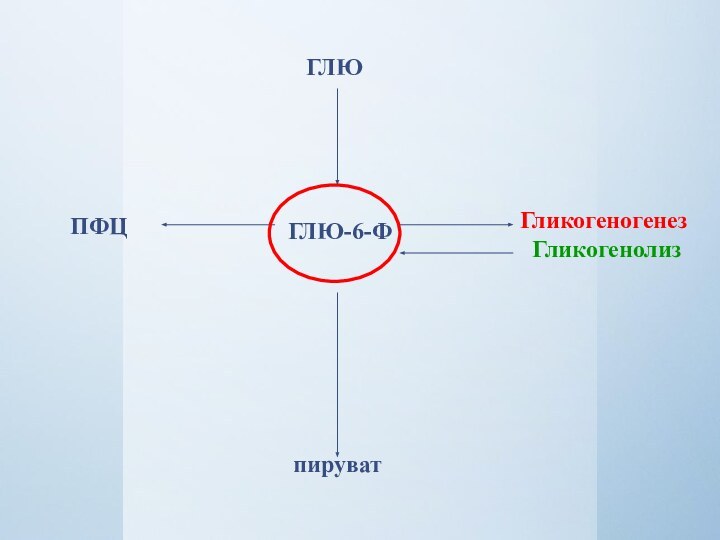
- 3. ГЛЮ-6-ФГЛЮПФЦпируватГликогеногенез Гликогенолиз
- 4. Гликоген - основной резервный полисахарид в клетках
- 5. Гликоген депонируется главным образом в печени
- 6. Синтез гликогенаГликоген синтезируется в период пищеварения (абсорбтивный
- 7. Синтез гликогенаКогда длина синтезируемой цепи увеличивается на
- 9. Мобилизация (распад) гликогена Мобилизация (распад) гликогена
- 10. Мобилизация (распад) гликогена Мобилизация гликогена в
- 12. Переключение процессов синтеза и мобилизации гликогена в
- 13. Влияние этих гормонов на синтез и распад
- 14. Первичным сигналом для синтеза инсулина и глюкагона
- 15. Регуляция метаболизма гликогена в печени В
- 16. Под влиянием инсулина происходит:• ускорение транспорта
- 17. Регуляция синтеза и распада гликогена в печени
- 18. Инозитолфосфатный механизм регуляции синтеза и распада гликогена
- 19. Регуляция метаболизма гликогена в мышцахАктивация адреналином мышечной
- 20. При интенсивной мышечной работе киназа фосфорилазы (Са2+
- 21. Значение регуляции обмена гликогена.При передаче гормонального сигнала
- 22. Итак, регуляция скоростей синтеза и распада гликогена
- 23. СИНТЕЗ ГЛЮКОЗЫ - ГЛЮКОНЕОГЕНЕЗ
- 24. Глюконеогенез - это процесс синтеза глюкозы
- 25. Важнейшей функцией глюконеогенеза является поддержание уровня глюкозы
- 26. Процесс протекает главным образом в печени
- 27. Схема гликолиза и глюконеогенеза
- 28. Суммарное уравнение глюконеогенеза2 Пируват + 4 АТФ
- 29. Глюкозолактатный цикл или цикл КориИспользование лактата в
- 30. Особенности обмена глюкозы в различных тканях и органах
- 31. Обмен углеводов в печениОдной из важнейших функций
- 32. Обмен углеводов в печениВ печени катаболизм глюкозы
- 33. Обмен углеводов в печениГликолиз обеспечивает энергией клеточные
- 34. Обмен углеводов в печениПри аэробных условиях происходит
- 35. Обмен углеводов в печениВ печени протекают гликогенез
- 36. Обмен углеводов в мышцах Цель мышечной клетки
- 37. Обмен углеводов в мышцах В мышцах идет
- 38. Обмен углеводов в мышцахФосфорилирование глюкозы в мышцах
- 39. Обмен углеводов в мозге По сравнению со
- 40. Обмен углеводов в мозге Высокая активность митохондриальных
- 41. Обмен углеводов в эритроцитахЭритроциты не содержат ядра,
- 42. Особенности обмена глюкозы в клетках опухoлиВ
- 43. Скачать презентацию
- 44. Похожие презентации






























Слайд 2
СИНТЕЗ ГЛИКОГЕНА (ГЛИКОГЕНОГЕНЕЗ), МОБИЛИЗАЦИЯ ГЛИКОГЕНА (ГЛИКОГЕНОЛИЗ). РЕГУЛЯЦИЯ ПРОЦЕССОВ
Слайд 5 Гликоген депонируется главным образом в печени и скелетных
мышцах и хранится в цитозоле клеток в форме гранул.
Гранулы гликогена плохо растворимы в воде и не влияют на осмотическое давление в клетке. Это обстоятельство объясняет, почему в клетке депонируется гликоген, а не свободная глюкоза. С гранулами связаны и некоторые ферменты, участвующие в обмене гликогена, что облегчает взаимодействие ферментов с субстратами.
Слайд 6
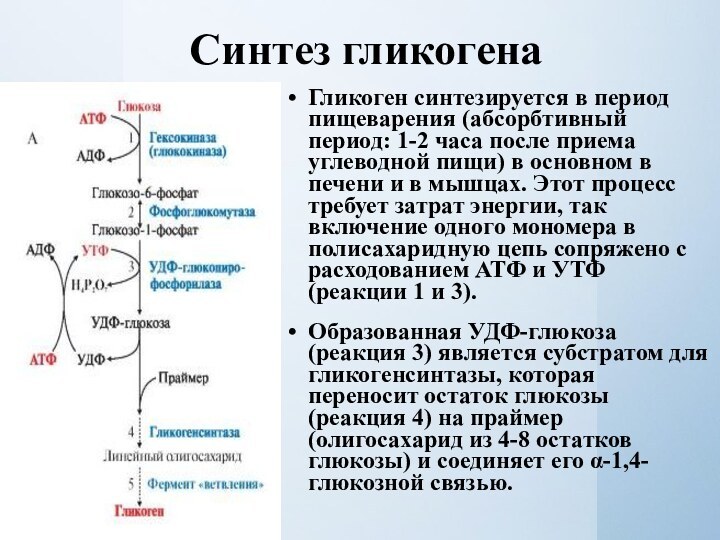
Синтез гликогена
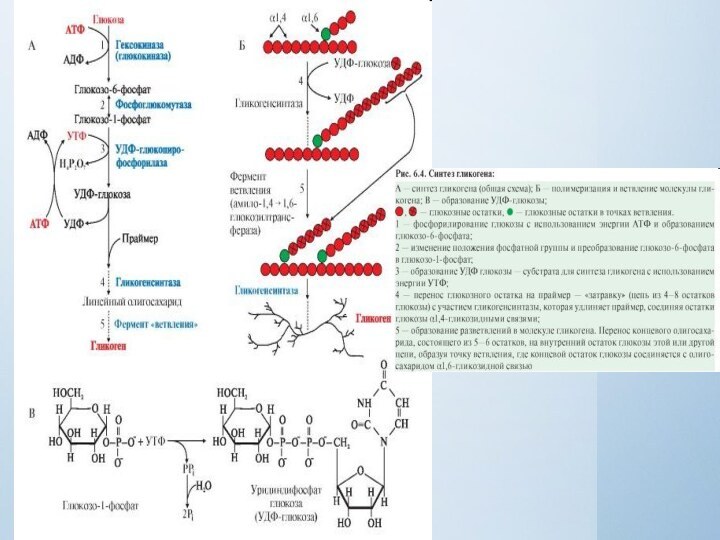
Гликоген синтезируется в период пищеварения (абсорбтивный период:
1-2 часа после приема углеводной пищи) в основном в
печени и в мышцах. Этот процесс требует затрат энергии, так включение одного мономера в полисахаридную цепь сопряжено с расходованием АТФ и УТФ (реакции 1 и 3).Образованная УДФ-глюкоза (реакция 3) является субстратом для гликогенсинтазы, которая переносит остаток глюкозы (реакция 4) на праймер (олигосахарид из 4-8 остатков глюкозы) и соединяет его α-1,4-глюкозной связью.
Слайд 7
Синтез гликогена
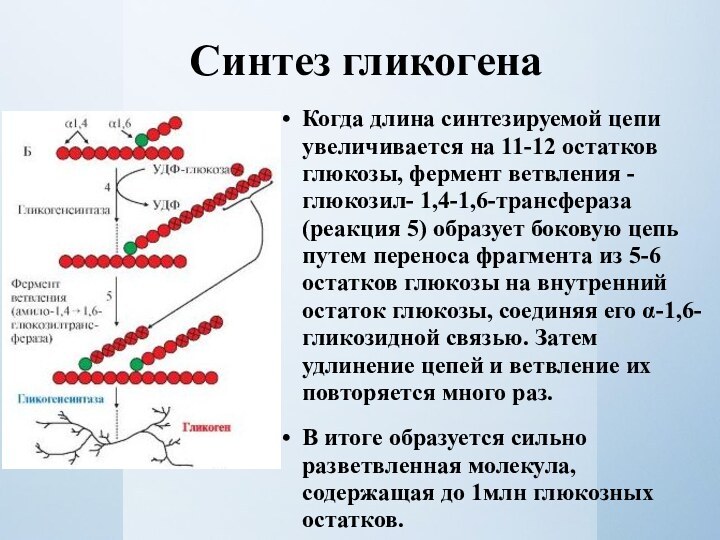
Когда длина синтезируемой цепи увеличивается на 11-12
остатков глюкозы, фермент ветвления - глюкозил- 1,4-1,6-трансфераза (реакция 5)
образует боковую цепь путем переноса фрагмента из 5-6 остатков глюкозы на внутренний остаток глюкозы, соединяя его α-1,6-гликозидной связью. Затем удлинение цепей и ветвление их повторяется много раз.В итоге образуется сильно разветвленная молекула, содержащая до 1млн глюкозных остатков.
Слайд 9
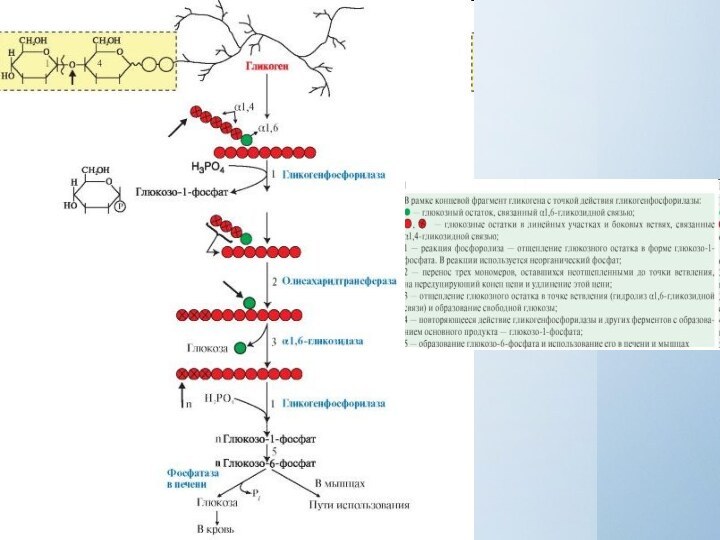
Мобилизация (распад) гликогена
Мобилизация (распад) гликогена
происходит в интервалах между приемами пищи (постабсорбтивный период) и
ускоряется во время физической работы. Этот процесс осуществляется путем последовательного отщепления остатков глюкозы, в виде глюкозо-1-фосфата (реакция 1) с помощью гликогенфосфорилазы, расщепляющей α-1,4-гликозидные связи. Этот фермент не расщепляет α-1,6-гликозидные связи в местах разветвлений, поэтому необходимы еще два фермента, после действия которых остаток глюкозы в точке ветвления освобождается в форме свободной глюкозы (реакции 2 и 3). Гликоген распадается до глюкозо-6-фосфата и свободной глюкозы без затрат АТФ.
Слайд 10
Мобилизация (распад) гликогена
Мобилизация гликогена в печени
отличается от таковой в мышцах одной реакцией (реакция 5),
обусловленной наличием в печени фермента глюкозо-6-фосфатазы.Присутствие в печени глюкозо-6-фосфатазы обеспечивает главную функцию гликогена печени - высвобождение глюкозы в кровь в интервалах между едой для использования ее другими органами.
Таким образом, мобилизация гликогена печени обеспечивает поддержание глюкозы в крови на постоянном уровне 3,3-5,5 ммоль в постабсорбтивном периоде. Это обстоятельство является обязательным условием для работы других органов и особенно мозга. Через 10-18 часов после приема пищи запасы гликогена в печени значительно истощаются, а голодание в течение 24 часов приводит к полному его исчерпанию.
Слайд 12 Переключение процессов синтеза и мобилизации гликогена в печени
и мышцах происходит при переходе из абсорбтивного состояния в
постабсорбтивное и из состояния покоя в режим физической работы. В переключении этих метаболических путей в печени участвуют инсулин, глюкагон и адреналин, а в мышцах - инсулин и адреналин.Слайд 13 Влияние этих гормонов на синтез и распад гликогена
осуществляется путем изменения в противоположном направлении активности двух ключевых
ферментов: гликогенсинтазы и гликогенфосфорилазы с помощью их фосфорилирования и дефосфорилирования.Слайд 14 Первичным сигналом для синтеза инсулина и глюкагона является
изменение концентрации глюкозы в крови. Инсулин и глюкагон постоянно
присутствуют в крови, но при переходе из абсорбтивного периода в постабсорбтивный изменяется их относительная концентрация. Отношение концентраций инсулина и глюкагона в крови называют инсулин-глюкагоновым индексом, в зависимости от которого изменяется направление метаболизма гликогена в печени.
Слайд 15
Регуляция метаболизма гликогена в печени
В период
пищеварения концентрация глюкозы в крови повышается до 10-12 ммоль/л,
и это является сигналом для синтеза и секреции инсулина. Концентрация инсулина увеличивается, и его влияние является преобладающим. Инсулин-глюкагоновый индекс в этом случае повышается.
Слайд 16
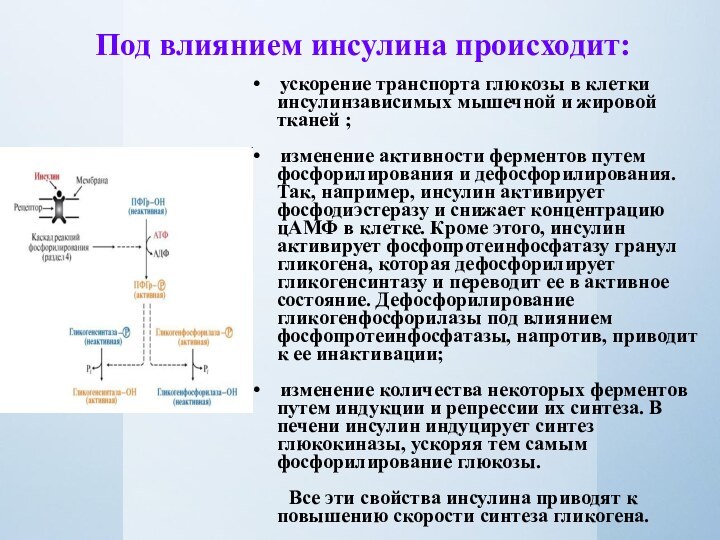
Под влиянием инсулина происходит:
• ускорение транспорта глюкозы
в клетки инсулинзависимых мышечной и жировой тканей ;
•
изменение активности ферментов путем фосфорилирования и дефосфорилирования. Так, например, инсулин активирует фосфодиэстеразу и снижает концентрацию цАМФ в клетке. Кроме этого, инсулин активирует фосфопротеинфосфатазу гранул гликогена, которая дефосфорилирует гликогенсинтазу и переводит ее в активное состояние. Дефосфорилирование гликогенфосфорилазы под влиянием фосфопротеинфосфатазы, напротив, приводит к ее инактивации;• изменение количества некоторых ферментов путем индукции и репрессии их синтеза. В печени инсулин индуцирует синтез глюкокиназы, ускоряя тем самым фосфорилирование глюкозы.
Все эти свойства инсулина приводят к повышению скорости синтеза гликогена.
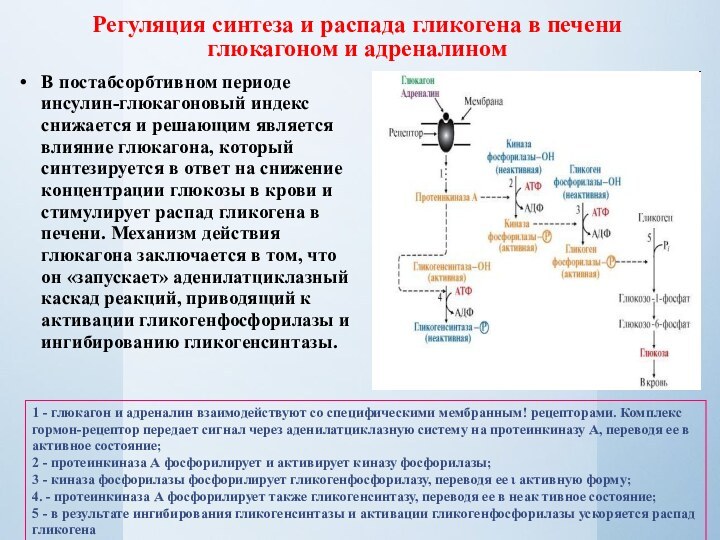
Слайд 17 Регуляция синтеза и распада гликогена в печени глюкагоном
и адреналином
В постабсорбтивном периоде инсулин-глюкагоновый индекс снижается и решающим
является влияние глюкагона, который синтезируется в ответ на снижение концентрации глюкозы в крови и стимулирует распад гликогена в печени. Механизм действия глюкагона заключается в том, что он «запускает» аденилатциклазный каскад реакций, приводящий к активации гликогенфосфорилазы и ингибированию гликогенсинтазы.1 - глюкагон и адреналин взаимодействуют со специфическими мембранным! рецепторами. Комплекс гормон-рецептор передает сигнал через аденилатциклазную систему на протеинкиназу А, переводя ее в активное состояние;
2 - протеинкиназа А фосфорилирует и активирует киназу фосфорилазы;
3 - киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя ее ι активную форму;
4. - протеинкиназа А фосфорилирует также гликогенсинтазу, переводя ее в неак тивное состояние;
5 - в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы ускоряется распад гликогена
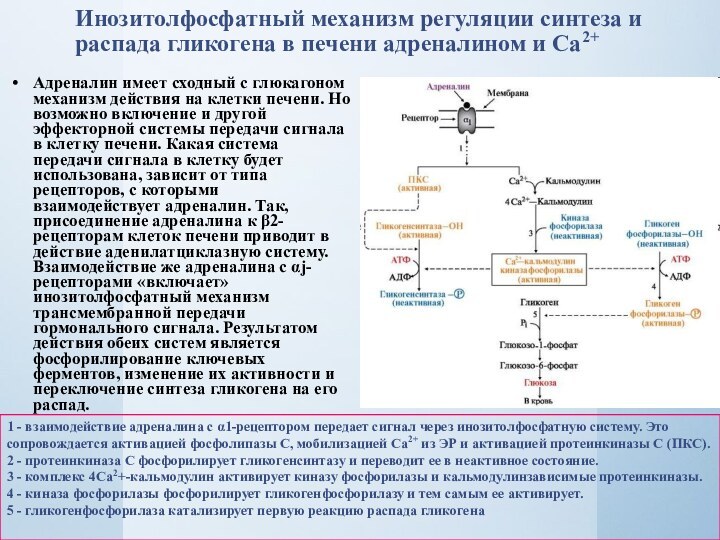
Слайд 18 Инозитолфосфатный механизм регуляции синтеза и распада гликогена в
печени адреналином и Са2+
Адреналин имеет сходный с глюкагоном
механизм действия на клетки печени. Но возможно включение и другой эффекторной системы передачи сигнала в клетку печени. Какая система передачи сигнала в клетку будет использована, зависит от типа рецепторов, с которыми взаимодействует адреналин. Так, присоединение адреналина к β2-рецепторам клеток печени приводит в действие аденилатциклазную систему. Взаимодействие же адреналина с αj-рецепторами «включает» инозитолфосфатный механизм трансмембранной передачи гормонального сигнала. Результатом действия обеих систем является фосфорилирование ключевых ферментов, изменение их активности и переключение синтеза гликогена на его распад.1 - взаимодействие адреналина с α1-рецептором передает сигнал через инозитолфосфатную систему. Это сопровождается активацией фосфолипазы С, мобилизацией Сa2+ из ЭР и активацией протеинкиназы С (ПКС).
2 - протеинкиназа С фосфорилирует гликогенсинтазу и переводит ее в неактивное состояние.
3 - комплекс 4Са2+-кальмодулин активирует киназу фосфорилазы и кальмодулинзависимые протеинкиназы.
4 - киназа фосфорилазы фосфорилирует гликогенфосфорилазу и тем самым ее активирует.
5 - гликогенфосфорилаза катализирует первую реакцию распада гликогена
Слайд 19
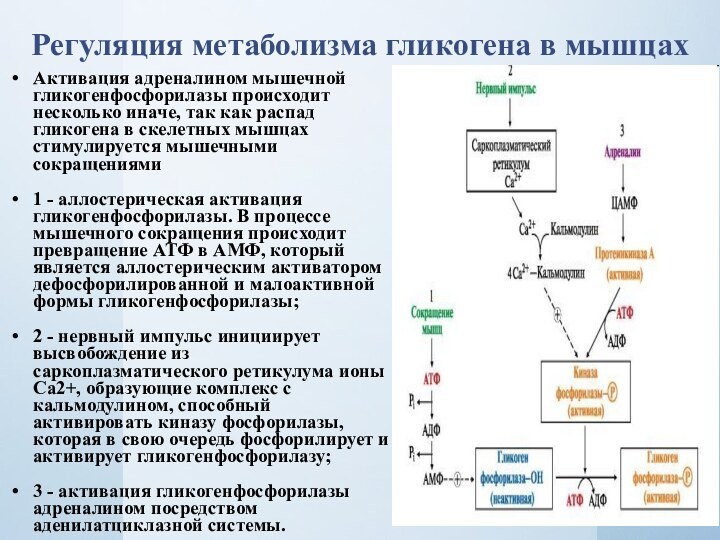
Регуляция метаболизма гликогена в мышцах
Активация адреналином мышечной гликогенфосфорилазы
происходит несколько иначе, так как распад гликогена в скелетных
мышцах стимулируется мышечными сокращениями1 - аллостерическая активация гликогенфосфорилазы. В процессе мышечного сокращения происходит превращение АТФ в АМФ, который является аллостерическим активатором дефосфорилированной и малоактивной формы гликогенфосфорилазы;
2 - нервный импульс инициирует высвобождение из саркоплазматического ретикулума ионы Са2+, образующие комплекс с кальмодулином, способный активировать киназу фосфорилазы, которая в свою очередь фосфорилирует и активирует гликогенфосфорилазу;
3 - активация гликогенфосфорилазы адреналином посредством аденилатциклазной системы.
Слайд 20 При интенсивной мышечной работе киназа фосфорилазы (Са2+ -зависимая)
активируется под влиянием нервного импульса, так как в саркоплазме
в этом случае возрастает концентрация ионов кальция. Результатом действия адреналина в мышцах также является активация цАМФ зависимой протеинкиназы (ПКА) и активация гликогенфосфорилазы путем ее фосфорилирования (пути 2 и 3).При умеренной физической нагрузке и в состоянии покоя, когда уровень цАМФ в клетке низкий и гликогенфосфорилаза находится в дефосфорилированном состоянии, в мышцах действует другой механизм активации гликогенфосфорилазы - аллостерический. Активатором фермента служит АМФ, образующаяся при распаде АТФ (путь 1).
Слайд 21
Значение регуляции обмена гликогена.
При передаче гормонального сигнала через
внутриклеточные посредники происходит значительное его усиление, поэтому активация фосфорилазы
гликогена при участии любой системы передачи сигнала в клетку печени позволяет быстро получить большое количество глюкозы из гликогена. Усиление гормонального сигнала в мышцах имеет большое значение для обеспечения энергетическим материалом интенсивной работы в условиях стресса, например при бегстве от опасности.При смене постабсорбтивного состояния на абсорбтивное или по окончании мышечной работы вся система возвращается в исходное состояние. Аденилатциклаза и фосфолипаза С инактивируются, цАМФ разрушается фосфодиэстеразой, а фосфопротеинфосфатаза вызывает переход всех внутриклеточных ферментов «каскада» в дефосфорилированную форму.
Слайд 22 Итак, регуляция скоростей синтеза и распада гликогена в
печени поддерживает постоянство концентрации глюкозы в крови (3,3-5,5 ммоль/л).
Регуляция обмена гликогена в мышцах обеспечивает энергетическим материалом как интенсивную работу мышц, так и энергозатраты в состоянии покоя.
Слайд 24 Глюконеогенез - это процесс синтеза глюкозы из
веществ неуглеводной природы.
Субстратами глюконеогенеза являются:
пируват,
лактат,
глицерол,
аминокислоты.
Слайд 25 Важнейшей функцией глюконеогенеза является поддержание уровня глюкозы в
крови в период длительного голодания и интенсивных физических нагрузок.
Постоянное поступление глюкозы в качестве источника энергии особенно необходимо для нервной ткани и эритроцитов.Слайд 26 Процесс протекает главным образом в печени и
менее интенсивно - в корковом веществе почек, а также
в слизистой оболочке кишечника.Включение различных субстратов в глюконеогенез зависит от физиологического состояния организма:
- лактат является продуктом анаэробного гликолиза в эритроцитах, работающих мышцах и других тканях с низким содержанием О2;
- глицерол высвобождается при гидролизе жиров в жировой ткани в постабсорбтивный период или при физической нагрузке;
- аминокислоты образуются в результате распада белков мышц и соединительной ткани и включаются в глюконеогенез при длительном голодании или продолжительной мышечной нагрузке.
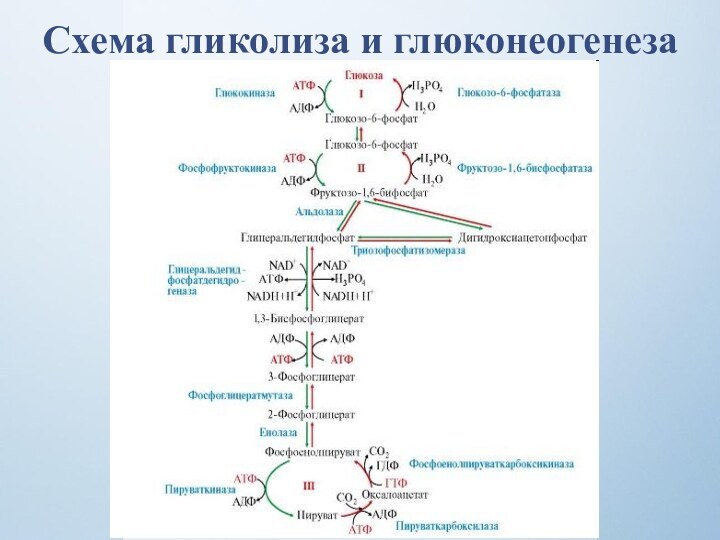
Большинство реакций гликолиза и глюконеогенеза являются обратимыми и катализируются одними и теми же ферментами, что и гликолиз. Четыре реакции глюконеогенеза необратимы.
Слайд 28
Суммарное уравнение глюконеогенеза
2 Пируват + 4 АТФ +
2 ГТФ + 2 (НАДН+Н+) + 4 Н2О
1 Глюкоза
+ 4 АДФ + 2 ГДФ + 6 Н3РО4 + 2 НАДН+
Слайд 29
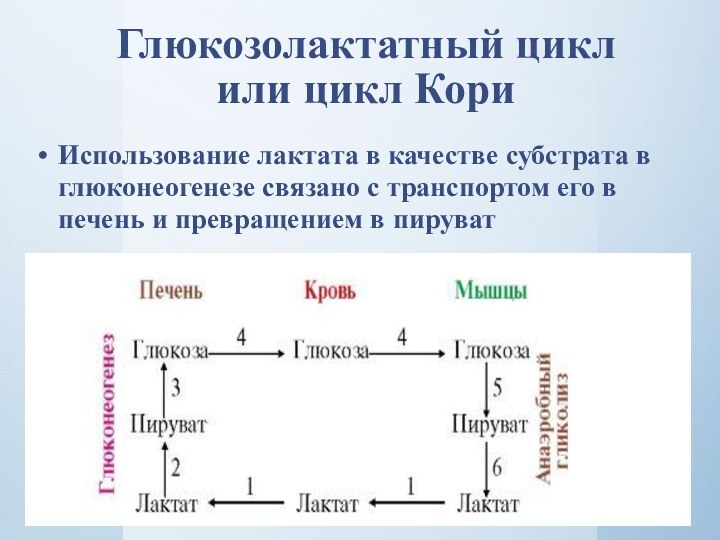
Глюкозолактатный цикл или цикл Кори
Использование лактата в качестве
субстрата в глюконеогенезе связано с транспортом его в печень
и превращением в пируват
Слайд 31
Обмен углеводов в печени
Одной из важнейших функций печени
в процессах обмена веществ является ее участие в поддержании
постоянного уровня глюкозы в крови (глюкостатическая функция): глюкоза, поступающая в избытке, превращается в резервную форму, которая используется в период, когда пища поступает в ограниченном количестве.Энергетические потребности самой печени, как и других тканей организма, удовлетворяется за счет внутриклеточного катаболизма поступающей глюкозы.
Слайд 32
Обмен углеводов в печени
В печени катаболизм глюкозы представлен
2 процессами: 1) гликолитический путь превращения 1 моль глюкозы
в 2 моль лактата с образованием 2 моль АТФ и2) пентозофосфатный путь превращения 1 моль глюкозы в 6 моль СО2 с образованием 12 моль НАДФН. Оба процесса протекают в анаэробных условиях, обе ферментативные системы содержатся в растворимой части цитоплазмы, оба пути требуют предварительного фосфорилирования глюкозы.
Слайд 33
Обмен углеводов в печени
Гликолиз обеспечивает энергией клеточные реакции
фосфорилирования, синтез белка; пентозофосфатный путь служит источником энергии восстановления
для синтеза жирных кислот, стероидов.
Слайд 34
Обмен углеводов в печени
При аэробных условиях происходит сочетание
гликолиза, протекающего в цитоплазме и цикла лимонной кислоты с
окислительным фосфорилированием в митохондриях достигается максимальноый выход энергии в 38 АТФ на 1 моль глюкозы. Фосфотриозы, образующиеся в процессе гликолиза, могут быть использованы для синтеза -глицерофосфата, необходимого для синтеза жиров. Пируват, который образуется при гликолизе, может быть использован для синтеза аланина, аспартата и других соединений, через стадию образования оксалоацетата. В печени реакции гликолиза могут протекать в обратном направлении и тогда происходит синтез глюкозы путем глюконеогенеза. В пентозофосфотном пути образуются пентозы, необходимые для синтеза нуклеиновых кислот. В отличие от гликолиза фосфоглюконатный путь необратим и здесь окисляется 1/3 глюкозы, 2/3 глюкозы окисляются по гликолитическому пути.
Слайд 35
Обмен углеводов в печени
В печени протекают гликогенез и
гликогенолиз. Эти процессы взаимосвязаны и регулируются как внутри –
так и внеклеточными соотношениями между поступлением и потреблением глюкозы.
Слайд 36
Обмен углеводов в мышцах
Цель мышечной клетки –
наиболее эффективно использовать поступающую глюкозу для образования АТФ, необходимого
для осуществления механической работы – сокращения. В состоянии покоя значительные количества глюкозы резервируются в форме гликогена. Цитоплазма мышечных клеток содержит в высоких концентрациях ферменты гликолиза, а изобилие митохондрий обеспечивает эффективный распад продуктов гликолиза через путь лимонной кислоты и цепь переноса электронов. Лишь в условиях крайнего утомления эти аэробные процессы не справляются с накоплением лактата.
Слайд 37
Обмен углеводов в мышцах
В мышцах идет гликогенез,
мышца осуществляет лишь немногие синтетические функции. Ключевые ферменты глюконеогенеза
в мышцах отсутствуют, и глюконеогенез не идет. Для восстановительных синтезов в мышце НАДФН не требуется, и пентозофосфатный путь почти не функционирует.Обмен углеводов в мышцах обеспечивает создание тканевых запасов гликогена в состоянии покоя и использование этих запасов, а также поступающей глюкозы при напряженной работе; основные энергетические потребности всех типов мышц удовлетворяются главным образом за счет окисления продуктов обмена жиров. Ни медленно сокращающаяся гладкая мышечная ткань, ни сердечная мышца не потребляют глюкозу в значительной мере. Во время напряженной работы сердце обеспечивает себя лактатом для окисления.
Слайд 38
Обмен углеводов в мышцах
Фосфорилирование глюкозы в мышцах происходит
под дейстием гексокиназы, в печени этот процесс катализируется глюкокиназой.
Эти ферменты отличаются по Кm.Кm≤ 0,1 ммоль/л гексокиназы значительно ниже Кm = 10 ммоль/л глюкокиназы. Фермент мышц – гексокиназа участвует во внутриклеточной регуляции, т.е. этот фермент будет фосфорилировать глюкозу только до тех пор, пока глюкозо-6-ф используется в мышцах для гликолиза или образования гликогена.
Другое важнейшее различие между тканью печени и мышцы состоит в отсутствии в мышцах фермента глюкозо-6-фасфатазы.
Слайд 39
Обмен углеводов в мозге
По сравнению со всеми
органами тела функций мозга в наибольшей степени зависит от
обмена углеводов. Если в крови, поступающей к мозгу, концентрация глюкозы становится вдвое ниже нормальной, то в течение нескольких секунд наступает потеря сознания, а через несколько минут – смерть. Для того чтобы обеспечить освобождение достаточного количества энергии, катаболизм глюкозы должен осуществляться в соответствии с аэробными механизмами; об этом свидетельствует даже более низкая чувствительность мозга к гипоксии, чем гипогликемии. Метаболизм глюкозы в мозге обеспечивает синтез нейромедиаторов, аминокислот, липидов, компонентов нуклеиновых кислот. Пентозофосфатный путь функционирует в небольшой мере, обеспечивая НАДФН для некоторых из этих синтезов. Основной катаболизм глюкозы в ткани мозга протекает по гликолитическому пути.Гексокиназа мозга имеет высокое сродство к глюкозе, что обеспечивает эффективное использование глюкозы мозгом. Активность ферментов гликолиза велика.
Слайд 40
Обмен углеводов в мозге
Высокая активность митохондриальных ферментов
цикла лимонной кислоты предотвращает накопление лактата в тканях мозга;
большая часть пирувата окисляется до Ацетил-КоА. Небольшая часть Ацетил-КоА используется для образования нейромедиатора ацетилхолина. Основное количество Ацетил-КоА подвергается окислению в цикле лимонной кислоты и дает энергию. Метаболизм цикла Кребса используется для синтеза аспартата и глутамата. Эти аминокислоты обеспечивают обезвреживание аммиака в тканях мозга.Мозг содержит мало гликогена (0,1% от общего веса); этот запас расходуется очень быстро.
В условиях длительного голодания мозг использует как источник энергии кетоновые тела. В крайних случаях такие аминокислоты как глутамат и аспартат превращаются в соответствующие кетокислоты, которые способны к окислению с образованием энергии.
Слайд 41
Обмен углеводов в эритроцитах
Эритроциты не содержат ядра, митохондрий.
В эритроците не идут реакции цикла лимонной кислоты, в
них нет ферментов дыхательной цепи. Парадоксальным является тот факт, что эритроцит, перенося кислород для тканей, сам его не использует и получает энергию за счет аэробных процессов.Основным процессом в эритроцитах, который дает энергию, является анаэробный гликолиз. При расщеплении фру-6-фф образуется НАДН, необходимый для восстановления избытка метгемоглобина (окисленной формы гемоглобина, не связывающей О2).
Побочным продуктом гликолиза в эритроцитах является 2,3-дифосфоглицерат. 2,3-дифосфоглицерат связывается с гемоглобином, уменьшает его сродство к О2 и, облегчает освобождение кислорода в тканях.
Пентозофосфатный путь в норме составляет лишь небольшую долю в катаболизме глюкозы. В условиях повышенной потребности в НАДФН этот процесс активизируется. НАДФН необходим для того, чтобы поддерживать внутриклеточный восстановитель, глутатион, в его восстановленной SH-форме. Воздействие агентов, ускоряющих окисление глутатиона в S-S-форму, активирует реакции пентозофосфатного пути, которые обеспечивают образование восстановленных эквивалентов в форме НАДФН+Н+.
Слайд 42
Особенности обмена глюкозы
в клетках опухoли
В клетках опухоли
отмечается повышенная активность гексокиназы, что приводит к быстрому поглощению
и окислению глюкозы. Опухолевая клетка является насосом, который выкачивает глюкозу из кровотока. В условиях быстро растущей опухоли система кровеносных сосудов отстает от роста опухоли и в таких клетках протекает анаэробный гликолиз, который и дает энергию для роста клеток. Выход энергии при анаэробном гликолизе составляет 2 моль АТФ и поэтому процесс должен идти с большой скоростью, чтобы обеспечить клетки опухоли энергией. Вследствие быстрого окисления глюкозы возникает гипогликемия. Возникновение гипогликемии вызывает ускорение глюконеогенеза и глюкоза начинает синтезироваться из аминокислот. Следствием синтеза глюкозы из аминокислот является падение веса у больных и развивается раковая кахексия.Мембранная гексокиназа – работает как насос.
Гипогликемия.
Анаэробный гликолиз.
«Принудительный» глюконеогенез.
Раковая кахексия.