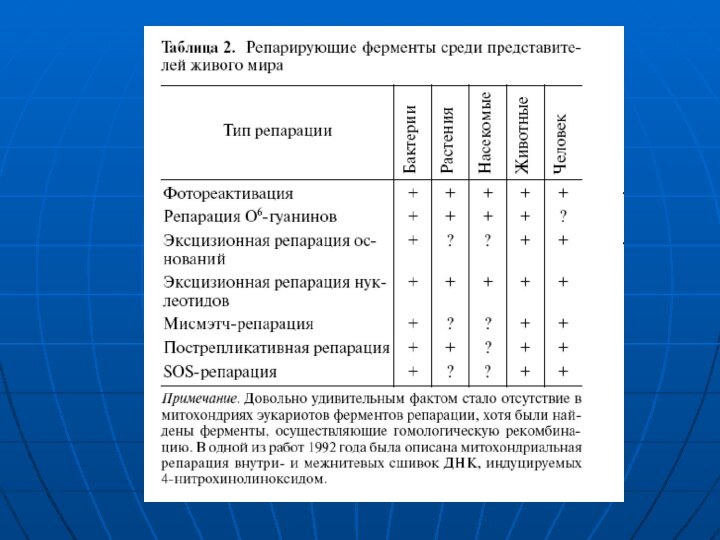
Слайд 2
Агенты повреждающие ДНК
Излучение
ионизирующая радиация (гамма лучи, рентгеновские лучи)
ультрафиолетовое
излучение (особенно ~260 нм, именно в этой области происходит
максимальное поглощение ДНК)
Активные радикалы кислорода, образуемые во время нормального клеточного дыхания в различных биохимических путях
Химические вещества окружающей среды
Многие углеводороды
Химикаты используемые в противоопухолевой химотерапии.
Слайд 3
Типы повреждения ДНК
Изменение одного основания
Апуринизация
Замена С на У
Замена
А на гипоксантин
Алкилирование основания
Вставка или делеция нуклеотида
Встраивание аналогичного основания
Изменение
двух оснований
Образование тиминовых димеров
Поперечная связь с бифункиональным алкилирующим агентом
Разрушение цепи
Радиоактивное разрушение элементов остова
Поперечные связи между между основаниями одной нити или двух параллельных нитей, между ДНК и белковыми молекулами, например гистонами
Слайд 4
Слева - Нормальная молекула ДНК (фрагмент) и схемы
образования наиболее частых повреждений – дезаминирования и апуринизации.
При
дезаминировании цитозин превращается в урацил, а аденин - в гипоксантин.
Если разрывается связь между остатком дезоксирибозы и пуриновым основанием (здесь аденин и гуанин), в этом месте остается только сахарофосфатный остов, т.е. возникает апуриновый сайт.
Слайд 5
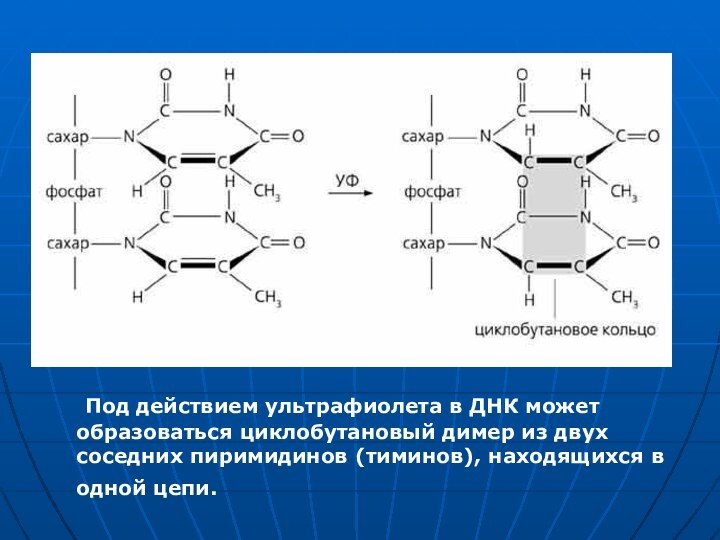
Под действием ультрафиолета в ДНК может образоваться циклобутановый
димер из двух соседних пиримидинов (тиминов), находящихся в одной
цепи.
Слайд 6
Повреждения, которые могут возникать в ДНК спонтанно или
под действием разных агентов.
Слайд 7
Репарация поврежденных оснований
Поврежденные основания могут быть исправлены различными
путями:
Прямое химическое исправление повреждений
Эксцизионная репарация (ER), при которой
поврежденное основание удаляется и заменяется новым
1. Эксцизионная репарация оснований (BER- Base Excision Repair)
2. Эксцизионная репарация нуклеотидов (NER - Nucleotide Excision Repair).
3. Мисмэтч репарация (MMR).
Слайд 8
Прямое исправление повреждений
Наиболее частая причина точечных мутаций у
человека - это спонтанное добавление метильной группы - один
из типов алкилирования. Такие модификации исправляются ферментами называемыми гликозилазами, исправляющими ошибку без разрушения цепи ДНК.
Некоторые препараты используемые в химотерапии также повреждают ДНК путем алкилирования.
Проблема репарации состоит в том, что ограниченным набором ферментов и механизмов клетка должна справиться со многими повреждениями, вызванными самыми различными химическими и физическими агентами.
Слайд 9
Обобщенная схема восстановления нормальной структуры ДНК
Дефектным может быть
одиночное основание, и тогда вырезается только нуклеотид;
в случае
более объемного повреждения из цепи удаляются и соседние с ним нуклеотиды, а образовавшуюся брешь застраивают полимеразы - или самостоятельно, или в присутствии белка PCNA (proliferating cell nuclear antigen) .
Слайд 10
ДНК-полимеразы β и λ присоединяют всего один нуклеотид
(short patch путь BER).
ДНК-полимеразы - δ и ε способны
создать большую вставку (long patch путь BER), но для этого им нужен специальный белок PCNA (proliferating cell nuclear antigen).
Особенно зависима от PCNA ДНК-полимераза δ, без PCNA фермент “отваливается” от ДНК, встроив лишь один нуклеотид, а если PCNA удерживает на ней полимеразу δ, то синтез идет до тех пор, пока фрагмент не достигнет нужной длины.
Если в клетке не хватает той или иной ДНК-полимеразы, репарация может переключиться с одного пути на другой - long patch путь BER.
Слайд 11
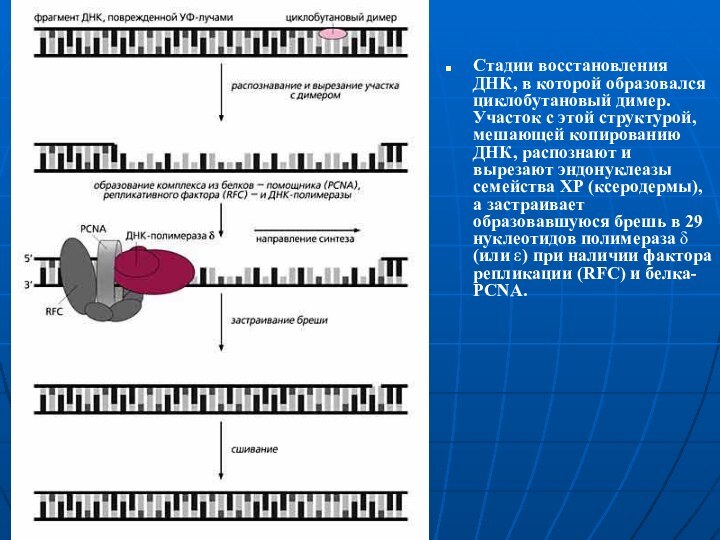
Стадии восстановления ДНК, в которой образовался циклобутановый димер.
Участок с этой структурой, мешающей копированию ДНК, распознают и
вырезают эндонуклеазы семейства ХР (ксеродермы), а застраивает образовавшуюся брешь в 29 нуклеотидов полимераза δ (или ε) при наличии фактора репликации (RFC) и белка- PCNA.
Слайд 12
Эксцизионная репарация оснований (BER)
Основные ключевые события:
1. Удаления
поврежденного основания (происходит ~ 20,000 раз в день в
каждой клетке человеческого тела) ДНК гликозилазами. У человека имеется, по крайней мере, 8 генов, кодирующих различные ДНК гликозилазы, каждые из которых распознают свой набор поврежденных оснований.
2. Удаление дезоксирибофосфата приводит к образованию пустоты в ДНК.
3. Замена правильным нуклеотидом. Это функция у человека выполняется ДНК полимеразой β.
4. Лигирование разрыва цепи. Имеется два фермента, оба нуждаются в АТР.
Слайд 13
Эксцизионная репарация нуклеотидов (NER)
Основные ключевые события NER:
1.Повреждение распознается одним или несколькими факторами, связывающимися с местом
повреждения.
2. ДНК раскручивается в месте повреждения. В этом процессе участвуют различные транскрипционные факторы IIH, TFIIH, (которые так же работают при нормальной транскрипции).
3. Разрез ДНК происходит с 3' и 5'-конца от повреждения, в результате чего удаляется фрагмент ДНК, содержащий поврежденный нуклеотид.
4. Новая цепь ДНК достраивается по матрице неповрежденной цепи ДНК полимеразами δ или ε.
5. Лигазы сшивают вновь синтезированный конец цепи.
Слайд 14
NER
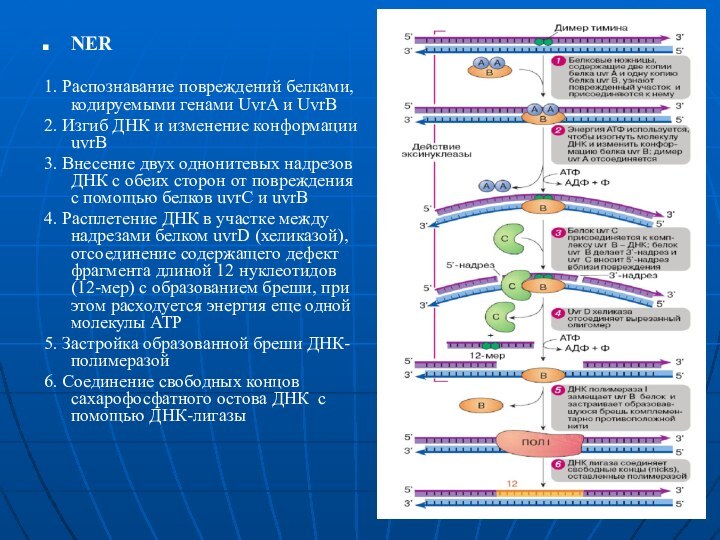
1. Распознавание повреждений белками, кодируемыми генами UvrA и
UvrB
2. Изгиб ДНК и изменение конформации uvrB
3. Внесение двух
однонитевых надрезов ДНК с обеих сторон от повреждения с помощью белков uvrС и uvrB
4. Расплетение ДНК в участке между надрезами белком uvrD (хеликазой), отсоединение содержащего дефект фрагмента длиной 12 нуклеотидов (12-мер) с образованием бреши, при этом расходуется энергия еще одной молекулы АТР
5. Застройка образованной бреши ДНК-полимеразой
6. Соединение свободных концов сахарофосфатного остова ДНК с помощью ДНК-лигазы
Слайд 15
Мисмэтч репарация(MMR)
Мисмэтч репарация исправляет ошибочно встроенные неповрежденные основания,
которые не образуют нормальное Уотсон-Криковское спаривание (A•T, C•G).
Такие
ошибки происходят во время работы ДНК полимеразы при репликации.
В мисмэтч репарации участвуют ферменты, вовлеченные в BER, NER репарацию и специализированные ферменты.
Синтез ДНК при мисмэтч репарации осуществляется ДНК полимеразами δ или ε.
Система мисмэтч репарации участвует в увеличении точности рекомбинации при мейозе.
Слайд 16
Репарация неправильно спаренного участка (мисмэтча) у E.coly. Двойная
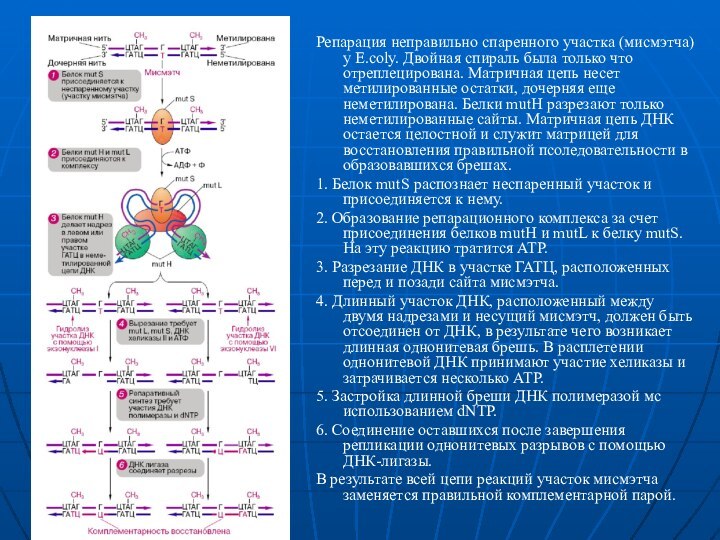
спираль была только что отреплецирована. Матричная цепь несет метилированные
остатки, дочерняя еще неметилирована. Белки mutH разрезают только неметилированные сайты. Матричная цепь ДНК остается целостной и служит матрицей для восстановления правильной псоледовательности в образовавшихся брешах.
1. Белок mutS распознает неспаренный участок и присоединяется к нему.
2. Образование репарационного комплекса за счет присоединения белков mutH и mutL к белку mutS. На эту реакцию тратится АТР.
3. Разрезание ДНК в участке ГАТЦ, расположенных перед и позади сайта мисмэтча.
4. Длинный участок ДНК, расположенный между двумя надрезами и несущий мисмэтч, должен быть отсоединен от ДНК, в результате чего возникает длинная однонитевая брешь. В расплетении однонитевой ДНК принимают участие хеликазы и затрачивается несколько АТР.
5. Застройка длинной бреши ДНК полимеразой мс использованием dNTP.
6. Соединение оставшихся после завершения репликации однонитевых разрывов с помощью ДНК-лигазы.
В результате всей цепи реакций участок мисмэтча заменяется правильной комплементарной парой.
Слайд 17
Репарация разрывов ДНК
Ионизирующая радиация и некоторые химические вещества
способны разорвать одну или две цепи ДНК.
Одноцепочечные разрывы (SSB).
Разрывы одной из цепей ДНК часто исправляются ферментами, участвующими в BER репарации.
Двуцепочечные разрывы (DSB). Имеется два механизма, которые способны устранить двуцепочечных разрывов ДНК:
1. Прямое соединение сломанных концов. Этот процесс требует специальных ферментов, которые узнают и связывают разорванные концы с последующим их сшиванием.
2. Если разорванная ДНК имеет тупые концы и соединение двух фрагментов ДНК происходит случайно, то такая репарация называется NHEJ (Nonhomologous End-Joining)..
Для NHEJ необходим белок Ku. Ku - гетеродимерная субъединица, состоящая из двух белков Ku70 и Ku80.
Ошибки, возникающие при прямом присоединении могут являться причиной транслокаций.
Слайд 18
Восстановление последовательности ДНК, в которой разорваны обе цепи,
способом
гомологичной рекомбинации.
Характерен для дрожжей (Saccharomyces cerevisiae)
Слайд 19
Последовательность реконструкции ДНК, в которой разорваны обе цепи,
соединением негомологичных концов.
Характерен для млекопитающих, в том числе
для человека.
Слайд 20
Пострепликативная репарация ДНК
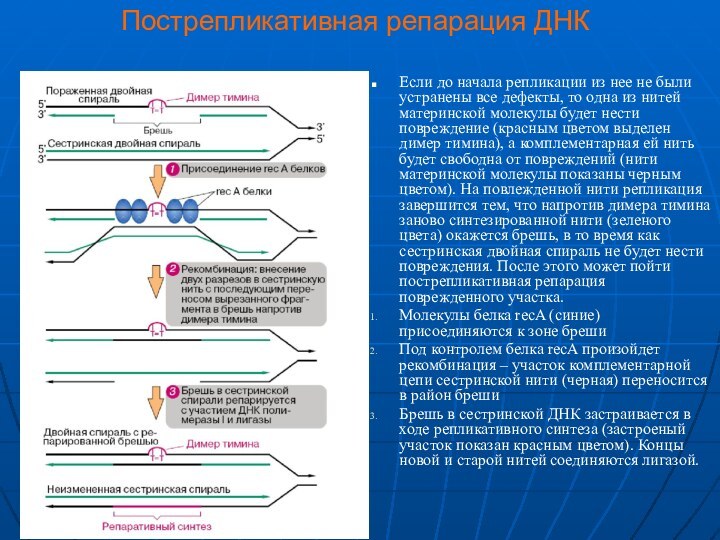
Если до начала репликации из нее
не были устранены все дефекты, то одна из нитей
материнской молекулы будет нести повреждение (красным цветом выделен димер тимина), а комплементарная ей нить будет свободна от повреждений (нити материнской молекулы показаны черным цветом). На повлежденной нити репликация завершится тем, что напротив димера тимина заново синтезированной нити (зеленого цвета) окажется брешь, в то время как сестринская двойная спираль не будет нести повреждения. После этого может пойти пострепликативная репарация поврежденного участка.
Молекулы белка recA (синие) присоединяются к зоне бреши
Под контролем белка recA произойдет рекомбинация – участок комплементарной цепи сестринской нити (черная) переносится в район бреши
Брешь в сестринской ДНК застраивается в ходе репликативного синтеза (застроеный участок показан красным цветом). Концы новой и старой нитей соединяются лигазой.
Слайд 22
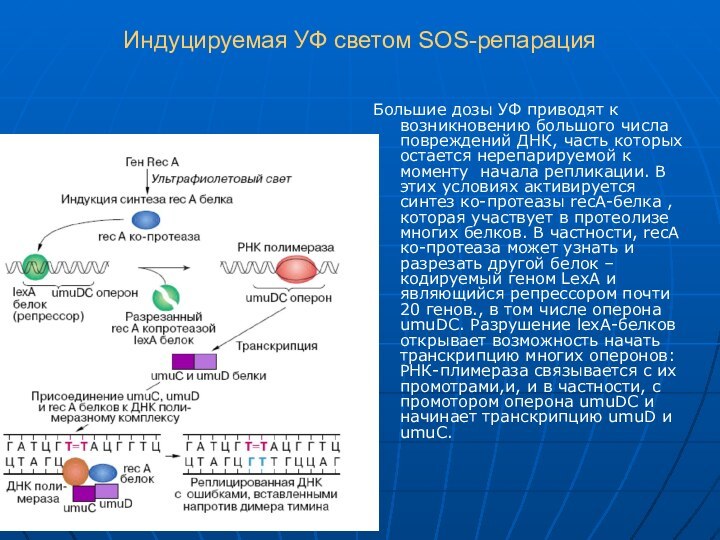
Индуцируемая УФ светом SOS-репарация
Большие дозы УФ приводят к
возникновению большого числа повреждений ДНК, часть которых остается нерепарируемой
к моменту начала репликации. В этих условиях активируется синтез ко-протеазы recA-белка , которая участвует в протеолизе многих белков. В частности, recА ко-протеаза может узнать и разрезать другой белок – кодируемый геном LexA и являющийся репрессором почти 20 генов., в том числе оперона umuDC. Разрушение lexA-белков открывает возможность начать транскрипцию многих оперонов: РНК-плимераза связывается с их промотрами,и, и в частности, с промотором оперона umuDC и начинает транскрипцию umuD и umuC.
Слайд 23
Гипотетическая схема устранения межцепочечных сшивок ДНК.