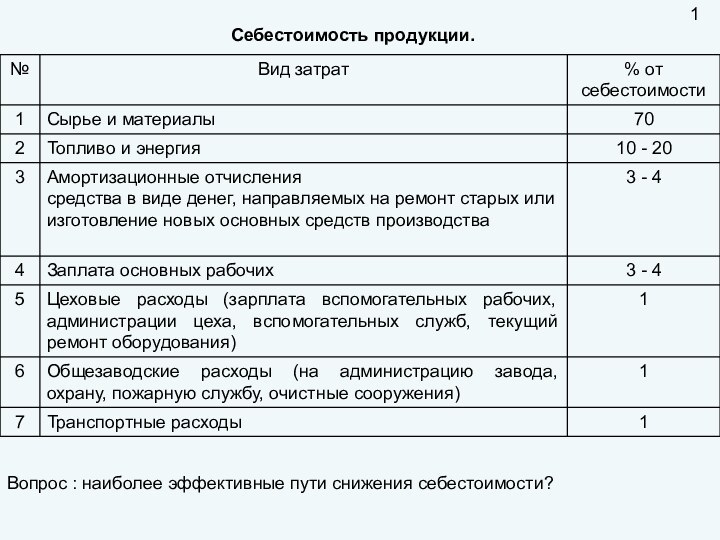
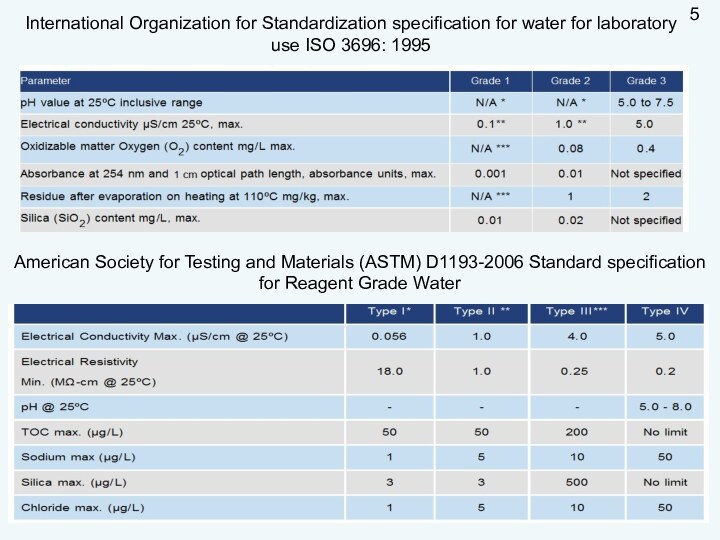
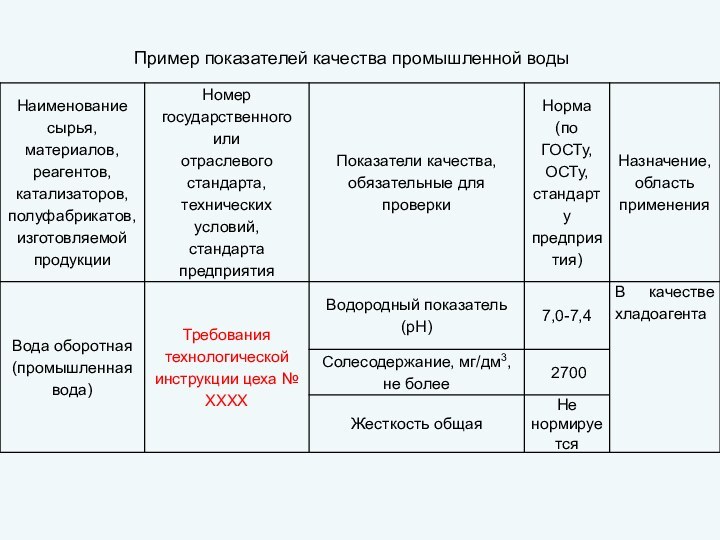
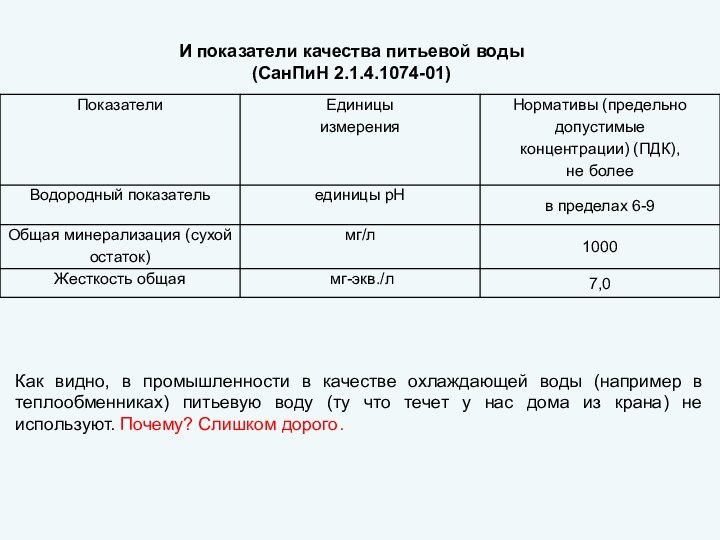
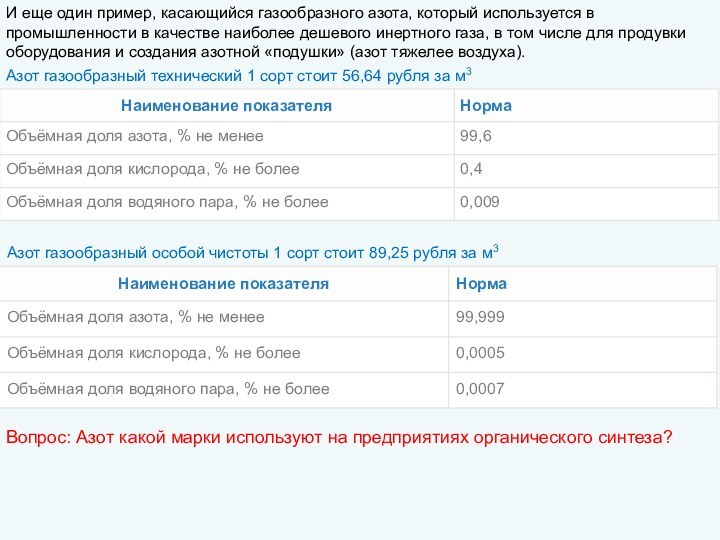
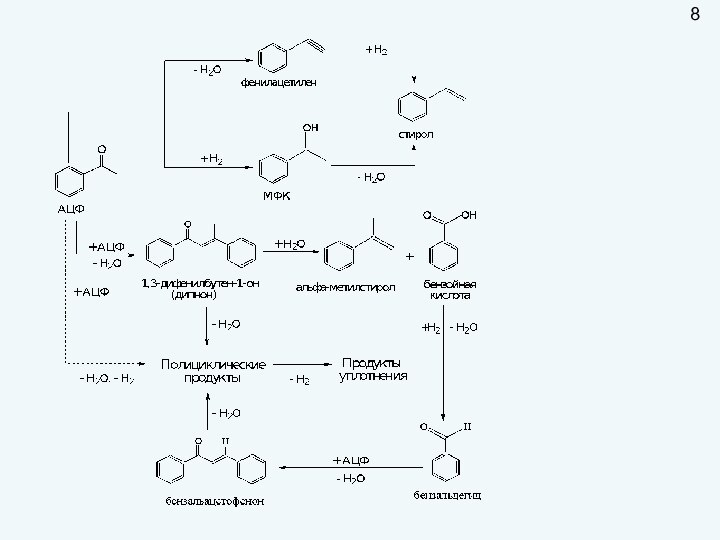
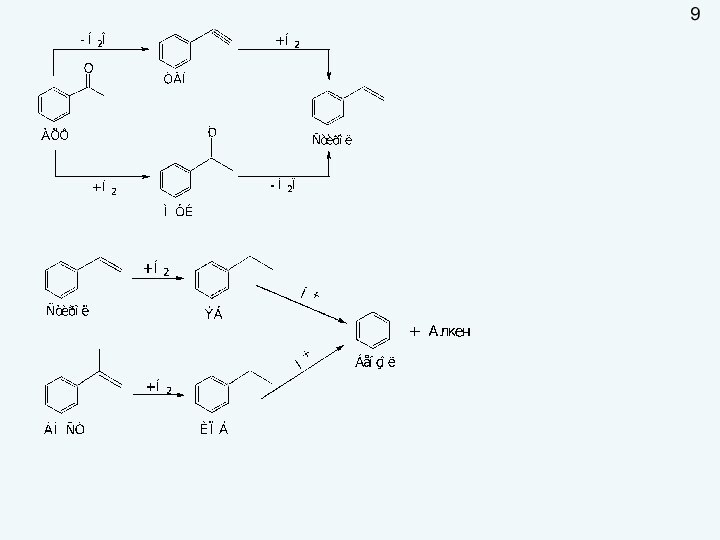
пригодность удовлетворять определенные потребности в соответствии с его назначением.
Применительно к химическим продуктам, это в первую очередь их чистота, характеризующаяся видом и количеством примесей к основному веществу.
Управление качеством базируется на стандартизации - нормативном способе управления, когда воздействие на объект осуществляется путем установления норм и правил, оформленных в виде нормативных документов, имеющих юридическую силу.
2