- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по физике на тему Изопроцессы
Содержание
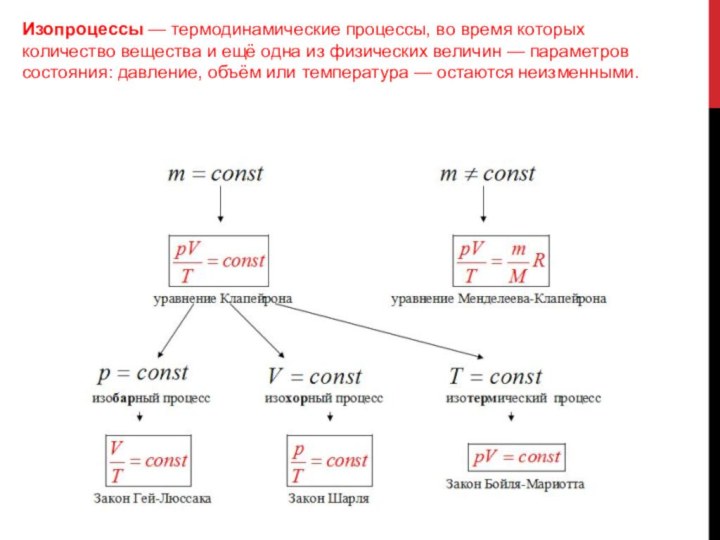
- 2. Изопроцессы — термодинамические процессы, во время которых количество вещества
- 3. Процесс изменения состояния термодинамической системы при постоянном
- 4. Закон Гей-Люссака — закон пропорциональной зависимости объёма
- 5. Процесс изменения состояния термодинамической системы при постоянном
- 6. Закон Шарля или второй закон Гей-Люссака —
- 7. Процесс изменения состояния термодинамической системы макроскопических тел
- 8. Закон Бойля — Мариотта — один из
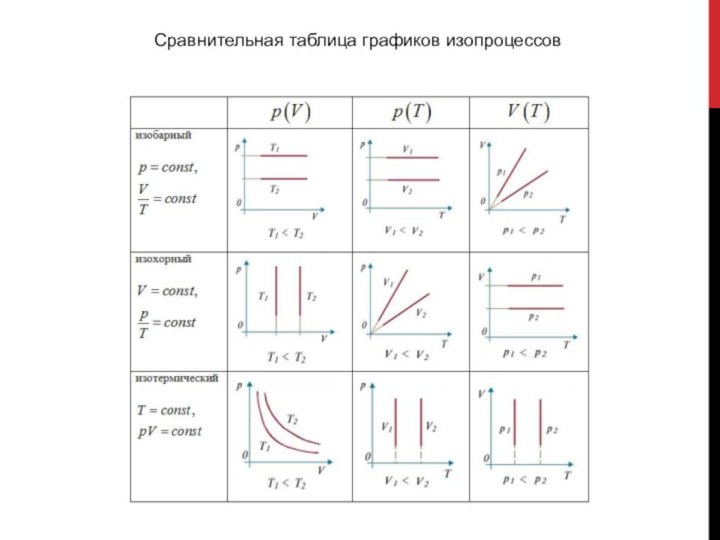
- 9. Сравнительная таблица графиков изопроцессов
- 10. Объединив законы Бойля-Мариотта и Гей-Люссака получается уравнение состояния идеального газа, связывающее
- 11. Скачать презентацию
- 12. Похожие презентации
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными.








Слайд 3 Процесс изменения состояния термодинамической системы при постоянном давлении
называется изобарным. Изобарный процесс протекает при неизменном давлении p
и условии m = const и M = const.Слайд 4 Закон Гей-Люссака — закон пропорциональной зависимости объёма газа
от абсолютной температуры при постоянном давлении, названный в честь
французского физика и химика Жозефа Луи Гей-Люссака, впервые опубликовавшего его в 1802 году.Следует отметить, что в англоязычной литературе закон Гей-Люссака обычно называют законом Шарля и наоборот. Кроме того, законом Гей-Люссака называют также химический закон объёмных отношений.
Слайд 5 Процесс изменения состояния термодинамической системы при постоянном объеме
называют изохорным. Изохорный процесс, протекающий при неизменном объеме V
и условии m = const и M = const.Слайд 6 Закон Шарля или второй закон Гей-Люссака — один
из основных газовых законов, описывающий соотношение давления и температуры
для идеального газа. Экспериментальным путем зависимость давления газа от температуры при постоянном объёме установлена в 1787 году Шарлем и уточнена Гей-Люссаком в 1802 году.Слайд 7 Процесс изменения состояния термодинамической системы макроскопических тел при
постоянной температуре называется изотермическим.
Для поддержания температуры газа постоянной необходимо,
чтобы он мог обмениваться теплотой с большой системой – термостатом. Термостатом может служить атмосферный воздух, если температура его заметно не меняется на протяжении всего процесса.Слайд 8 Закон Бойля — Мариотта — один из основных
газовых законов, открытый в 1662 году Робертом Бойлем и
независимо переоткрытый Эдмом Мариоттом в 1676 году. Описывает поведение газа в изотермическом процессе. Закон является следствием уравнения Клапейрона.Закон Бойля — Мариотта гласит:
При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно.
Слайд 10 Объединив законы Бойля-Мариотта и Гей-Люссака получается уравнение состояния идеального газа, связывающее все
его параметры. Это уравнение называется уравнением состояния идеального газа (уравнение
Клайперона).PV / T = const, при m = const
Если массу газа удвоить при постоянном объеме и Т (или соединить два объема равных масс), то отношение увеличивается вдвое. Поэтому Клайперон указал, что const = Bm, где В - индивидуальная газовая постоянная, зависящая от природы газа.
PV = BmT
Менделеев несколько видоизменил закон Клайперона, объединив его с законом Авогадро (если Р и Т одинаковы, то киломоли разных газов занимают одинаковый объем - Vm).
PVm /Т = R = const - одинакова для всех газов. R - универсальная газовая постоянная.
PVm = ТR - уравнение Менделеева-Клайперона для киломоля газа.
Для произвольной массы газа уравнение Менделеева -Клайперона примет вид:
PV = m/m RТ; где m/m = n - число киломолей
PV =r RТ/m , где r - плотность вещества