Слайд 2
Строение атома
Атом (от др.греч. ἄτομος - неделимый) - наименьшая химически неделимая
часть химического элемента,являющаяся носителем его свойств.
Понятие об атоме как о
наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами.
На международном съезде химиков в г. Карлсруэ (Германия) в 1860 г. были приняты определения понятий молекулы и атома. Атом - наименьшая частица химического элемента, входящего в состав простых и сложных веществ.
Слайд 3
Атом состоит из атомного ядра и электронов. Ядро атома состоит из
положительно заряженных протонов и незаряженных нейтронов.
Электрон — мельчайшая частица вещества с отрицательным электрическим
зарядом е=1,6·10-19 Кл, принятым за элементарный электрический заряд. m=9,1*10-31 кг. Электрон является квазичастицей проявляя корпускулярно-волновой дуализм. Он одновременно является и частицей (корпускула) и волной. К свойствам частицы можно отнести массу электрона и его заряд, а к волновым свойствам - способность к дифракции и интерференции. Связь между волновыми и корпускулярными свойствами электрона отражены в уравнении де Бройля:
λ- длина волны, m— масса частицы, — скорость частицы,h — постоянная Планка = 6,63·10-34 Дж·с.
Слайд 4
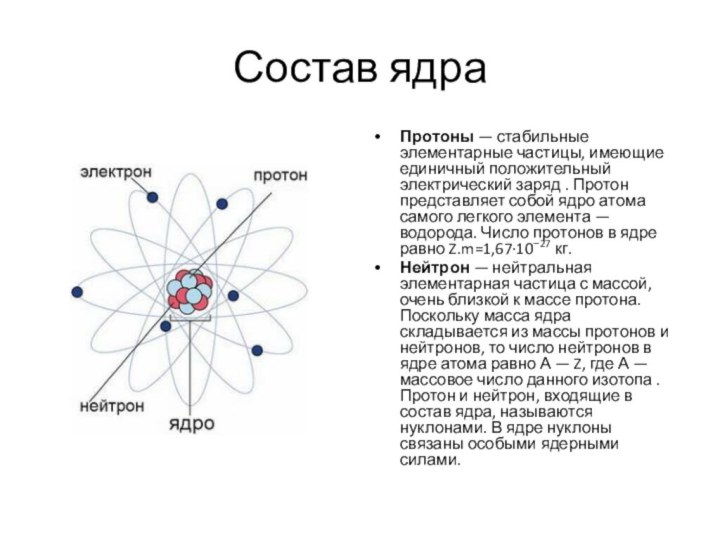
Состав ядра
Протоны — стабильные элементарные частицы, имеющие единичный положительный
электрический заряд . Протон представляет собой ядро атома самого
легкого элемента — водорода. Число протонов в ядре равно Z.m=1,67·10−27 кг.
Нейтрон — нейтральная элементарная частица с массой, очень близкой к массе протона. Поскольку масса ядра складывается из массы протонов и нейтронов, то число нейтронов в ядре атома равно А — Z, где А — массовое число данного изотопа .Протон и нейтрон, входящие в состав ядра, называются нуклонами. В ядре нуклоны связаны особыми ядерными силами.
Слайд 5
Опыты Резерфорда
Эрнест Резерфорд – один из самых знаменитых
физиков первой половины XX века. Когда-то Резерфорд первый анатомировал
атом, обнаружив в нем ядро. ,проводил опыты по изучению прохождения альфа-частиц через тонкие металлические пластины золота и платины. Резерфорд в 1906 году предложил провести зондирование атомов тяжёлых элементов альфа-частиц с энергией 4,05 МэВ, которые испускались ядром урана или радия. Таким образом предлагалось изучить рассеяние (изменение направления движения) альфа-частиц в веществе.
Масса альфа-частицы примерно в 8000 раз больше массы электрона. Положительный заряд равен по модулю удвоенному заряду электрона 2е. Скорость альфа-частицы составляет 1/15 скорости света или 2 * 107 м/с. Альфа-частица – это полностью ионизированный атом гелия.
Слайд 6
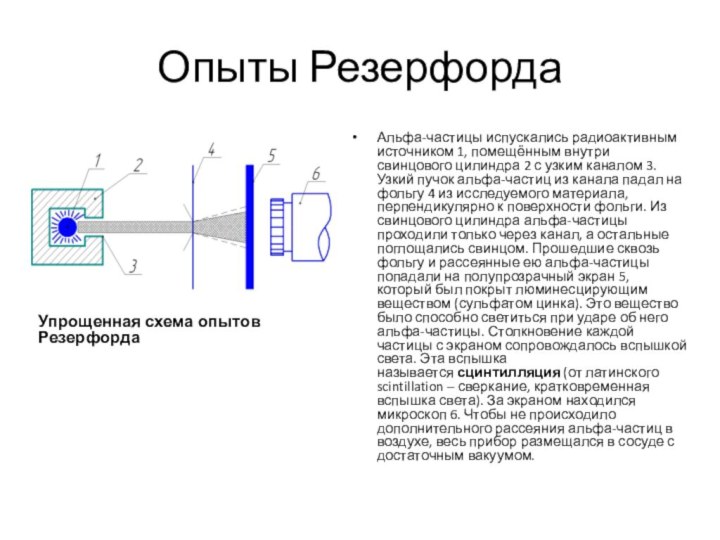
Опыты Резерфорда
Упрощенная схема опытов Резерфорда
Альфа-частицы испускались радиоактивным источником
1, помещённым внутри свинцового цилиндра 2 с узким каналом
3. Узкий пучок альфа-частиц из канала падал на фольгу 4 из исследуемого материала, перпендикулярно к поверхности фольги. Из свинцового цилиндра альфа-частицы проходили только через канал, а остальные поглощались свинцом. Прошедшие сквозь фольгу и рассеянные ею альфа-частицы попадали на полупрозрачный экран 5, который был покрыт люминесцирующим веществом (сульфатом цинка). Это вещество было способно светиться при ударе об него альфа-частицы. Столкновение каждой частицы с экраном сопровождалось вспышкой света. Эта вспышка называется сцинтилляция (от латинского scintillation – сверкание, кратковременная вспышка света). За экраном находился микроскоп 6. Чтобы не происходило дополнительного рассеяния альфа-частиц в воздухе, весь прибор размещался в сосуде с достаточным вакуумом.
Слайд 7
В отсутствие фольги на экране возникал светлый кружок,

состоящий из сцинтилляций, вызванных тонким пучком альфа-частиц. Но когда
на пути движения альфа-частиц помещали тонкую золотую фольгу толщиной примерно 0,1 мк (микрон), то наблюдаемая на экране картинка сильно менялась: отдельные вспышки появлялись не только за пределами прежнего кружка, но их можно было даже наблюдать с противоположной стороны золотой фольги.
Подсчитывая число сцинтилляций в единицу времени в разных местах экрана, можно установить распределение в пространстве рассеянных альфа-частиц. Число альфа-частиц быстро убывает с увеличением угла рассеяния.
Наблюдаемая на экране картина позволила заключить, что большинство альфа-частиц проходит сквозь золотую фольгу без заметного изменения направления их движения. Однако некоторые частицы отклонялись на большие углы от первоначального направления альфа-частиц (порядка 135о…150о) и даже отбрасывались назад. Исследования показали, что при прохождении альфа-частиц сквозь фольгу примерно на каждые 10000 падающих частиц только одна отклоняется на угол более 10о от первоначального направления движения. Лишь в виде редкого исключения одна из огромного числа альфа-частиц отклоняется от своего первоначального направления.
Тот факт, что многие альфа-частицы проходили сквозь фольгу, не отклоняясь от своего направления движения, говорит о том, что атом не является сплошным образованием. Так как масса альфа-частицы почти в 8000 раз превосходит массу электрона, то электроны, входящие в состав атомов фольги, не могут заметно изменить траекторию альфа-частиц. Рассеяние альфа-частиц может вызывать положительно заряженная частица атома – атомное ядро.
Слайд 8
Таким образом, опыты Резерфорда и его сотрудников привели

к выводу, что в центре атома находится плотное положительно
заряженное ядро, диаметр которого не превышает 10–14–10–15 м. Это ядро занимает только 10–12 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Веществу, составляющему ядро атома, следовало приписать колоссальную плотность порядка ρ ≈ 1015 г/см3. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. Впоследствии удалось установить, что если заряд электрона принять за единицу, то заряд ядра в точности равен номеру данного элемента в таблице Менделеева.
Радикальные выводы о строении атома, следовавшие из опытов Резерфорда, заставляли многих ученых сомневаться в их справедливости. Не был исключением и сам Резерфорд, опубликовавший результаты своих исследований только в 1911 г. через два года после выполнения первых экспериментов. Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны.
Слайд 9
Нильс Хе́нрик Дави́д Бор
— датский физик-теоретик и общественный деятель, один из
создателей современной физики. Лауреат Нобелевской премии по физике (1922). Член Датского
королевского общества (1917) и его президент с 1939 года. Был членом более чем 20 академий наук мира, в том числе иностранным почётным членом АН СССР (1929; членом-корреспондентом — с 1924).
Бор известен как создатель первой квантовой теории атома и активный участник разработки основ квантовой механики. Он также внёс значительный вклад в развитие теории атомного ядра и ядерных реакций, процессов взаимодействия элементарных частиц со средой.
Слайд 10
Постулаты Бора
Первый постулат Бора: постулат стационарных состояний
Атомная система
может находиться только в особых стационарных, или квантовых, состояниях,
каждому из которых соответствует определённая энергия En. В стационарном состоянии атом не излучает свет.
Слайд 11
Второй постулат Бора:правило квантования орбит
В стационарном состоянии атома
электрон, двигаясь по круговой орбите с ускорением, не излучает
света, должен иметь дискретные (квантованные) значения момента импульса;
n – главное квантовое число.
Слайд 12
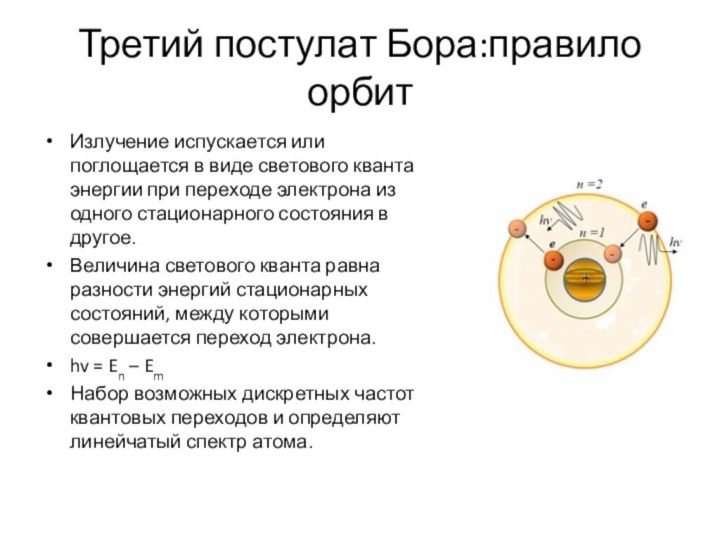
Третий постулат Бора:правило орбит
Излучение испускается или поглощается в
виде светового кванта энергии при переходе электрона из одного
стационарного состояния в другое.
Величина светового кванта равна разности энергий стационарных состояний, между которыми совершается переход электрона.
hv = En – Em
Набор возможных дискретных частот квантовых переходов и определяют линейчатый спектр атома.
Слайд 13
Боровские орбиты
-это геометрическое место точек,а которых вероятность нахождения
электорна самая большая;
Радиус б. о. возрастает в меру того,как
отдаляется от ядра:
Энергетический уровень атома:
Слайд 14
Теория атома водорода по Бору
Спектр поглощения атома водорода

является линейчатым. Он также объясняется теорией Бора. Так как
свободные атомы водорода обычно находятся в основном состоянии (стационарное состояние с наименьшей энергией при n=1), то при сообщении атомам извне определённой энергии могут наблюдаться лишь переходы атомов из основного состояния в возбуждённое.
Для водорода основными сериями являются:
· в ультрафиолетовой области спектра –
серия Лаймана (n = 1, m = 2, 3, 4, …);
· в видимой области спектра –
серия Бальмера (n = 2, m = 3, 4, 5 …);
· в инфракрасной области спектра –
серия Пашена (n = 3, m = 4, 5, 6 …);
серия Брэкета (n = 4, m = 5, 6, 7 …);
серия Пфунда (n = 5, m = 6, 7, 8 …);
серия Хэмфри (n = 6, m = 7, 8, 9 …).
Энергия атома водорода с увеличением n возрастает и энергетические уровни сближаются к границе, соответствующей значению n = ∞. Атом водорода обладает, таким образом, минимальной энергией (Е1 = = - 13,6 эВ) при n = 1 и максимальной (Е∞ = 0) при n = ∞. Следовательно, значение Е∞ = 0 соответствует ионизации атома (отрыву от него электрона). Согласно второму постулату Бора , при переходе атома водорода (Z = 1) из стационарного состояния n в стационарное состояние m с меньшей энергией испускается квант света.