- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по теме Классификация кристаллов
Содержание
- 3. Твердые кристаллы Большинство твердых тел имеет кристаллическое
- 4. Характерная особенность кристаллического состояния, отличающая его от
- 5. Анизотропия кристаллов обусловлена упорядоченным расположением частиц, из
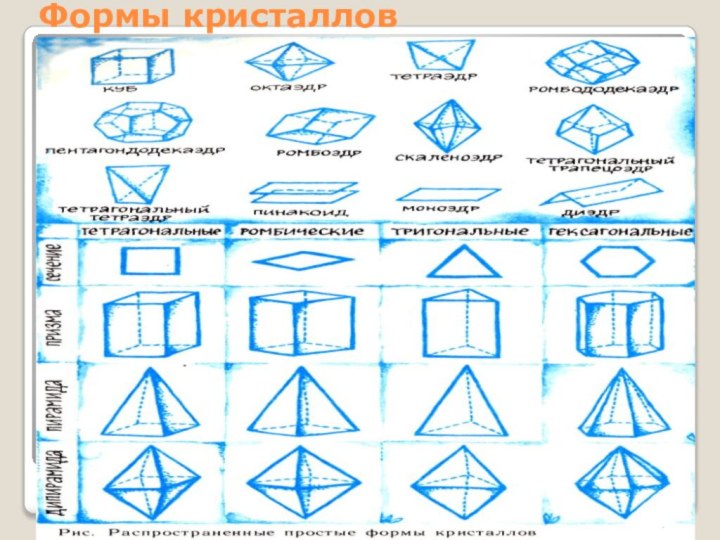
- 6. Формы кристаллов
- 7. Аморфные телаАморфные тела- твердые тела, не имеющие
- 8. Строение аморфных телВ аморфных телах не наблюдается
- 9. КомпозитыКомпозитные материал- это материалы, механические свойства которых
- 10. Правильность внешней огранки и анизотропия кристаллов обычно
- 11. МонокристаллыСоздав специальные условия кристаллизации из раствора или
- 12. Структурные элементы кристалла размещаются в узлах геометрически
- 13. 32 вида симметрииНизшая категорияСредняя категорияВысшая категорияСингонии:ТриклиннаяМоноклиннаяРомбическаяСингонии:ТетрагонапьнаяТригональнаяГексагональнаяСингонии:Кубическая
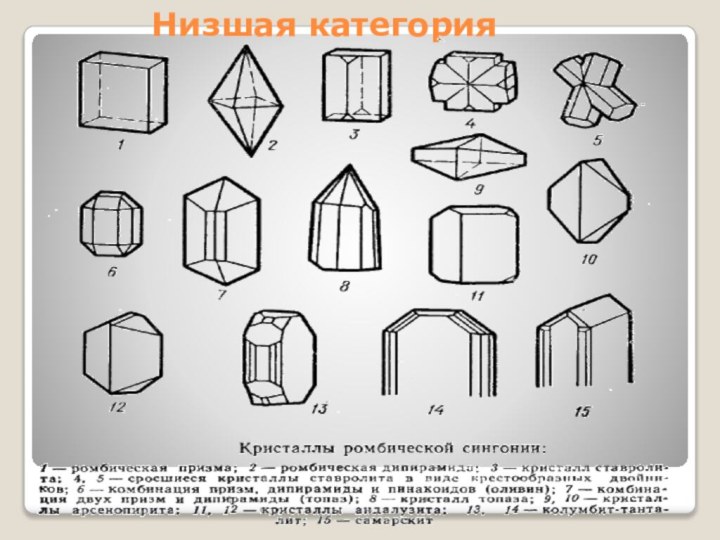
- 14. Низшая категория
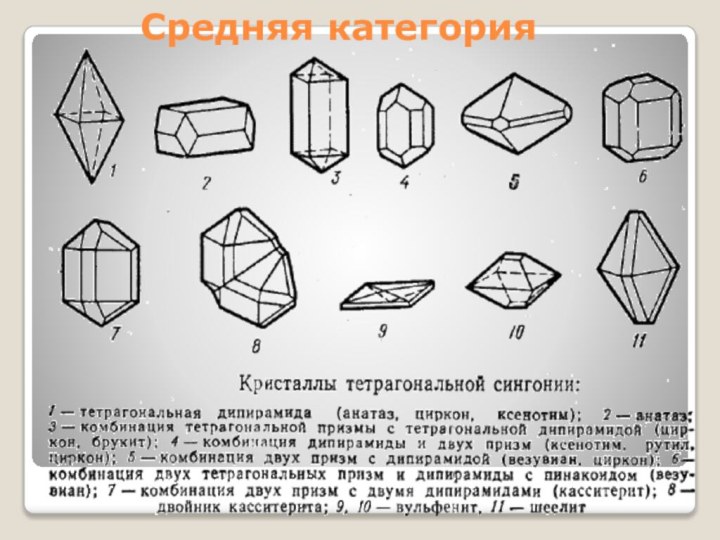
- 15. Средняя категория
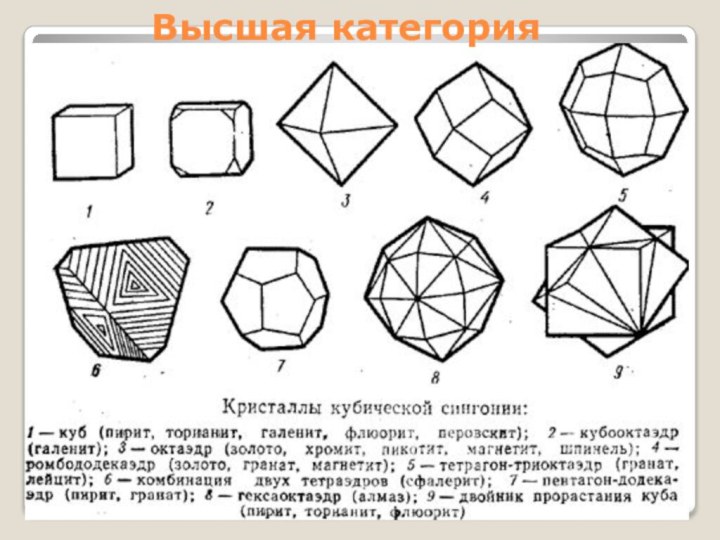
- 16. Высшая категория
- 17. Типы кристаллов В зависимости от вида частиц,
- 18. Ионные кристаллыВ узлах решетки ионы.Химическая связь ионная.Свойства
- 19. Атомные кристаллыВ узлах решетки атомы.Химическая связь ковалентная
- 20. Металлические кристаллыВ узлах решетки атом-ионы.Химическая связь металлическая.Свойства
- 21. Молекулярные кристаллыВ узлах решетки молекулы.Химическая связь ковалентная
- 22. Кристаллические решетки
- 23. Применение кристаллов
- 24. Скачать презентацию
- 25. Похожие презентации
Твердые кристаллы Большинство твердых тел имеет кристаллическое состояние. Почти все минералы и все металлы твердом состоянии являются кристалламиКристаллы- это твёрдые тела, атомы или молекулы которых занимают определённые, упорядоченные положения в пространстве.
















Слайд 3
Твердые кристаллы
Большинство твердых тел имеет кристаллическое состояние. Почти
все минералы и все металлы твердом состоянии являются кристаллами
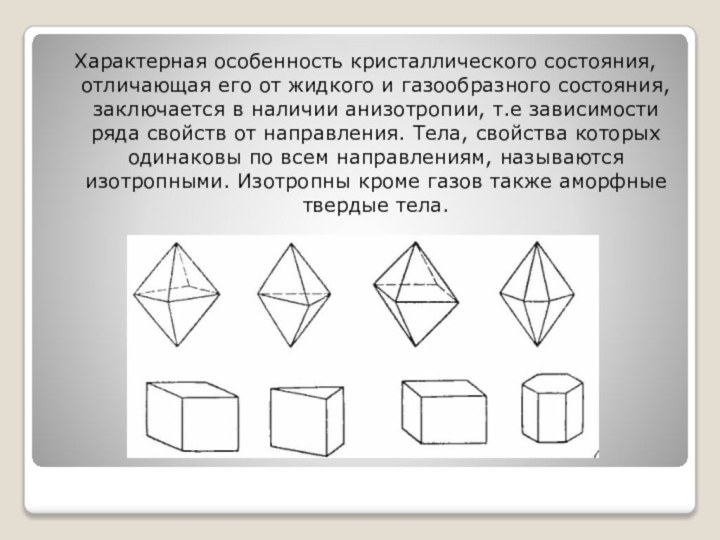
это твёрдые тела, атомы или молекулы которых занимают определённые, упорядоченные положения в пространстве.Слайд 4 Характерная особенность кристаллического состояния, отличающая его от жидкого
и газообразного состояния, заключается в наличии анизотропии, т.е зависимости
ряда свойств от направления. Тела, свойства которых одинаковы по всем направлениям, называются изотропными. Изотропны кроме газов также аморфные твердые тела.Слайд 5 Анизотропия кристаллов обусловлена упорядоченным расположением частиц, из которых
они построены.Такое расположение проявляется во внешней огранки кристаллов.
Кристаллические тела
ограничены плоскими гранями, углами.Грани кристаллов могут изменяться по своей форме и относительным размерам, но их взаимные наклоны постоянны и неизменны для каждого рода кристаллов
Слайд 7
Аморфные тела
Аморфные тела- твердые тела, не имеющие строгой
повторяемости во всех направлениях.
Свойства аморфных тел:
1.
Изотропия.2. При низких температурах имеют свойства твердых тел, при нагревании- свойства жидкостей.
3. Не имеют определенной температуры плавления.
4. Неустойчивое состояние: со временем переходит в кристаллическое.
Слайд 8
Строение аморфных тел
В аморфных телах не наблюдается строго
порядка расположения их частиц. В отличии от кристаллов, где
существует дальний порядок в расположении частиц, в строении аморфных тел есть ближний порядок. Это значит, что некая упорядоченность в расположении частиц сохраняется лишь вблизи каждой отдельной частицы.
Слайд 9
Композиты
Композитные материал- это материалы, механические свойства которых превосходят
естественные материалы. Они состоят из матрицы и наполнителей.
В
качестве матрицы используют полимерные, металлические, углеродные или керамические материалы. Наполнители могут состоять нитевидных кристаллических волокон, проволоки.
Например: железобетон (строительство) , железографит (изготовление подшипников).
Слайд 10 Правильность внешней огранки и анизотропия кристаллов обычно не
проявляются из-за того, что кристаллические тела встречаются в виде
поликристаллов.Поликристаллы – это твердое тело, состоящее из большого числа маленьких кристалликов.
В поликристаллах анизотропия наблюдается только в пределах каждого отдельного взятого кристаллика, тело же в следствии беспорядочной ориентации кристалликов анизотропии не обнаруживает.
Поликристаллы
Слайд 11
Монокристаллы
Создав специальные условия кристаллизации из раствора или расплава,
можно вырастить большие одиночные кристаллы-монокристаллы. Иногда они обладают геометрически
правильной внешней формой, но главным признаком монокристалла — периодически повторяющаяся внутренняя структура во всем его объеме.Слайд 12 Структурные элементы кристалла размещаются в узлах геометрически правильной
пространственной решетки. Весь кристалл может быть получен путем многократного
повторения в трех различных направлениях элементарной кристаллической ячейки.Кристаллическая решетка может обладать различными видами симметрии. Под симметрией кристаллической решетки понимается свойство решетки совпадать с самой собой при некоторых пространственных перемещениях.
В зависимости от формы элементарной ячейки все кристаллы делятся на 7 кристаллографических систем (или сингоний), каждая из которых характеризуется своей совокупностью элементов симметрии
Слайд 13
32 вида симметрии
Низшая категория
Средняя категория
Высшая категория
Сингонии:
Триклинная
Моноклинная
Ромбическая
Сингонии:
Тетрагонапьная
Тригональная
Гексагональная
Сингонии:
Кубическая
Слайд 17
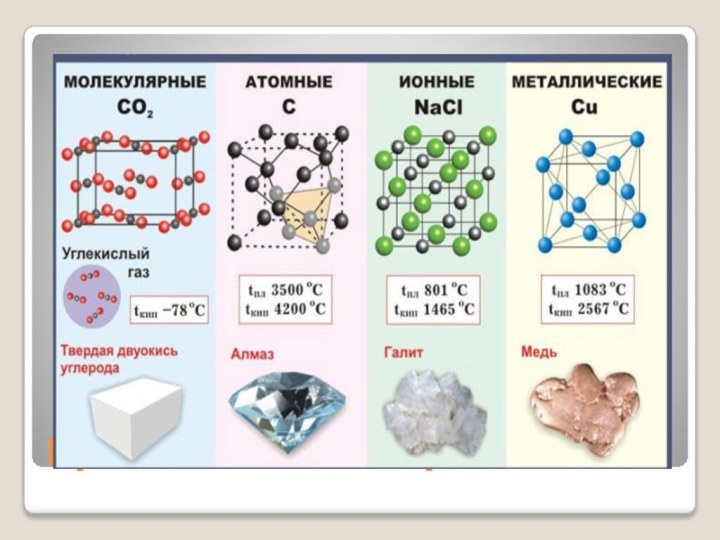
Типы кристаллов
В зависимости от вида частиц, помещающихся в
узлах кристаллической решетки, и от характера сил взаимодействия между
частицами различают 4 типа кристаллов
Слайд 18
Ионные кристаллы
В узлах решетки ионы.
Химическая связь ионная.
Свойства веществ:
1) относительно высокая твердость, прочность, 2) хрупкость, 3) термостойкость,
4) тугоплавкость, 5) нелетучестьПримеры: соли (NaCl, Na2CO3), основания (Ca(OH)2, CaO)
Слайд 19
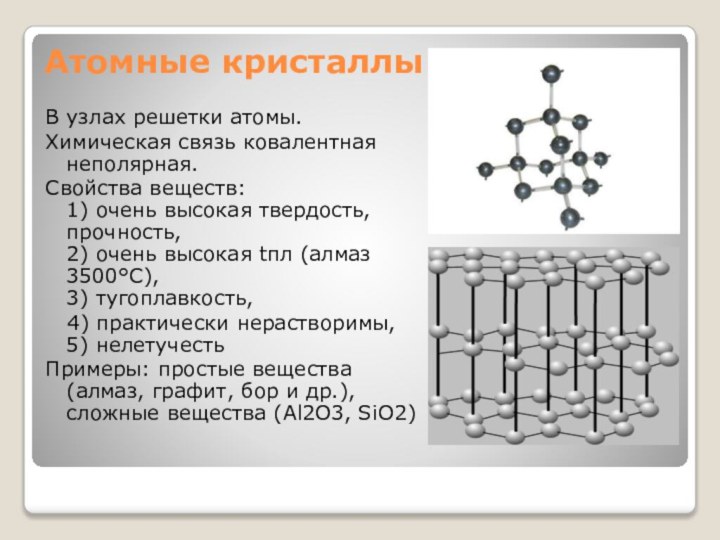
Атомные кристаллы
В узлах решетки атомы.
Химическая связь ковалентная неполярная.
Свойства
веществ: 1) очень высокая твердость, прочность, 2) очень высокая
tпл (алмаз 3500°С), 3) тугоплавкость,4) практически нерастворимы, 5) нелетучесть
Примеры: простые вещества (алмаз, графит, бор и др.), сложные вещества (Al2O3, SiO2)
Слайд 20
Металлические кристаллы
В узлах решетки атом-ионы.
Химическая связь металлическая.
Свойства веществ:
1) непрозрачность
2) тепло- и электропроводность,
3) ковкость и пластичность,
4) металлический блеск.Примеры: металлы
Слайд 21
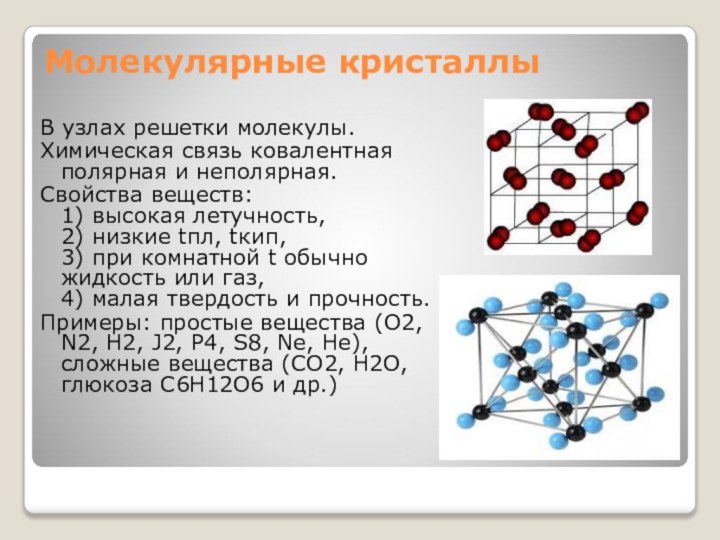
Молекулярные кристаллы
В узлах решетки молекулы.
Химическая связь ковалентная полярная
и неполярная.
Свойства веществ:
1) высокая летучность,
2) низкие tпл,
tкип,
3) при комнатной t обычно жидкость или газ,
4) малая твердость и прочность.Примеры: простые вещества (O2, N2, H2, J2, P4, S8, Ne, He), сложные вещества (СО2, H2O, глюкоза С6H12O6 и др.)





























