- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему к уроку по теме: Опыт Резерфорда. Ядерная модель атома
Содержание
- 2. Атомная и ядерная физика раздел физики, изучающий
- 3. Явления, подтверждающие сложное строение атома Явление электролиза
- 4. Демокрит существует предел деления атома АристотельДелимость вещества
- 5. Первая модель атома— модель Томсона (1903 г.).
- 6. Недостатки модели атома Томсона Она не могла
- 7. Томсон, пытаясь согласовать эту модель с данными
- 8. Опыт Резерфорда с α-частицамиФотографии люминесцирующего экрана при
- 9. Опыт Резерфорда (1906 г.) Резерфорд «бомбардировал» α-частицами золотую фольгу и наблюдал за свечением экрана.
- 10. При попадании α-частицы на экран возникает свечение люминесцентного слоя.
- 11. Наблюдения из опыта большинство α -частиц пролетает
- 13. Ядерная модель атома Атом имеет положительное заряженное
- 14. Выводы Резерфорда (модель атома):
- 15. Модель ТомсонаМодель РезерфордаОтличие модели Томсона от модели Резерфорда
- 16. Отличие атомных систем от планетных Планеты притягиваются
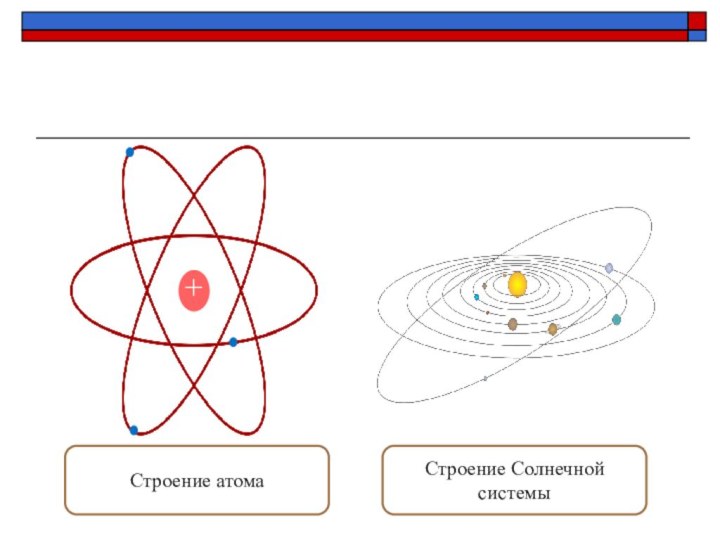
- 17. +Строение атомаСтроение Солнечной системы
- 18. Противоречия планетарной модели атома и классической физики 1)Но: атом устойчив!!!
- 19. 2) Вследствие непрерывной потери Е электрона, атом
- 20. ВыводЭти противоречия объясняются невозможностью применения к электронам в атомах законов классической физики.
- 21. Это интересноЕсли бы все электроны тела человека
- 22. Скачать презентацию
- 23. Похожие презентации
Атомная и ядерная физика раздел физики, изучающий строение атома и атомного ядра и процессы, связанные с ними

















Слайд 2
Атомная и ядерная физика
раздел физики, изучающий строение атома
и атомного ядра и процессы, связанные с ними
Слайд 3
Явления, подтверждающие сложное строение атома
Явление электролиза (Фарадей,
1833г)
Электромагнитная теория света (Максвелл)
Рентгеновские лучи (1895)
Явление радиоактивности (Беккерель, 1896г)
Катодные
лучи – электроны (Дж. Томсон, 1897г)Линейчатые спектры
Фотоэффект
Опыты Резерфорда по зондированию вещества
Слайд 4
Демокрит
существует предел деления атома
Аристотель
Делимость вещества бесконечна
1626г, Париж
Учение об атоме запрещено по страхом смерти
Слайд 5
Первая модель атома
— модель Томсона (1903 г.). Положительно
заряженный шар, внутри которого находятся электроны («пудинг с изюмом»).
Суммарный
положительный заряд = суммарному отрицательному заряду (атом в целом нейтрален).
Слайд 6
Недостатки модели атома Томсона
Она не могла объяснить
излучения большого числа спектральных линий
Не давала возможность понять,
чем определяются размеры атомов. Оказалась в полном противоречии с опытами Резерфорда
Слайд 7
Томсон, пытаясь согласовать эту модель с данными спектроскопии
и периодическим законом Менделеева, распределял электроны по концентрическим кольцам,
приписав каждому из электронов собственную частоту колебаний, совпадающую с одной из частот спектра излучения атома
Слайд 8
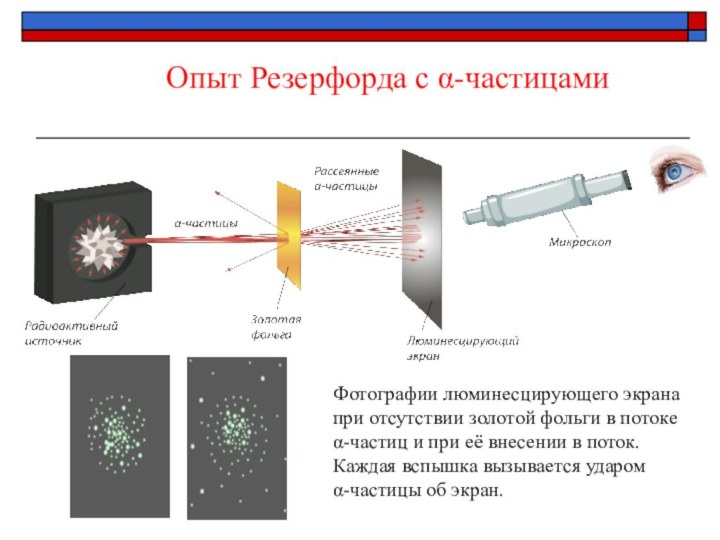
Опыт Резерфорда с α-частицами
Фотографии люминесцирующего экрана при отсутствии
золотой фольги в потоке α-частиц и
при её внесении в поток.Каждая вспышка вызывается ударом
α-частицы об экран.
Слайд 9
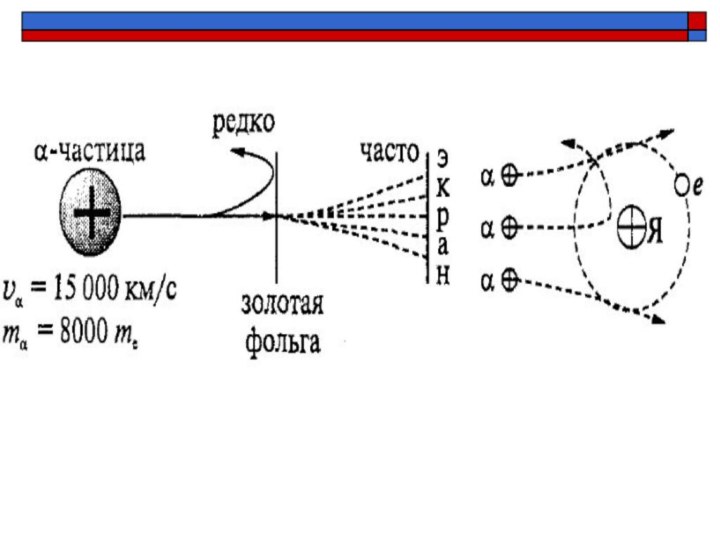
Опыт Резерфорда (1906 г.)
Резерфорд «бомбардировал» α-частицами золотую фольгу
и наблюдал за свечением экрана.
Слайд 11
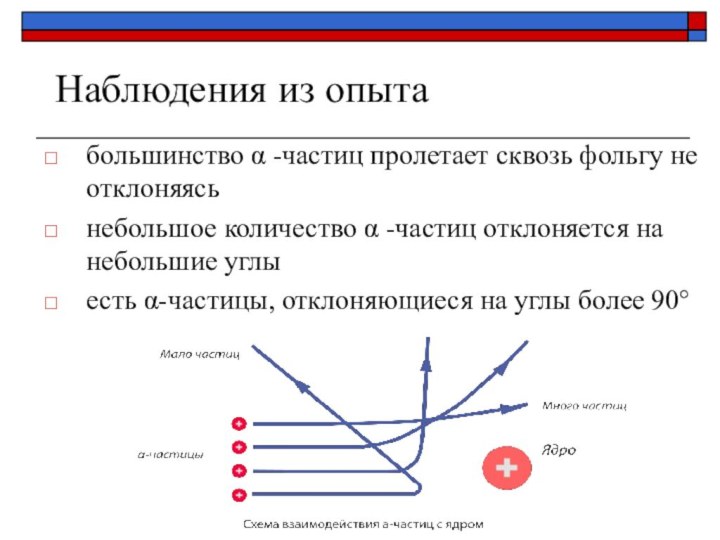
Наблюдения из опыта
большинство α -частиц пролетает сквозь фольгу
не отклоняясь
небольшое количество α -частиц отклоняется на небольшие углы
есть
α-частицы, отклоняющиеся на углы более 90°
Слайд 13
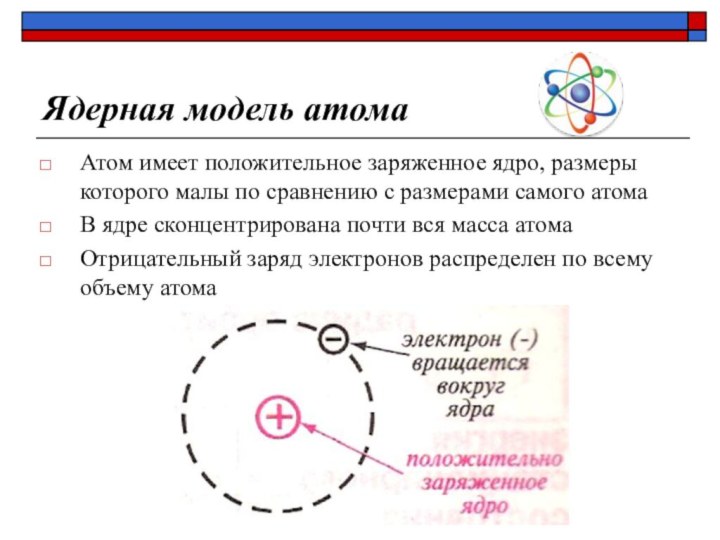
Ядерная модель атома
Атом имеет положительное заряженное ядро,
размеры которого малы по сравнению с размерами самого атома
В ядре сконцентрирована почти вся масса атома
Отрицательный заряд электронов распределен по всему объему атома
Слайд 16
Отличие атомных систем от планетных
Планеты притягиваются к
Солнцу силами всемирного тяготения.
Электроны притягиваются к ядру кулоновскими
силами. Силы гравитационного притяжения между электронами и ядром ничтожно малы по сравнению с электромагнитными
Слайд 19 2) Вследствие непрерывной потери Е электрона, атом должен
излучать непрерывный спектр, но атом излучает линейчатый спектр.
3)
Атом излучает свет не все время, а лишь при определенных условиях (прохождение тока в газах, нагревание до высокой температуры),т.е. при сообщении ему энергии. Противоречия планетарной модели атома и классической физики





























