- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему урока “Радиоактивность. Модели атомов. Опыт Резерфорда.
Содержание
- 2. Тема урока :“Радиоактивность. Модели атомов. Опыт Резерфорда.”
- 3. Цели урока: повторить, что такое атом ,его строение ; углубить знания о структуре атома ;познакомиться с явлением радиоактивности
- 4. Основные вопросы:Открытие явления радиоактивности А. Беккерелем.Опыт по
- 5. Эпиграф к уроку: «Науку все
- 6. Гипотеза о том, что все тела состоят
- 7. Антуан Анри Беккерель французский физик, лауреат
- 8. Мария СКЛОДОВСКАЯ-КЮРИ 7 ноября 1867 г.
- 9. Джозеф Джон Томсон 18 декабря 1856
- 10. Первые модели строения атома: Немецкий физик
- 11. Первые модели строения атомовв 1902 г. Уильям Томсон
- 12. Эрнест РЕЗЕРФОРД Английский физик, родился
- 13. Опыт Э. Резерфорда в 1899 году
- 14. Потом опыт изменяли, создали сильное магнитное поле,
- 15. Положительно заряженные частицы назвали альфа-частицами. Альфа -
- 16. Установка Резерфорда
- 17. Результаты опытовОпыт показал, что положительный заряд атома
- 18. Планетарная модель атома РезерфордаАтом имеет в центре
- 19. Закрепление знанийВ чем заключается открытие, сделанное Беккерелем
- 20. Итог урока
- 21. Задание на дом § 65, § 66,
- 22. Скачать презентацию
- 23. Похожие презентации



















Слайд 4
Основные вопросы:
Открытие явления радиоактивности А. Беккерелем.
Опыт по обнаружению
сложного состава радиоактивного излучения.
Альфа, бета, и гамма – частицы.
Радиоактивность
как свидетельство слож- ного строения атомов
Слайд 5
Эпиграф к уроку:
«Науку все глубже постигнуть стремись,
познанием вечного жаждой томись. Лишь первых познаний блеснет тебе
свет, узнаешь: предела для знания нет»Персидский поэт Хаким Абулькасим Мансур Хасан Фирдоуси Туси, 940 – 1030 гг.
Слайд 6
Гипотеза о том, что все тела состоят из
мельчайших частиц, было высказано древнегреческими философами Левкиппом (500-440 д.н.э.)
и Демокритом (ок. 460 - 370 до н.э.) свыше двух тысячелетий тому назад. Частицы эти были названы «атомами», что означает неделимые. Но с середины 9 века было подставлено под сомнение представление о неделимости атома. Экспериментальные работы показали, что в их строение входят электрически заряженные частицы.Слайд 7 Антуан Анри Беккерель французский физик, лауреат Нобелевской премии 15
декабря15 декабря 1852 — 25 августа 1908
В 1896
году, исследуя действие различных люминесцирующих минералов на фотопластинку, Беккерель случайно открыл неизвестное излучение, присущее самой урановой соли и ничего общего не имеющее с люминесцирующим излучением. Это явление самопроизвольного испускания солями урана лучей особой природы было названо радиоактивностью Слайд 8 Мария СКЛОДОВСКАЯ-КЮРИ 7 ноября 1867 г. –
4 июля 1934 г. Пьер КЮРИ
5 мая 1859 г. – 19 апреля 1906 г.Радиоактивность” – (лат) radio – излучаю, aсtivus – действенный
В июле и декабре 1898 г. Мария и Пьер Кюри объявили об открытии двух новых элементов, которые были названы ими полонием (в честь Польши – родины Марии) и радием.
Слайд 9 Джозеф Джон Томсон 18 декабря 1856 г. –
30 августа 1940 г.
Открыл в 1895 – 1897 гг.
электрон.Предложил одну из первых моделей атома в 1903 г.,
Получил в 1906 г. Нобелевскую премию по физике
Слайд 10
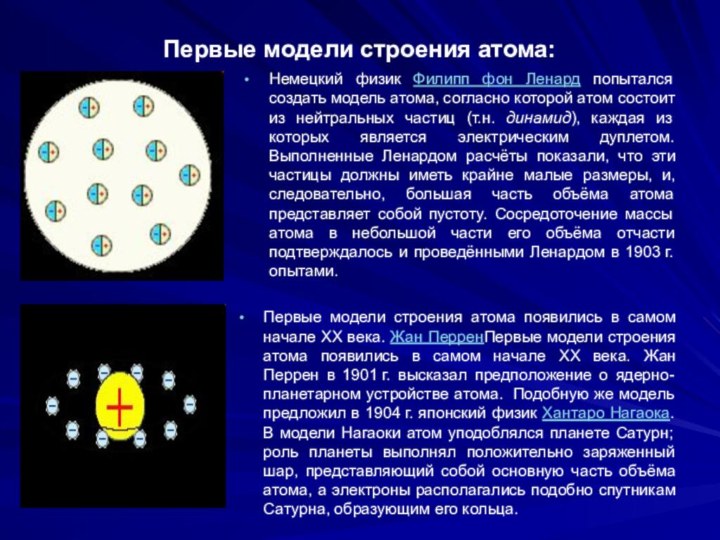
Первые модели строения атома:
Немецкий физик Филипп
фон Ленард попытался создать модель атома, согласно которой атом
состоит из нейтральных частиц (т.н. динамид), каждая из которых является электрическим дуплетом. Выполненные Ленардом расчёты показали, что эти частицы должны иметь крайне малые размеры, и, следовательно, большая часть объёма атома представляет собой пустоту. Сосредоточение массы атома в небольшой части его объёма отчасти подтверждалось и проведёнными Ленардом в 1903 г. опытами.Первые модели строения атома появились в самом начале XX века. Жан ПерренПервые модели строения атома появились в самом начале XX века. Жан Перрен в 1901 г. высказал предположение о ядерно-планетарном устройстве атома. Подобную же модель предложил в 1904 г. японский физик Хантаро Нагаока. В модели Нагаоки атом уподоблялся планете Сатурн; роль планеты выполнял положительно заряженный шар, представляющий собой основную часть объёма атома, а электроны располагались подобно спутникам Сатурна, образующим его кольца.
Слайд 11
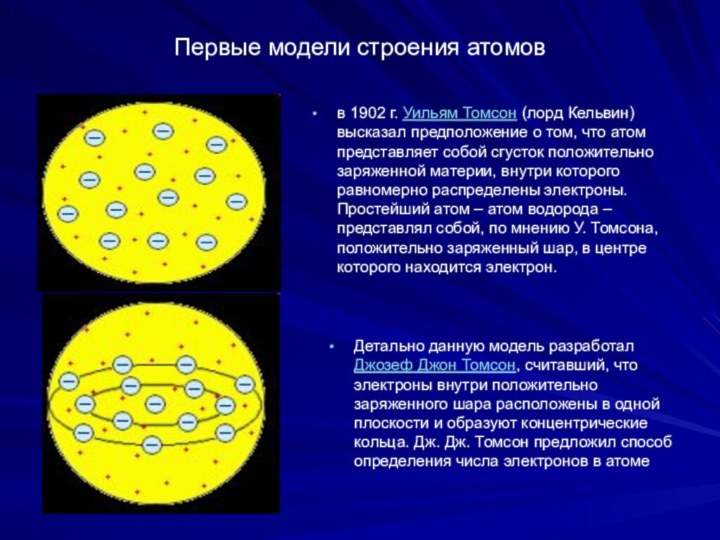
Первые модели строения атомов
в 1902 г. Уильям Томсон (лорд
Кельвин) высказал предположение о том, что атом представляет собой
сгусток положительно заряженной материи, внутри которого равномерно распределены электроны. Простейший атом – атом водорода – представлял собой, по мнению У. Томсона, положительно заряженный шар, в центре которого находится электрон.
Детально данную модель разработал Джозеф Джон Томсон, считавший, что электроны внутри положительно заряженного шара расположены в одной плоскости и образуют концентрические кольца. Дж. Дж. Томсон предложил способ определения числа электронов в атоме
Слайд 12
Эрнест РЕЗЕРФОРД
Английский физик, родился 30 августа
1871 г. в Новой Зеландии. Его исследования посвящены радиоактивности,
атомной и ядерной физике. Своими фундаментальными открытиями в этих областях Резерфорд заложил основы современного учения о радиоактивности и теории строения атома. Умер 19 октября 1937 г.
Слайд 13
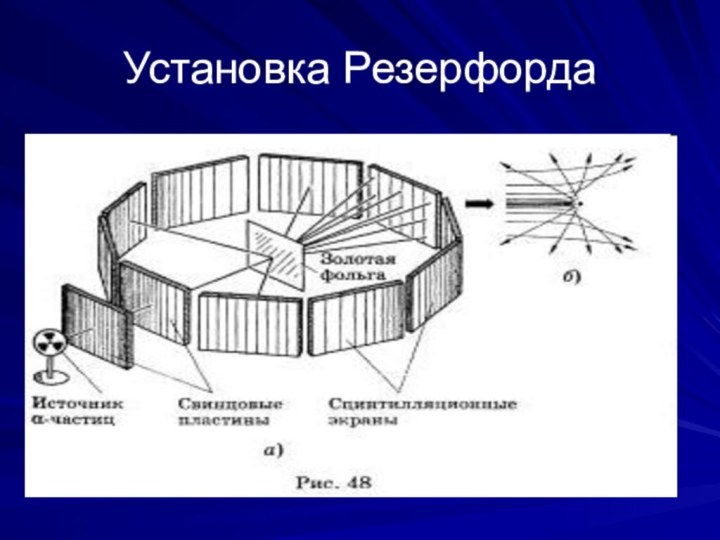
Опыт Э. Резерфорда в 1899 году
На рисунке изображен толстостенный свинцовый сосуд с крупицей
радия на дне. Пучок радиоактивного излучения радия выходит сквозь узкое отверстие и попадает на фотопластинку (излучение радия направлено во все стороны, но сквозь толстый слой свинца оно пройти не может). После проявления фотопластинки на ней обнаруживалось одно темное пятно – как раз в том месте, куда попадал пучок.
Слайд 14
Потом опыт изменяли, создали сильное магнитное поле, действовавшее
на пучок. В этом случае на проявленной пластинке возникало
три пятна: одно, центральное, было на том же месте, что и раньше, а два других – по разные стороны от центрального. Если два потока отклонились в магнитном поле от прежнего направления, значит, они представляют собой потоки заряженных частиц. Отклонение в разные стороны свидетельствовало о разных знаках электрических зарядов частиц. В одном потоке присутствовали только положительно заряженные частицы, в другом – отрицательно заряженные. А центральный поток представлял собой излучение, не имеющее электрического заряда.Слайд 15 Положительно заряженные частицы назвали альфа-частицами. Альфа - частицы –
это потоки ионизированных ядер атомов гелия. Скорость этих частиц
20000 км/с, что превышает скорость современного самолета (1000 км/ч) в 72000 раз. Альфа – лучи проникают в воздух до 10 см.
Отрицательно заряженные – бета-частицами. Бета – частицы представляют собой поток быстрых электронов, летящих со скоростями близкими к скорости света. Они проникают в воздух до 20 м.
Нейтральные – гамма - квантами. Гамма – кванты или лучи – это коротковолновое электромагнитное излучение, скорость распространения электромагнитного излучения такая же, как и у всех электромагнитных волн – 300000 км/с. Гамма – лучи проникают в воздух на сотни метров.
Слайд 17
Результаты опытов
Опыт показал, что положительный заряд атома сконцентрирован
в очень малом объеме – ядре.
Между ядрами атомов существуют
большие промежутки. ядра различных атомов во много раз превышает размер ядра.
Таким образом, атом оказался «пустым».
Слайд 18
Планетарная модель атома Резерфорда
Атом имеет в центре ядро,
размеры которого во много раз меньше размеров самого атома
.Вокруг ядра по орбитам движутся электроны.
Почти вся масса атома сконцентрирована в его ядре.
Суммарный отрицательный заряд всех электронов равен суммарному положительному заряду ядра атома и компенсирует его.
Слайд 19
Закрепление знаний
В чем заключается открытие, сделанное Беккерелем в
1896г?
Кто из ученых занимался исследованием данных лучей?
Кем
и как было названо явление самопроизвольного излучения некоторыми атомами? В ходе исследования явления радиоактивности, какие неизвестные ранее химические элементы были открыты?
Как были названы частицы, входящие в состав радиоактивного излучения?
Что представляют собой эти частицы?
О чем свидетельствует явление радиоактивности?
Пользуясь рисунком расскажите, как проводился опыт Резерфорда по рассеянию α- частиц?
Какие выводы сделал Резерфорд?
Что представляет атом согласно ядерной модели, выдвинутой Резерфордом?
Слайд 20
Итог урока
Мир электрона.
Быть может, эти электроны-
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков.
Еще, быть может, каждый атом -
Вселенная, где сто планет,
Там все, что здесь, в объеме сжатом,
Но так же то, чего здесь нет.
Их меры малы, но все та же
Их бесконечность, как и здесь,
Там скорбь и страсть, как здесь, и даже
Там та же мировая спесь... Валерий Брюсов в 1922 году
Слайд 21
Задание на дом
§ 65, § 66,
Принести
таблицы Д.И.Менделеева
Подготовить сообщение о научной деятельности Фредерика Содди.
Подготовить сообщение
о научной деятельности А. А. БеккереляПодготовить сообщение о научной деятельности М. Склодовской-Кюри и П. Кюри
Подготовить сообщение о научной деятельности Э. Резерфорда





























