- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Электрический ток в жидкостях
Содержание
- 2. Повтороение:Дать определение электрического тока.По способности проводить электрический
- 3. Сравним свойства проводников и полупроводников.
- 4. Зависит ли сопротивление проводников от температуры?.Зависит ли сопротивление полупроводников от температуры?.
- 5. Электрический ток в жидкостях
- 6. Цель урока: Сравнить электропроводность жидкостей.Разъяснить физическую природу
- 7. Все ли вещества проводят ток?КА
- 8. Все ли вещества проводят ток?
- 9. Почему чистая
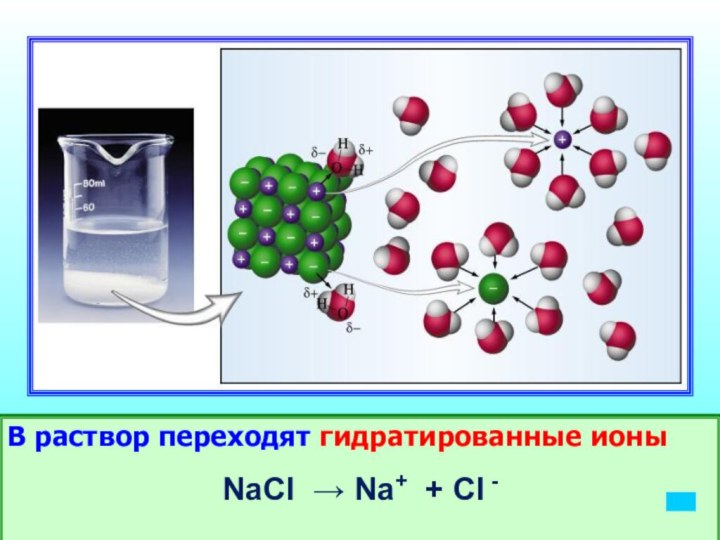
- 10. Строение молекулы воды Диполь водыВзаимодействие молекул воды с молекулами электролита - гидратация
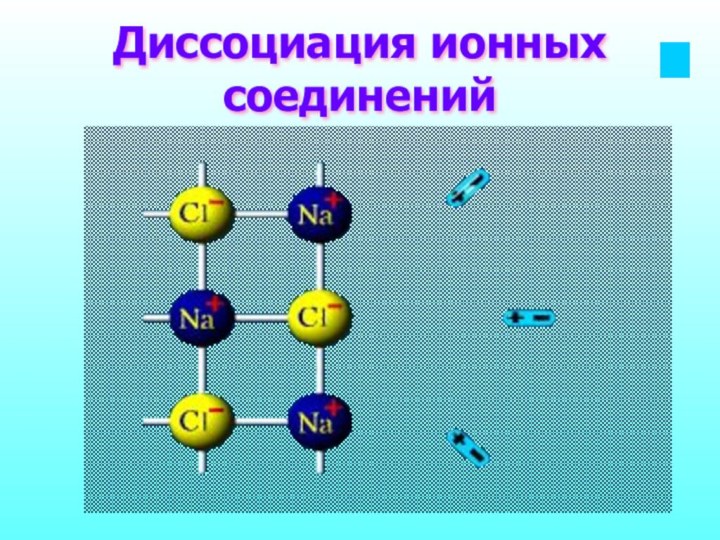
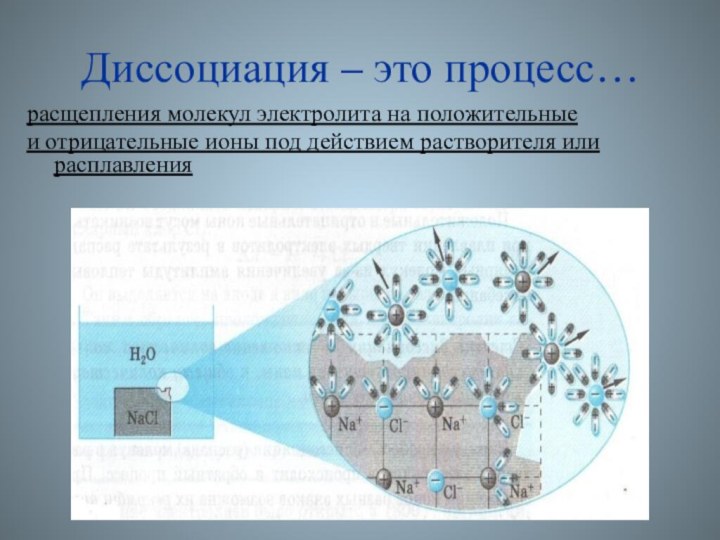
- 11. Диссоциация ионных соединений
- 12. Модельная схема диссоциации солиNaCl = + Na+
- 13. В раствор переходят гидратированные ионыNaCl → Na+ + Cl -
- 14. Электрическая диссоциация – расщепление молекул электролита на положительные
- 15. Электрическая диссоциация – расщепление молекул электролита на
- 16. Причины распада вещества на ионы в расплавах
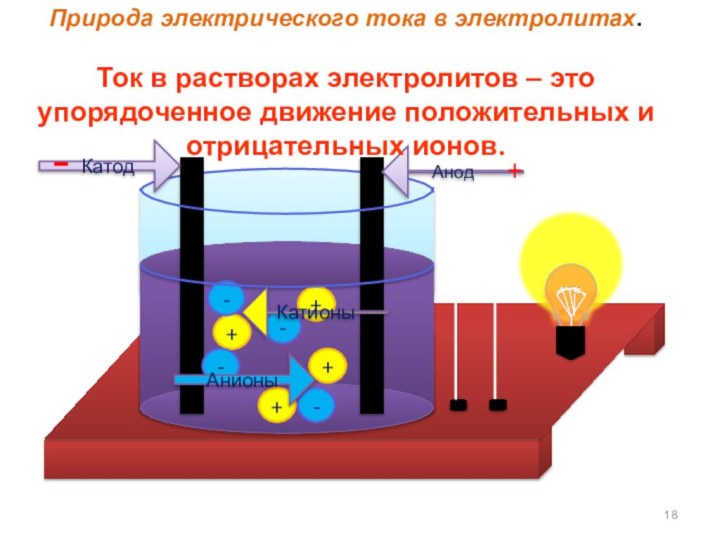
- 18. ++++----АнионыКатионыАнодКатод-+Природа электрического тока в электролитах. Ток
- 19. По электрическим свойствам все жидкости можно разделить
- 20. Опыт №1Выяснить, влияет ли концентрация раствора электролита на силу тока.
- 21. Вывод № 1.Сила тока зависит от концентрации раствора, чем насыщение раствор, тем больше сила тока.
- 22. Опыт №2Установить, как влияет площадь погружения электродов на силу тока.
- 23. Вывод № 2.Сила тока зависит от площади
- 24. Опыт № 3.Установить, как влияет расстояния между электродами на силу тока.
- 25. Вывод № 3.Сила тока зависит от расстояния
- 26. Опыт № 4.Выяснить, как влияет температура электролита на силу тока в нём.
- 27. Вывод № 4. С повышением температуры электропроводность электролита увеличивается.
- 28. Опыт № 5.Выяснить, как влияет природа электролита на силу тока в нём.
- 29. Вывод № 5.Различные электролиты по-разному проводят электрический ток.
- 30. При ионной проводимости прохождение тока связано с
- 31. Процесс выделения на электродах вещества,
- 32. От чего зависит масса вещества, выделившегося на
- 33. 1. Как найти массу вещества, выделившегося на
- 34. 1 закон Фарадея
- 36. 2 закон Фарадеяэлектрохимические эквиваленты веществ прямо пропорциональны
- 37. Применение электролиза ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗАПолучение химически чистых веществГальванопластикаГальваностегия
- 38. Борис Семёнович Якоби
- 39. Изготовление декоративных скульптур методом гальванопластики
- 40. Применение электролиза 1. ГальванопластикаКопия барельефа, полученная методом
- 41. Венцы, чеканка, камни, золочение
- 42. Применение электролиза 2. Гальваностегия Гальваностегия – покрытие
- 43. гальваническое наращивания тонкого слоя Алмазный инструмент, изготовленный методом гальваностегии
- 44. Применение электролиза 3. Получение химически чистых веществ
- 45. Применение электролиза 3. Получение химически чистых веществ
- 46. Промышленное получение алюминия
- 48. Электролиты – это …водные растворы солей, кислот, щелочей.Вещества растворы или расплавы которых проводят электрический ток
- 49. Неэлектролиты – это …дистилированная вода, сахар, минеральное
- 50. Разделить вещества на электролиты и неэлектролиты:Оксид кальцияБензолКислородГидрооксид калияГлюкозаСерная кислотаГидрооксид барияводасераХлорид натрия
- 51. Носителями заряда в электролитах являются… положительные и отрицательные ионы.-+
- 52. © Акимцева А.С. 2008Диссоциация – это процесс…расщепления
- 53. Рекомбинация – это процесс…соединение ионов в нейтральную молекулу.
- 54. Если в электролите нет электрического поля, то
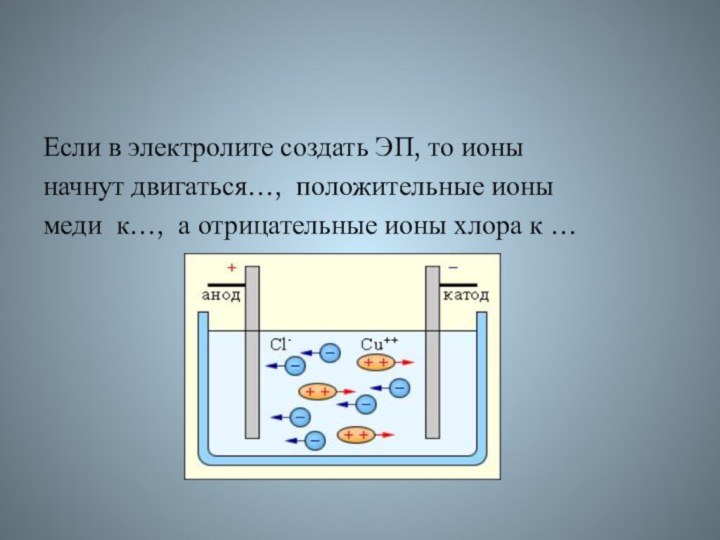
- 55. Если в электролите создать ЭП, то ионы
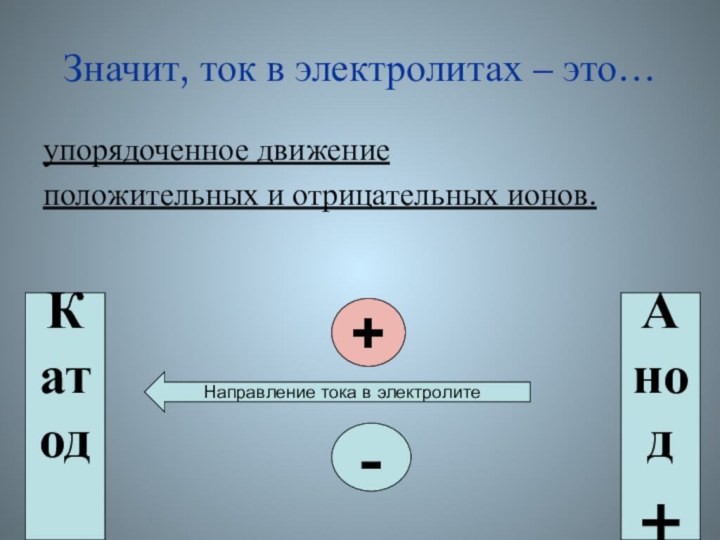
- 56. Значит, ток в электролитах – это…упорядоченное движениеположительных и отрицательных ионов.+-Катод_Анод+Направление тока в электролите
- 57. При прохождении электрического тока через электролит наблюдается…выделение веществ, входящих в электролит, на электродах!!!
- 58. Электролиз – это явление…выделения на электродах веществ,
- 59. КАДан электролит AgNО3. Записать уравнение электролитической
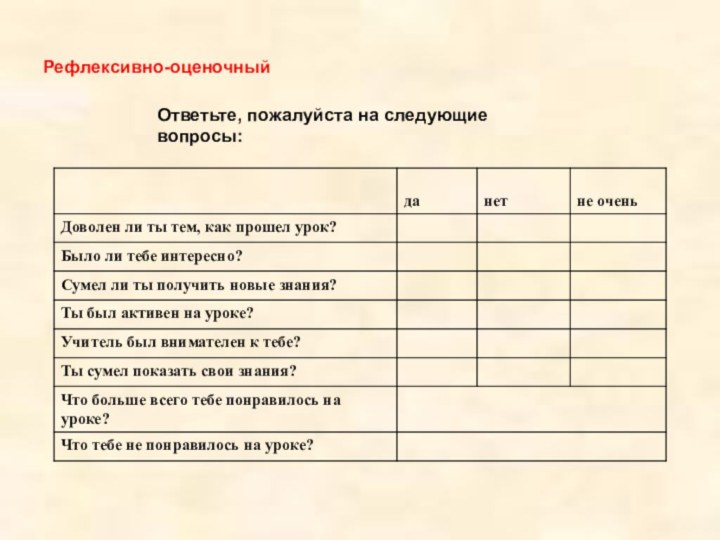
- 60. Рефлексивно-оценочныйОтветьте, пожалуйста на следующие вопросы:
- 61. Итог урока.Д/з §§ 119-120, упр.20 (4,5)
- 62. Скачать презентацию
- 63. Похожие презентации



















































Слайд 2
Повтороение:
Дать определение электрического тока.
По способности проводить электрический ток
твердые тела делятся?
Слайд 3
Сравним свойства проводников
и полупроводников.
Чем обусловлена электрическая
проводимость металлов?
Чем создается электрический ток в чистом
полупроводнике?Влияние примесей на сопротивление проводников?
Влияние примесей на сопротивление полупроводников.
Слайд 4
Зависит ли сопротивление проводников от температуры?.
Зависит ли сопротивление
полупроводников от температуры?.
Слайд 6
Цель урока:
Сравнить электропроводность жидкостей.
Разъяснить физическую природу электропроводности
жидких проводников.
Ввести определение понятий:
- электролиты;
- электрическая диссоциация;
- степень диссоциации.2. Рассмотреть явление электролиза.
3. Закон Фарадея.
4. Применение электролиза в технике.
Слайд 9 Почему чистая вода,раствор сахара не проводят, а
раствор соли проводит электрический ток? Чем обусловлен электрический ток в
растворе соли?
Слайд 10
Строение молекулы воды
Диполь
воды
Взаимодействие молекул воды с молекулами электролита - гидратация
Слайд 14
Электрическая диссоциация – расщепление молекул электролита на положительные и
отрицательные ионы под действием растворителя
В процессе диссоциации:
NaCL. ↔ Na+
+ Cl-,Если в дистиллированную Н2О. налить НCl
НCl↔ Н+ + Cl-,
Если в дистиллированную Н2О. налить NaОН
NaОН↔ Na+ +ОН-
Слайд 15 Электрическая диссоциация – расщепление молекул электролита на положительные
и отрицательные ионы под действием растворителя.
Степень диссоциации – отношение
числа молекул, диссоциировавших на ионы, к общему количеству молекул данного вещества.Рекомбинация – процесс объединения ионов разных знаков в нейтральные молекулы.
Слайд 16
Причины распада вещества на ионы в расплавах
Нагревание
усиливает колебания ионов в узлах кристаллической решётки -кристаллическая решётка
разрушается.Слайд 17 Вывод: подвижными носителями зарядов в растворах,
расплавах солей, кислот и щелочей являются ионы.
Слайд 18
+
+
+
+
-
-
-
-
Анионы
Катионы
Анод
Катод
-
+
Природа электрического тока в электролитах.
Ток в растворах
электролитов – это упорядоченное движение положительных и отрицательных ионов.
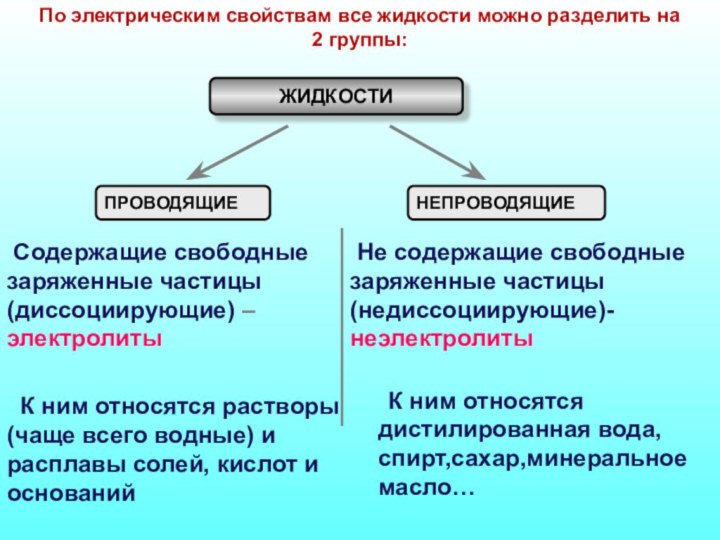
Слайд 19 По электрическим свойствам все жидкости можно разделить на
2 группы:
ЖИДКОСТИ
ПРОВОДЯЩИЕ
НЕПРОВОДЯЩИЕ
Содержащие свободные заряженные частицы (диссоциирующие) – электролиты
Не содержащие свободные заряженные частицы (недиссоциирующие)-неэлектролиты К ним относятся растворы (чаще всего водные) и расплавы солей, кислот и оснований
К ним относятся дистилированная вода, спирт,сахар,минеральное масло…
Слайд 21
Вывод № 1.
Сила тока зависит от концентрации раствора,
чем насыщение раствор, тем больше сила тока.
Слайд 23
Вывод № 2.
Сила тока зависит от площади погружения
электродов, чем больше площадь погружения тем больше сила
тока и наоборот.
Слайд 25
Вывод № 3.
Сила тока зависит от расстояния между
электродами, чем меньше расстояние тем больше сила тока и
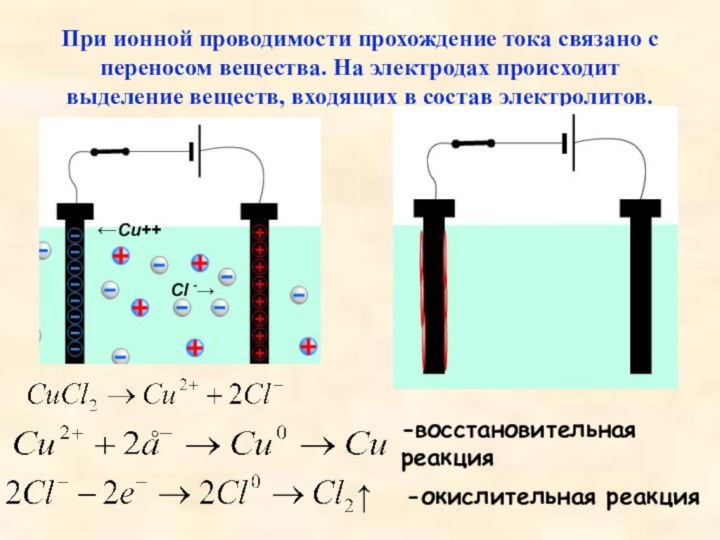
наоборот.Слайд 30 При ионной проводимости прохождение тока связано с переносом
вещества. На электродах происходит выделение веществ, входящих в состав
электролитов.-восстановительная реакция
-окислительная реакция
↑
←Cu++
Cl -→
Слайд 31 Процесс выделения на электродах вещества, связанный
с окислительно-востановительной реакцией – называется электролизом.
Явление
электролиза было открыто в 1800г
анг. физиками
У.Никольсом и А.Карлейлем.
Слайд 32 От чего зависит масса вещества, выделившегося на электродах
за определённое время?
Закон электролиза
(Закон Фарадея).
Исследовал электролиз
и открыл его законы в 1834 г. английский физик Майкл Фарадей
Слайд 33
1. Как найти массу вещества, выделившегося на электродах?
2.
Как найти массу одного иона?
3. Как найти число ионов?
4.
Как найти заряд одного иона? (n – валентность)
Слайд 34
1 закон Фарадея
Масса
вещества, выделившегося на электроде за время Δt при прохождении
электрического тока, прямопропорциональна силе тока и времениK – электрохимический эквивалент вещества (зависит от молярной массы вещества «М» и валентности «n»)
Физ. смысл k – численно равен массе вещества, выделившегося на электроде при прохождении через электролит заряда в 1 Кл.
Слайд 35
- постоянная Фарадея
F=
9,65 *10 -4 Кл/мольФиз.смысл F- численно равна заряду, который надо пропустить через раствор электролита, чтобы выделить на электроде 1 моль одновалентного вещества.
Слайд 36
2 закон Фарадея
электрохимические эквиваленты веществ прямо пропорциональны отношениям
их малярных масс (m) в валентности (n)
k=
Объединенный закон Фарадея
Слайд 37
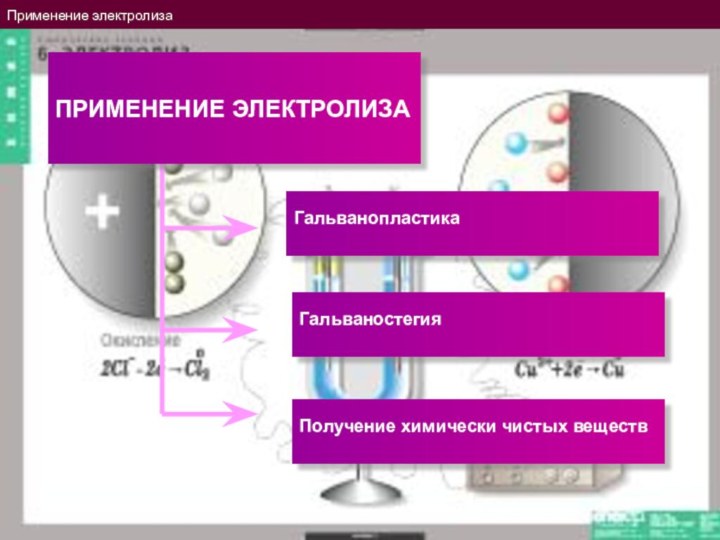
Применение электролиза
ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА
Получение химически чистых веществ
Гальванопластика
Гальваностегия
Слайд 38 Борис Семёнович Якоби
1801-1874
Русский физик и
электротехник, академик Петербуржской Академии наук (1842). Многочисленные труды по практическому применению электричества. В 1838 году создал гальванопластику – процесс изготовления рельефных металлических копий путем электролиза
Слайд 40
Применение электролиза
1. Гальванопластика
Копия барельефа, полученная методом гальванопластики
Гальванопластика – получение отслаиваемых копий предмета, полученных путем осаждения
металла на поверхности предмета электролитическим способом Точность копирования формы предмета очень высокая, т.к. процесс идет на ионном (молекулярном) уровне
Применение:
Получение рельефных копий барельефов, статуй
Изготовление клише, полиграфия
выпуск ценных бумаг, денег
Слайд 42
Применение электролиза
2. Гальваностегия
Гальваностегия – покрытие предметов
неокисляющимся металлами для защиты от коррозии
(Ni, Cr, Zn, Ag,
Au, Cu …) Приведите примеры защитных покрытий в быту и технике
Слайд 43
гальваническое наращивания тонкого слоя
Алмазный инструмент,
изготовленный методом
гальваностегии
Слайд 44
Применение электролиза
3. Получение химически чистых веществ
Рафинирование
меди
+ анод
- катод
Катод – тонкая пластина чистой меди,
анод – толстая пластина неочищенной медиCuSO4
При прохождении тока через электролит на катоде оседает чистая медь, анод расходуется и истощается
Примеси остаются в электролите или оседают на дно
При плотности тока 0,3 А на 1 дм2 процесс идет несколько дней
Слайд 45
Применение электролиза
3. Получение химически чистых веществ
Получение
алюминия
Алюминий получают электролитическим способом из глинозема (вспомните –
алюминий является одним из самых распространенных химических элементов земной коры и содержится в любой глине)Электролитическим способом получают:
Магний, натрий, калий, кальций …
Соду, хлор, хлористый кальций …
Осуществив, например, электролиз раствора поваренной соли NaCl, мы можем получить сразу 3 полезных химических вещества:
Газообразные водород и хлор, а также раствор едкого натра NaOH
Слайд 48
Электролиты – это …
водные растворы солей, кислот, щелочей.
Вещества
растворы или расплавы которых проводят электрический ток
Слайд 49
Неэлектролиты – это …
дистилированная вода, сахар, минеральное масло,
спирт,нерастворимые оксиды …..
Вещества растворы и расплавы которых не проводят
электрический ток
Слайд 50
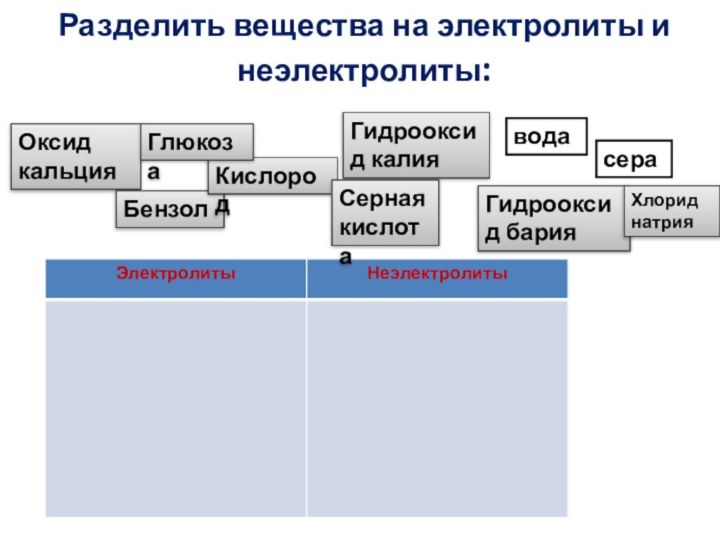
Разделить вещества на электролиты и неэлектролиты:
Оксид кальция
Бензол
Кислород
Гидрооксид калия
Глюкоза
Серная
кислота
Гидрооксид бария
вода
сера
Хлорид натрия
Слайд 52
© Акимцева А.С. 2008
Диссоциация – это процесс…
расщепления молекул
электролита на положительные
и отрицательные ионы под действием растворителя
или расплавления
Слайд 55
Если в электролите создать ЭП, то ионы
начнут
двигаться…, положительные ионы
меди к…, а отрицательные ионы хлора к
…
Слайд 56
Значит, ток в электролитах – это…
упорядоченное движение
положительных и
отрицательных ионов.
+
-
Катод
_
Анод
+
Направление тока в электролите
Слайд 57
При прохождении электрического тока через электролит наблюдается…
выделение веществ,
входящих в
электролит, на электродах!!!
Слайд 58
Электролиз – это явление…
выделения на электродах веществ,
входящих
в состав электролита, при
протекании через него электрического
тока.
Слайд 59
К
А
Дан электролит AgNО3. Записать уравнение электролитической
диссоциации и указать направление ионов.
AgNО3↔
Ag+ +
NО3
-AgNО3
Ag+
NО3-
Какое вещество будет выделяться на катоде при электролизе электролита?
Диссоциация других веществ:
КОН ↔
К+ +
ОН-
H2SO4 ↔
H+ + H+ +
SO42-
СаСl2 ↔
Ca 2++
Cl- + Cl-