- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Двойной электрический слой
Содержание
- 2. Граница электрод-растворПереход электрона из металла на находящуюся
- 3. Адсорбция и пространственное разделение зарядаВследствие энергетически неравноценного
- 4. Положительная адсорбцияЕсли концентрация частиц увеличивается по мере
- 5. Причиныгидрофобные органические вещества в водных растворах, которые
- 6. Отрицательная адсорбцияЕсли концентрация частиц убывает по мере
- 7. ПричиныОтрицательная адсорбция может быть вызванаили втягиванием сильно
- 8. Уравнение Гиббса
- 9. Адсорбция в двухкомпонентной системе
- 10. Получаем
- 11. относительный поверхностный избыток
- 12. Адсорбция и поверхностная концентрацияСледует различать понятия поверхностного
- 13. Модель адсорбции на электроде поверхностный избыток (адсорбция)
- 14. Потенциал нулевого зарядаЭлектродный потенциал, при котором на
- 15. Трехэдектродная система
- 18. образование двойного электрического слоя всегда тесно связано
- 19. Адсорбционный метод изучения двойного электрического слоянеобходимо использовать
- 20. Идеально поляризуемый электродесли подводимое к электроду электричество
- 21. Емкость двойного электрического слояДвойной электрический слой в
- 22. Электрохимический импедансИзмерение емкости можно проводить
- 23. Вольтамперометрические и кулонометрические методы изучения строения двойного электрического слоя и адсорбции на электродах
- 24. Совершенно поляризуемый электрод
- 25. Дофазовое осаждение
- 27. Общая поляризационная емкостьобщая поляризационная емкость C складывается
- 29. Потенциалы Нернста и Вольта
- 30. Роль растворителя в формировании потенциала нулевого зарядаМежду
- 31. Строение ДЭС
- 32. Скачать презентацию
- 33. Похожие презентации
Граница электрод-растворПереход электрона из металла на находящуюся в растворе частицу или обратный процесс — переход электрона с частицы на электрод — протекает на границе фаз и зависит от того, как построена эта граница































Слайд 3
Адсорбция и пространственное разделение заряда
Вследствие энергетически неравноценного состояния
частиц на поверхности
и в объеме раствора их равновесная
концентрация изменяется по мере приближения к границе раздела фаз. Это явление получило название адсорбции.
явление — пространственным разделением зарядов и обусловленным этим изменением гальвани -потенциала
Слайд 4
Положительная адсорбция
Если концентрация частиц увеличивается по мере приближения
к поверхности, то адсорбция называется положительной (рис. 7.1, кривая
1).Положительная адсорбция может быть обусловлена «выталкиванием» частиц из объема на поверхность.
Слайд 5
Причины
гидрофобные органические вещества в водных растворах, которые нарушают
водородные связи между молекулами воды в объеме раствора. Выигрыш
энергии за счет восстановления этих связей при переходе органических молекул на поверхность и служит причиной их «выжимания» из объема раствора.взаимное притяжение между поверхностью электрода и частицами раствора. Это взаимодействие может быть чисто электростатическим (например, катионы притягиваются к отрицательно заряженной поверхности металла) или специфическим, обусловленным более сложными ковалентными) силами взаимодействия поверхности металла с адсорбированными частицами
Слайд 6
Отрицательная адсорбция
Если концентрация частиц убывает по мере приближения
к
поверхности, то адсорбция называется отрицательной (см. рис.
7.1, кривая 2).
Слайд 7
Причины
Отрицательная адсорбция может быть вызвана
или втягиванием сильно сольватированных
частиц с поверхности
в объем раствора, или отталкиванием ионов от
одноименно заря@женнойповерхности электрода. Первыйэффект приводит к за@
метнойотрицательнойадсорбции только в концентрированных
растворах (1 моль/л), в то время как отталкивание ионов от одно@
именно заряженнойповерхности электрода вызывает существен@
ную отрицательную адсорбцию и в разбавленных растворах
Слайд 12
Адсорбция и поверхностная концентрация
Следует различать понятия поверхностного избытка
Гi (адсорбции) и поверхностной концентрации Ai, т. е. количества
компонента i, непосредственно связанного с единицей поверхности электрода.Обе величины (Гi и Ai) имеют одинаковую размерность (моль/м2),
однако поверхностная концентрация — величина всегда положительная, тогда как поверхностный избыток может быть как положительным, так и отрицательным
Слайд 13
Модель адсорбции на электроде
поверхностный избыток (адсорбция) характеризует
изменение состава поверхностного слоя по сравнению с некоторой идеальной
системoй , в которой концентрация всех компонентов остается неизменной вплоть до границы раздела фаз.К такой идеальной системе близка по своим свойствам граница раздела между электродом, на поверхности которого нет свободных зарядов (q = 0), и разбавленным раствором электролита, ионы которого не «выжимаются» из раствора и не проявляют специфического взаимодействия с металлом электрода.
Слайд 14
Потенциал нулевого заряда
Электродный потенциал, при котором на поверхности
электрода нет свободных зарядов (q= 0), называется потенциалом нулевого
заряда Eq=0.Понятие о потенциале нулевого заряда как о важной электрохимической характеристике электрода было введено А.Н.Фрумкиным (1927 г.)
Слайд 18 образование двойного электрического слоя всегда тесно связано с
адсорбцией на границе электрод/раствор ионов и полярных молекул.
Чтобы
изучить строение двойного электрического слоя, помимо адсорбционных данных необходимо знать приведенные потенциалы ϕ0 и заряды поверхности электрода q. На основе этих данных далее строится модель двойного слоя, описывающая распределение заряженных частиц и потенциала в зависимости от расстояния до поверхности электрода
Слайд 19
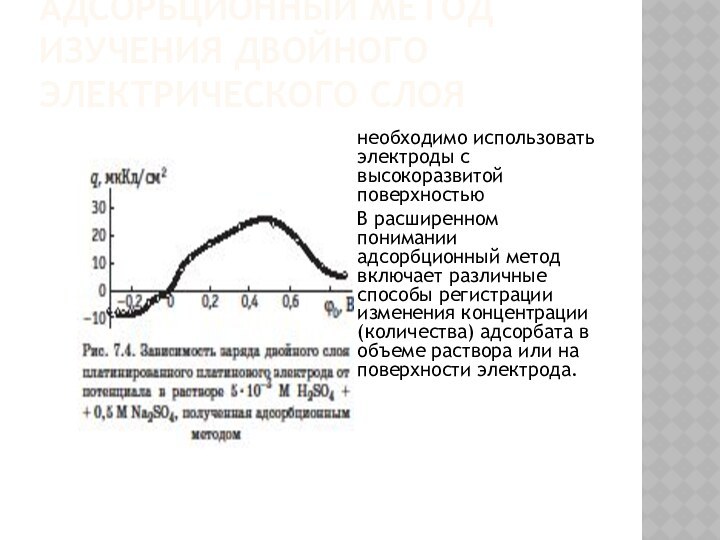
Адсорбционный метод изучения двойного электрического слоя
необходимо использовать электроды
с высокоразвитой поверхностью
В расширенном понимании адсорбционный метод включает различные
способы регистрации изменения концентрации (количества) адсорбата в объеме раствора или на поверхности электрода.
Слайд 20
Идеально поляризуемый электрод
если подводимое к электроду электричество затрачивается
только на изменение заряда поверхности q,
т. е. на
электроде при заданном потенциале не протекает электрохимическая реакция.
Слайд 21
Емкость двойного электрического слоя
Двойной электрический слой в первом
приближении можно рассматривать как конденсатор с удельной емкостью С
в условиях идеально поляризуемого электрода.Если же электрод не является идеально поляризуемым, то часть подведенного электричества затрачивается на электрохимическую реакцию и отношение С= Δq/ΔE, называемое поляризационной емкостью, не равно емкости двойного слоя.
Выделение последней из поляризационной емкости возможно лишь при количественном учете фарадеевского процесса (электрохимической реакции).
Слайд 22
Электрохимический импеданс
Измерение емкости можно проводить разнообразными
приемами.
Наиболее точные измерения основаны на использовании синусоидального переменного
тока.Общее сопротивление электрической цепи такому току называется импедансом
Слайд 23 Вольтамперометрические и кулонометрические методы изучения строения двойного электрического слоя и
адсорбции на электродах
Слайд 27
Общая поляризационная емкость
общая поляризационная емкость C складывается в
этом случае из емкости двойного электрического слоя C д.э.с
и некоторой псевдоемкости, представляющей собой величину
Слайд 30
Роль растворителя в формировании потенциала нулевого заряда
Между атомами
кислорода в молекулах Н2O и незаряженной поверхностью металла существует
донорно-акцепторное взаимодействие, которое проявляется гораздо сильнее в случае галлия, чем в случае ртути.Возникающие вследствие такого взаимодействия хемосорбированные на галлии диполи воды вносят существенный
вклад в отрицательную составляющую гальвани-потенциала
.