Слайд 2
Содержание :
1. Определение сущности процесса электролиза
2. Электролиз в
расплавах:
а) процессы на катоде
б) процессы на аноде
в) примеры электролиза в расплавах электролитов
3. Электролиз в растворах:
а) процессы на катоде
б) процессы на аноде
в) примеры электролиза в растворах электролитов
4. Области использования электролиза: а) получение чистых металлов б) очистка металлов в) получение щелочей, галогенов, водорода г) гальваностегия в) гальванопластика г) косметология
5. Тест по теме «Электролиз»
6. Домашнее задание
7.Список использованной литературы и Интернет-ресурсов
Слайд 3
Электролиз – это окислительно-восстановительный процесс, протекающий на электродах
в растворах или расплавах электролитов при пропускании электрического тока.
Сущность электролиза заключается в том, что за счет электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.
Слайд 4
Электролиз в расплавах
На катоде происходит процесс восстановления
•
В расплавах катионы металла восстанавливаются до свободного металла:
Мn+ +
nē = М0
Электролиз в расплавах
На аноде происходит
процесс окисления
• В расплавах анионы бескислородных кислот (кроме фторидов) окисляются до соответствующего простого вещества, например:
2Cl– – 2ē = Cl20
• Кислородсодержащие анионы выделяют кислород и превращаются в один из оксидов:
SO42– – 2ē = SO20 + O20.
Слайд 6
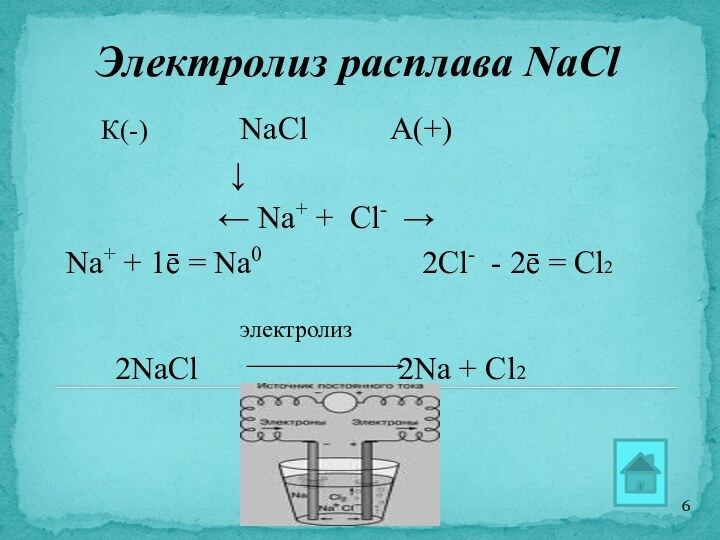
Электролиз расплава NaCl
К(-)
NaCl А(+)
↓
← Na+ + Cl- →
Na+ + 1ē = Na0 2Cl- - 2ē = Cl2
электролиз
2NaCl 2Na + Cl2
Слайд 7
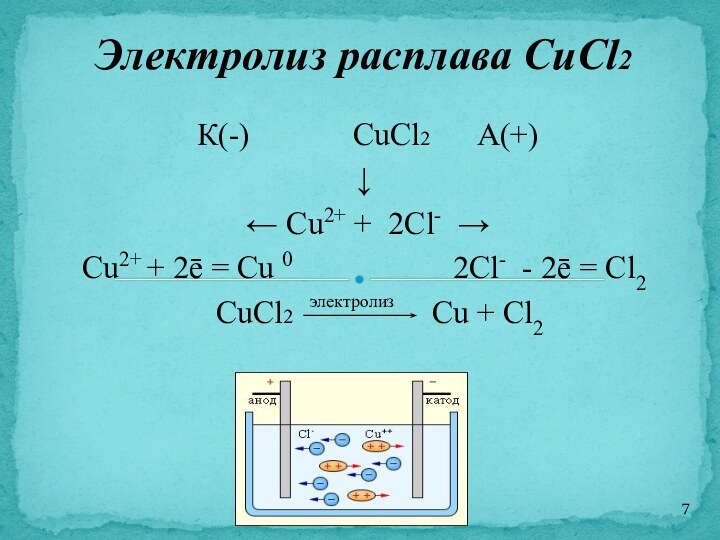
К(-) CuCl2 А(+)
↓
← Cu2+ + 2Cl- →
Cu2+ + 2ē =
Cu 0 2Cl- - 2ē = Cl2
CuCl2 Cu + Cl2
Электролиз расплава CuCl2
электролиз
Слайд 8
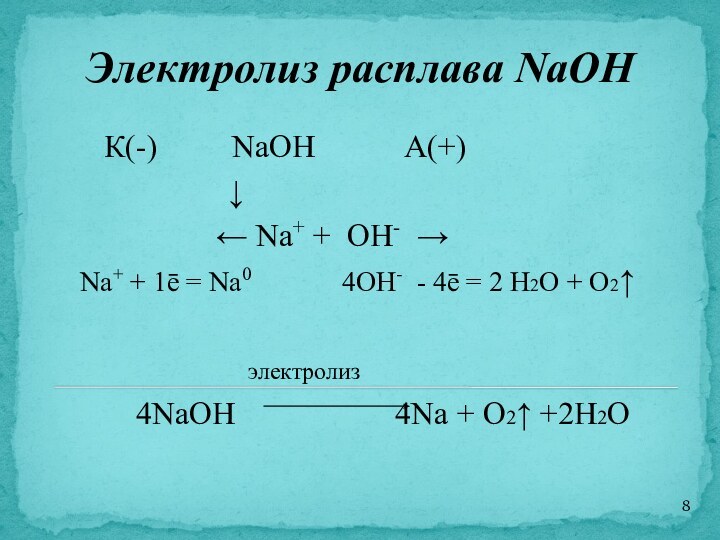
Электролиз расплава NaOH
К(-) NaOH А(+)
↓
← Na+ + OH- →
Na+ + 1ē = Na0 4OH- - 4ē = 2 H2O + O2↑
электролиз
4NaOH 4Na + O2↑ +2H2O
Слайд 9
Электролиз в растворах
(процесс на катоде)
В растворах процесс
на катоде не зависит от материала катода, а зависит
от активности восстанавливаемого металла.
а) Если металл расположен в ряду напряжений от Li до Al включительно, то на катоде идет процесс восстановления воды:
2Н2О + 2ē = H20 + 2OH–
Электролиз в растворах
(процесс на катоде)
б)
Если металл расположен в ряду напряжений между Al и H2 , то на катоде идут одновременно процессы восстановления воды и катионов металла:
2Н2О + 2ē = H20 + 2OH–
Мn+ + nē = М0
в) Если металл расположен в ряду напряжений после Н2, то на катоде идет процесс восстановления катионов металла:
Мn+ + nē = М0
При электролизе растворов кислот идет процесс восстановления ионов водорода:
2Н+ + 2ē = H20
Слайд 11
Процесс на аноде
В растворах процесс на аноде зависит
от материала анода и от природы аниона.
Аноды могут быть двух видов – растворимые (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза) и нерастворимые, или инертные (уголь, графит, платина, золото)
а) Если анод растворимый, то независимо от природы аниона всегда идет окисление металла анода, например:
Cu0 – 2ē = Cu2+
Слайд 12
Процесс на аноде
б) Если анод инертный, то в
случае бескислородных анионов (кроме фторидов) идет окисление анионов:
2Cl– –
2ē = Cl20
В случае кислородсодержащих анионов и фторидов идет процесс окисления воды, анион при этом не окисляется и остается в растворе:
2H2O – 4ē = O20 + 4H+
При электролизе растворов щелочей идет окисление гидроксид-ионов:
4OH– – 4ē = O20 + 2H2O
Слайд 13
Электролиз раствора NaCl
на инертном аноде
К(-) NaCl А(+)
↓
← Na+ + Cl- →
2Н2О + 2ē = H2 + 2OH- 2Cl- - 2ē = Cl2↑
электролиз
2NaCl + 2H2O H2 + Cl2 +2NaOH
Слайд 14
Электролиз раствора CuSO4
на инертном аноде
К(-) CuSO4 А(+)
↓
← Cu2+ + SO42- →
Cu2+ + 2ē = Cu0 2H2O – 4ē = O2↑ + 4H+
электролиз
2CuSO4 + 2 H2O 2Cu + O2 + 2 H2SO4
Слайд 15
Электролиз раствора NaCl
на
растворимом аноде
К(-) NaCl А(+)
↓ (Cu)
← Na+ + Cl- →
Cu2+ + 2ē = Cu0 Cu0 – 2ē =Cu2+
(т.к. Cu2+ в ряду напряжений
стоят после H+)
Происходит переход ионов меди с анода на катод. Концентрация NaCl в растворе не меняется.
Слайд 16
Применение электролиза:
получение чистых металлов (Алюминий, магний, натрий, кадмий
получают только электролизом)
Слайд 18
получение щелочей, хлора, водорода
Слайд 19
защита металлов от коррозии (При этом на поверхности
металлических изделий электрохимическим методом наносят тонкий слой другого металла,
устойчивого к коррозии). Этот раздел гальванотехники называется ГАЛЬВАНОСТЕГИЯ (от гальвано... и греч. stego - покрываю)
Слайд 20
копирование рельефных изделий из металлов и других материалов.
Гальванопластика позволяет создавать документально точные копии барельефов, монет, гербов,
медалей, эмблем и т.д. Широко применяется при реставрации.
Слайд 21
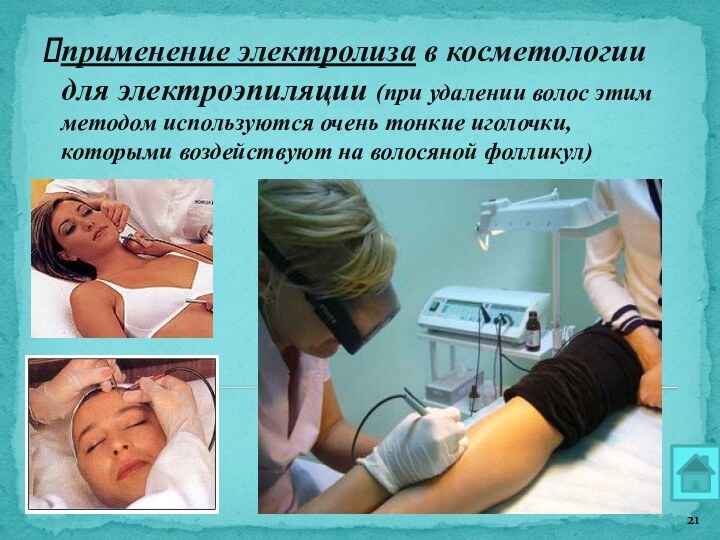
применение электролиза в косметологии для электроэпиляции (при удалении
волос этим методом используются очень тонкие иголочки, которыми воздействуют
на волосяной фолликул)
Слайд 22
Тест по теме "Электролиз"
1. При электролизе раствора сульфата
цинка с инертными электродами на аноде выделяется:
а) цинк;
б) кислород; в) водород; г) сера.
2. При электролизе раствора хлорида натрия образуются:
а) натрий и хлор;
б) гидроксид натрия, хлор и водород;
в) кислород и хлор;
г) натрий, хлор и соляная кислота.
Слайд 23
3. При электролизе расплава гидроксида натрия на аноде
выделяется:
а) натрий; б) водород; в) кислород;
г) вода
4. Платиновый электрод:
а) инертный;
б) растворимый;
в) расходуется в процессе электролиза;
г) не расходуется в процессе электролиза.
Слайд 24
5. Процесс на катоде при электролизе растворов солей
зависит от:
а) природы катода;
б) активности металла;
в) состава аниона;
г) не
зависит от перечисленных факторов.
6. При электролизе раствора нитрата меди(II) с медными электродами на аноде будет происходить:
а) выделение диоксида азота;
б) выделение монооксида азота;
в) растворение анода;
г) выделение кислорода.
Слайд 25
7. При электролизе 240 г 15%-го раствора гидроксида
натрия на аноде выделилось 89,6 л (н.у.) кислорода. Массовая
доля вещества в растворе после окончания электролиза равна (в %):
а) 28,1; б) 32,1; в) 37,5; г) 40,5.
8. Медный купорос массой 100 г растворили в воде и провели электролиз до обесцвечивания раствора. Объем (в л, н.у.) собранного газа равен:
а) 2,24; б) 4,48; в) 11,2; г) 22,4.
Слайд 26
А теперь проверим ваши ответы!
1-б
2-б
3-в, г
4-а, г
5-б
6- в
7-
в
8-б
Слайд 27
Домашнее задание:
Учебник О.С.Габриеляна Химия 11 класс
§ 18 (стр.217 -
222), упр. 22,23,25.
Слайд 28
Список использованной литературы:
1. О.С.Габриелян Учебник химии для
11 класса, М., Дрофа, 2004г.
Интернет – ресурсы:
1. http://www.nontoxicprint.com/electroetching.htm
2. http://dic.academic.ru/dic.nsf/enc_colier/3192/ХИМИЧЕСКИЕ
3.
http://atecom.ru/ru/hydrogen/
4. http://festival.1september.ru/articles/564677/
5. http://www.nickelca.ru/professions/metallurgy/
6. http://t-coins.narod.ru/Hidro.htm
7. http://medicini.info/raznoe/165-udalenie-volos-metodom-elektroliza.html
8. http://www.bayertechnology.com/ru/produkty/khlor-ehlektroliz.html
9. http://www.interfax.by/article/4066