- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Электролиз растворов солей
Содержание
- 2. Электролиз – это совокупность окислительно-восстановительных процессов, протекающих
- 5. Cu(NO3)2, HOHCu+2Катод (– )Анод (+)OH-1
- 6. NaCl, HOH Na+1
- 7. При электролизе раствора нитрата серебра масса катода
- 8. Задача (продолжение)Сократим Н2О в обоих частях уравнения: 4AgNO3
- 9. Выберите формулы солей, при электролизе водных растворов
- 10. Скачать презентацию
- 11. Похожие презентации








Слайд 5
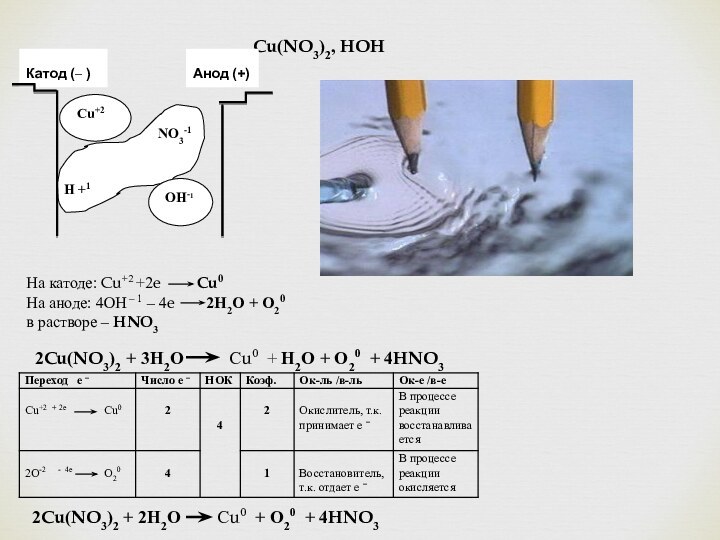
Cu(NO3)2, HOH
Cu+2
Катод (– )
Анод (+)
OH-1
NO3-1
Н +1
На катоде: Cu+2 +2e Cu0
На аноде: 4ОН – 1 – 4e 2Н2О + О20
в растворе – HNO3
2Cu(NO3)2 + 3Н2О Сu0 + Н2О + О20 + 4HNO3
2Cu(NO3)2 + 2Н2О Сu0 + О20 + 4HNO3
Слайд 6
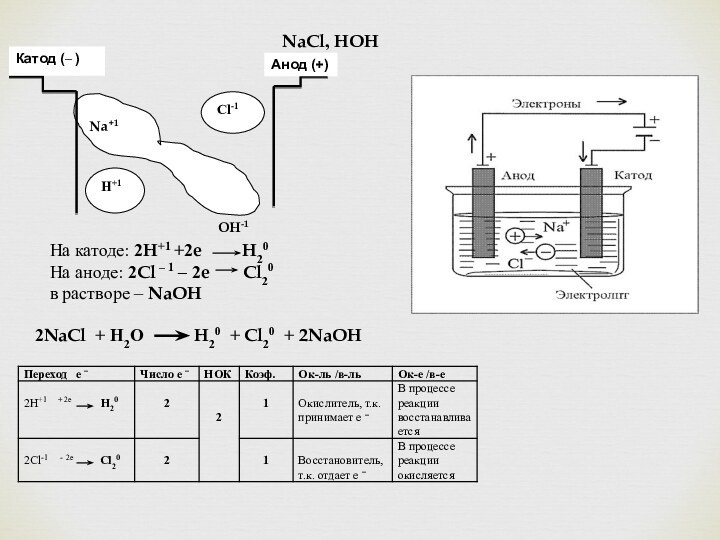
NaCl, HOH
Na+1
OH-1
Cl-1
Катод (– )
Анод (+)
H+1
На катоде: 2H+1 +2e H20
На аноде: 2Cl – 1 – 2e Cl20
в растворе – NaOH
2NaCl + Н2О H20 + Cl20 + 2NaOH
Слайд 7 При электролизе раствора нитрата серебра масса катода увеличилась
на 6 г. Вычислите объем газа выделившегося на аноде.
ДаноРешение
1) Составим схему электролиза
AgNO3, HOH
m катода увел на 6г,
следовательно,
m (Ag) = 6 г.
V газа на аноде?
Анод (+)
Катод (– )
NO3 NO3-1
H+1
Ag+1
OH-1
На катоде: Ag+1 +1e Ag0
На аноде: 4ОН – 1 – 4e 2Н2О + О20
в растворе – HNO3
2) Составим уравнение реакции электролиза:
4AgNO3 + 3Н2О 4Ag0 + Н2О + О20 + 4HNO3
Задача
Слайд 8
Задача (продолжение)
Сократим Н2О в обоих частях уравнения:
4AgNO3 +
2Н2О
4Ag0 + О20 + 4HNO33. v (Ag)= m/M = 6г/108 г/моль = 0,56 моль
4
5. V (O2)= 0,14 моль * 22,4 л/моль = 3,136 л
Ответ: V (O2 =3,136 л
Слайд 9 Выберите формулы солей, при электролизе водных растворов которых
на катоде
оседает металл. Свой
выбор объясните.CuCl2, KNO3, AgNO3, BaCl2, Fe2(SO4)3, Cr(NO3)3,
NaBr
2. При электролизе водных растворов каких солей из
задания 1 на аноде может быть получен кислород?
Почему?
3. При электролизе водных растворов каких солей из
задания 1 на катоде может быть получен водород?
Почему?
4. При электролизе водных растворов каких солей из
задания 1 в растворе будет образовываться кислота?
Почему?
5. При электролизе водных растворов каких солей из
задания 1 в растворе будет образовываться щелочь?
Почему?
Ответьте на вопросы