Слайд 2
Электроны в атоме
Из основного свойства заряженных тел
и частиц следует, что неподвижными электроны в атоме быть
не могут. Ведь в этом случае они, притянувшись к ядру, просто упали бы на него, и атом перестал бы существовать. Следовательно, электроны в атоме движутся.
Но уже Резерфорду было ясно, что просто вращаться вокруг ядра электроны не могут. В то время уже были известны законы электродинамики, в соответствии с которыми вращающийся вокруг ядра электрон обязан постепенно терять свою энергию, что должно приводить в конце концов, к его падению на ядро.
Эта исключительно сложная проблема хоть не всегда последовательно, но была решена в первой трети ХХ века в результате работ многих выдающихся физиков: Нильса Бора, Альберта Эйнштейна, Эрвина Шрёдингера, Вернера Гейзенберга, Макса Борна и многих других ученых.
Вспомним три основные особенности поведения электронов в атоме.
Слайд 3
Первая особенность.
Энергия свободного электрона, так же как и
энергия тела, может изменяться непрерывно, но энергия связанного электрона,
в частности электрона в атоме, может принимать только вполне определенные значения. При переходе электрона из одного состояния в другое энергия поглощается или выделяется порциями – квантами энергии. Поэтому первая особенность поведения электрона часто называется принципом квантования его энергии. Эта особенность была постулирована датским физиком Нильсом Бором в 1913 году и в дальнейшем получила блестящее экспериментальное подтверждение.
Слайд 4
Вторая особенность.
Электрон в одних случаях проявляет свойства
частицы вещества, а в других – волновые свойства. Такая
двойственность поведения электрона и других микрочастиц (дуализм) – одно из общих свойств материи (и вещества, и поля). Оно называется "корпускулярно-волновой дуализм"или "дуализм волна-частица ".
Волновые свойства электрона проявляются, например, при прохождении потока электронов через тончайшую кристаллическую пленку. Поток электронов ведет себя так, как будто через эту пленку прошли волны, то есть, подвергается дифракции(огибание волнами встречающегося на их пути препятствия ,если его размер сопоставим с длиной волны) и интерференции(увеличение гребней и уменьшение впадин волн при наложении их друг на друга) Эту особенность поведения электрона предсказал французский физик Луи де Бройль в 1924 году, а в 1926 году американский физик Девиссон впервые наблюдал дифракционную картину при взаимодействии потока электронов с металлами.
Слайд 5
Третья особенность.
Чем с большей точностью определяют положение
электрона в пространстве, тем с меньшей точностью можно определить
его скорость. И наоборот, чем с большей точностью определяют скорость электрона (абсолютную величину и направление), тем с меньшей точностью можно определить его положение в пространстве. Это утверждение, а оно справедливо и для других микрочастиц, называется "принцип неопределенностей". Этот принцип был сформулирован немецким физиком Вернером Гейзенбергом в 1927 году.
Принцип неопределенностей "лишает "летящий электрон траектории. Действительно, если мы в какой-то момент точно знаем положение электрона, то мы принципиально ничего не знаем о его скорости и в следующий момент времени можем обнаружить электрон в любой другой точке атома, правда, с разной вероятностью.
Слайд 6
Неопределенность установления положения и скорости электрона столь велика,
что необходимо вообще отказаться от анализа траектории его движения.
Однако есть возможность вероятностного описания строения атома.
Согласно квантовой механике, движение электрона в атоме описывается волновым уравнением (уравнение Шредингера):
Решением уравнения Шредингера является волновая функция Ψ и соответствующее ей значение энергии электрона E. Вероятность нахождения электрона в пространстве характеризуется квадратом волновой функции, т.е. величиной |Ψ|2. Для описания строения атома можно рассматривать электрон как бы “размазанным” в пространстве в виде электронного облака. Величина |Ψ|2, полученная из волнового уравнения, является мерой электронной плотности в данном элементе объема, или мерой вероятности нахождения электрона в данном элементе объема атома.
Слайд 7
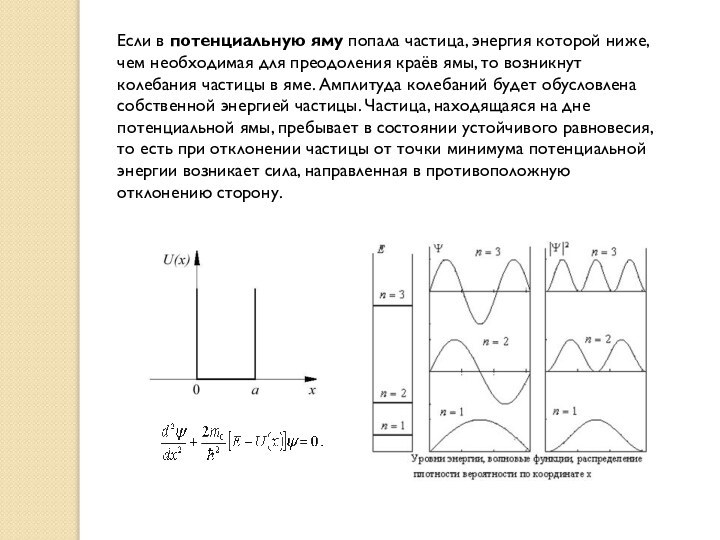
Если в потенциальную яму попала частица, энергия которой
ниже, чем необходимая для преодоления краёв ямы, то возникнут
колебания частицы в яме. Амплитуда колебаний будет обусловлена собственной энергией частицы. Частица, находящаяся на дне потенциальной ямы, пребывает в состоянии устойчивого равновесия, то есть при отклонении частицы от точки минимума потенциальной энергии возникает сила, направленная в противоположную отклонению сторону.
Слайд 8
Наличие трех измерений пространства приводит к тому, что

в выражении волновой функции Ψ, являющейся решением уравнения Шредингера,
появляются три величины, которые могут принимать только дискретные целочисленные значения – три квантовых числа. Они обозначаются символами n, l и ml. Эти квантовые числа характеризуют состояние электрона не только в атоме водорода, но и в любом другом атоме.Дополнительным квантовым числом ms характеризуют электрон.
Атомная орбиталь — одноэлектронная волновая функция, полученная решением уравнения Шрёдингера задаётся главным n, орбитальным l и магнитным ml квантовыми числами.
Название «орбиталь» (а не орбита) отражает геометрическое представление о стационарных состояниях электрона в атоме; такое особое название отражает тот факт, что состояния электрона в атоме описывается законами квантовой механики и отличается от классического движения по траектории. Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку.
Слайд 9
Характеристика электронов квантовыми числами состоит в следующем.
а)

Главное квантовое число (n) определяет средний радиус электронного облака,
или общую энергию электрона на данном уровне. Оно принимает натуральные значения от 1 до ∞. В реальных атомах n имеет 7 значений, обозначаемых латинскими буквами K, L, M, N, O, P, Q. Значение n=1 отвечает уровню с самой низкой энергией (т.е. наиболее устойчивому состоянию электрона).
Теоретически количество уровней не ограничено, но в атоме главным образом бывают заняты электронами уровни с низкой энергией.
б) Побочное, или орбитальное, квантовое число (l). В спектрах многоэлектронных атомов наблюдается мультиплетная структура линий, т.е. линии расщеплены на несколько компонент.
в) Магнитное квантовое число (ml). Если атом поместить во внешнее магнитное поле, то происходит дальнейшее расщепление спектральных линий. Это означает, что при данных значениях n и l может существовать несколько состояний электрона с одинаковой энергией.
г) Спиновое квантовое число (ms) не связано с движением электрона около ядра, а определяет его собственное состояние.
Слайд 11
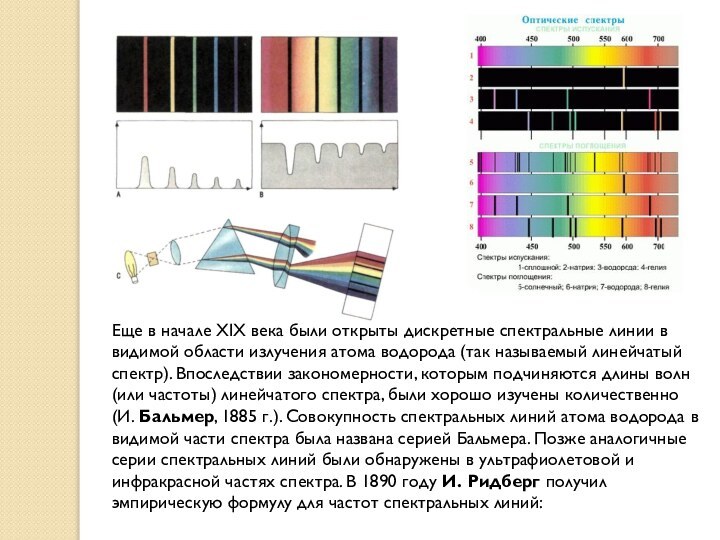
Еще в начале XIX века были открыты дискретные спектральные
линии в видимой области излучения атома водорода (так называемый
линейчатый спектр). Впоследствии закономерности, которым подчиняются длины волн (или частоты) линейчатого спектра, были хорошо изучены количественно (И. Бальмер, 1885 г.). Совокупность спектральных линий атома водорода в видимой части спектра была названа серией Бальмера. Позже аналогичные серии спектральных линий были обнаружены в ультрафиолетовой и инфракрасной частях спектра. В 1890 году И. Ридберг получил эмпирическую формулу для частот спектральных линий:
Слайд 12
Иоганн Якоб Бальмер (1825 —1898) — швейцарский математик и физик.
Йоханнес
Роберт Ридберг (1854 – 1919)
— шведский физик
Слайд 14
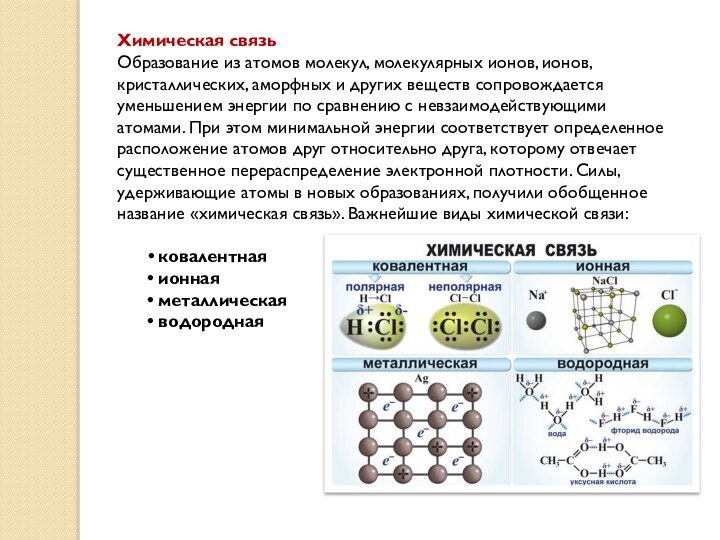
Химическая связь
Образование из атомов молекул, молекулярных ионов, ионов,
кристаллических, аморфных и других веществ сопровождается уменьшением энергии по
сравнению с невзаимодействующими атомами. При этом минимальной энергии соответствует определенное расположение атомов друг относительно друга, которому отвечает существенное перераспределение электронной плотности. Силы, удерживающие атомы в новых образованиях, получили обобщенное название «химическая связь». Важнейшие виды химической связи:
ковалентная
ионная
металлическая
водородная
Слайд 15
Формы электронных облаков и химическая связь
Согласно квантовой модели

фтома форма электронного облака определяется решением волноавого уравнения Шредингера
при опреледенныз граничных условиях.
Источниками сил, связывающих атомы друг с другом, являются зоны перекрытия электронных облаков. Зоны перекрытия одновременно являются частью электронных облаков обоих соприкасающихся атомов. Чем больше зон перекрытия, тем крепче связь между атомами. Каждый электрон электронного облака на большей части своей траектории взаимодействует преимущественно с одним из протонов ядра, формируя часть электронного облака – электронный лепесток. Но в зонах перекрытия электроны могут переходить из одного электронного лепестка в другой. Электронные лепестки, связанные с протонами законченной ядерной оболочки в межатомных связях не участвуют. Они сливаются в сплошное электронное облако, границы которого намного ближе к центру ядра, чем концы обособленных электронных лепестков. По этой причине сплошное электронное облако не достает до электронных облаков соседних атомов и не способно создавать с ними зоны перекрытия. Межатомные связи способны создавать только обособленные электронные лепестки.
Слайд 16
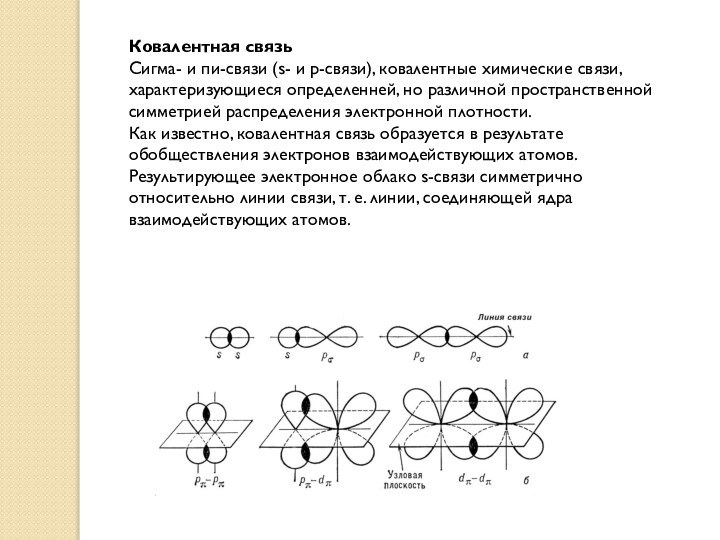
Ковалентная связь
Сигма- и пи-связи (s- и p-связи), ковалентные
химические связи, характеризующиеся определенней, но различной пространственной симметрией распределения
электронной плотности.
Как известно, ковалентная связь образуется в результате обобществления электронов взаимодействующих атомов. Результирующее электронное облако s-связи симметрично относительно линии связи, т. е. линии, соединяющей ядра взаимодействующих атомов.
Слайд 17
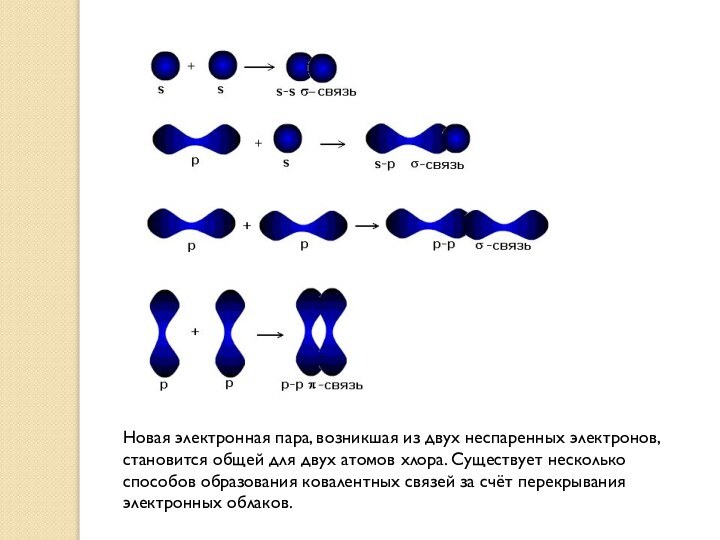
Новая электронная пара, возникшая из двух неспаренных электронов,
становится общей для двух атомов хлора. Существует несколько способов
образования ковалентных связей за счёт перекрывания электронных облаков.
Слайд 18
Выше были показаны орбитали, которые связывают между собой
два определенных атома. Такие связывающие орбитали называются локализованными орбиталями.
Однако в некоторых молекулах невозможно указать точное положение (локализацию) связывающих орбиталей-орбитали перестраиваются, возникают гибридные состояния.
Слайд 19
Ионная связь
Чисто ионной связью называется химически связанное состояние
атомов, при котором устойчивое электронное окружение достигается путём полного
перехода общей электронной плотности к атому более электроотрицательного элемента.
На практике полный переход электрона от одного атома к другому атому-паренеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую, но не нулевую, электроотрицательность, илюбая связь будет в некоторой степени ковалентной.
Ионная связь возможна только между атомами электроположительных и электроотрицательных элементов, находящихся в состоянии разноименно заряженных ионов.
Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединени электронов.При отдаче электронов образуется положительно заряженный ион-катион, при присоединении-отрицательный-анион.
Слайд 20
Одноатомные катионы и одноатомные анионы возникают при химической

реакции между нейтральнами атомами путем взаимопередачи электронов.
При этом
атом электроположительного элемента, обладающий небольшим числом внешних электронов, переходит в более устойчивое состояние одноатомного катиона путем уменьшения числа этих электронов. Наоборот, атом электроотрицательного элемента, имеющий большое число электроно на внешнем слое , переходит в более устойчивое для него состояние одноатомного иона путем увеличения числа электронов.
Одноатомные катионы образуются, как правило, металлами, а одноатомные анионы-неметаллами. При передаче электронов металлического и неметаллического элементов стремятся сформировать вокруг своих ядер устойчивую конфигурацию электронной оболочки. Атом неметаллического элемента создает внешнюю оболочку последующего благородного газа, тогда как атом металлического элемента после отдачи внешних электронов получает устойчивую конфигурацию предыдущего благородного газа.
Ионную связь часто рассматривают как предельный случай ковалентной связи.
Слайд 21
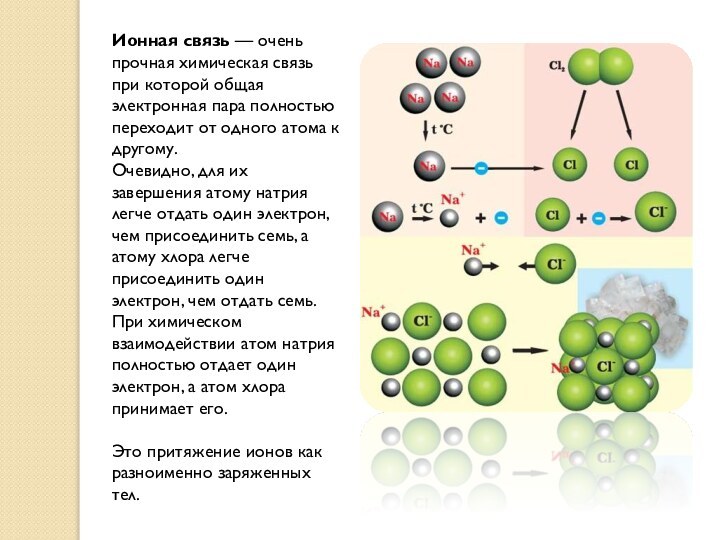
Ионная связь — очень прочная химическая связь при которой
общая электронная пара полностью переходит от одного атома к
другому.
Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его.
Это притяжение ионов как разноименно заряженных тел.
Слайд 22
Металлическая связь.
В металлах валентные электроны удерживаются атомами

крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних
электронов, приобретают положительный заряд. Они образуют металлическую кристаллическую решётку.
Совокупность обобществлённых валентных электронов (электронный газ), заряженных отрицательно, удерживает положительные ионы металла в определённых точках пространства - узлах кристаллической решётки, например, металла серебро.
Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью (особенно золото, серебро, медь, алюминий).
Во узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, происходящие из атомов металлов от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
Слайд 23
Свободное движение электронов в металле подтверждено в 1913
году опытом Мандельштама–Папалекси по резкому торможению быстро вращающейся катушки
с проводом — свободные электроны продолжали двигаться по инерции, в результате чего гальванометр регистрировал импульс электрического тока. Свободное движение электронов в металле обусловливает высокую теплопроводность металла и склонность металлов к термоэлектронной эмиссии, происходящей при умеренной температуре.
Представим себе проводник в виде автобуса, который резко тормозит. Всех пассажиров, державшихся за поручни или нет, при этом резко подаст вперед сила инерции, при этом стоящие наиболее близко к лобовому стеклу рискуют пробить его и быть выброшенными наружу. Точно так же ведут себя и электроны в кристалле металла при резком его торможении.