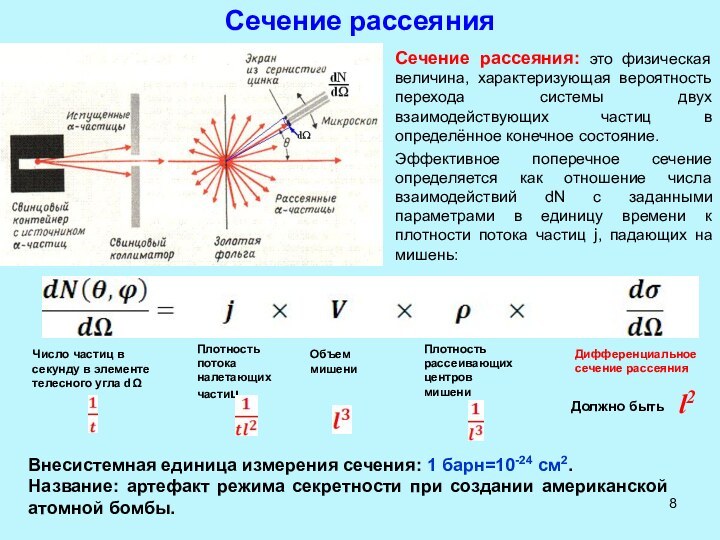
взаимодействии быстрых электронов с веществом (например, с атомами анода
в рентгеновской трубке). Максимальная энергия рентгеновского излучения ћωmax тормозного спектра определяется энергией электронов eV в трубке:ћωmax=eV
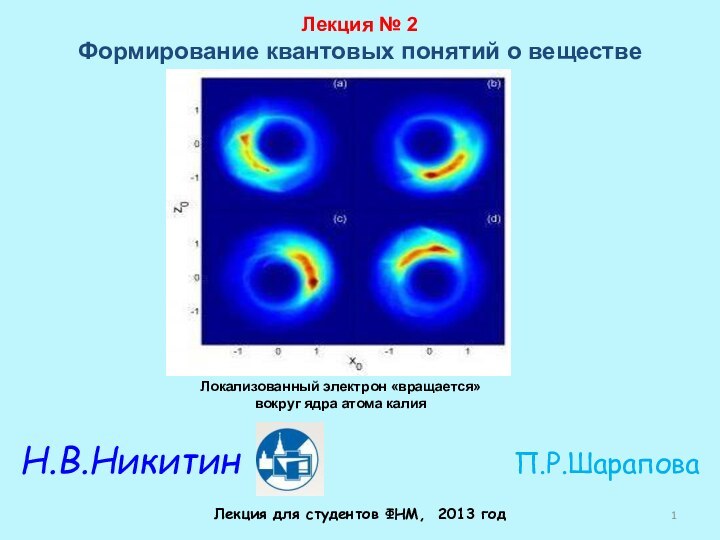
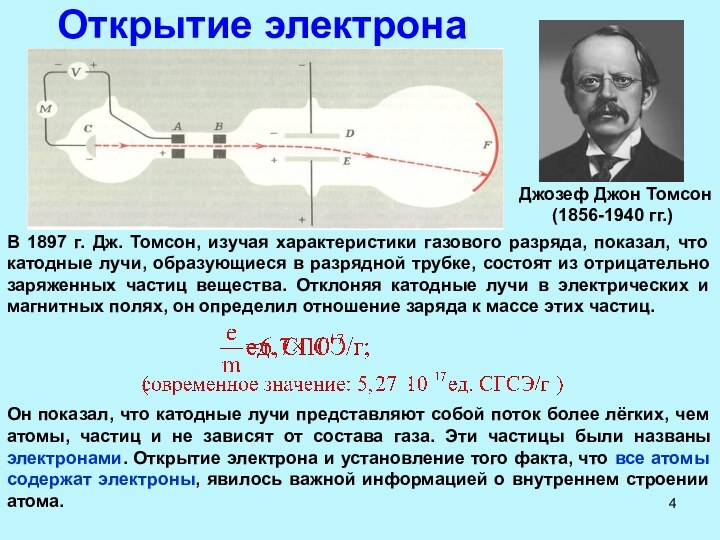
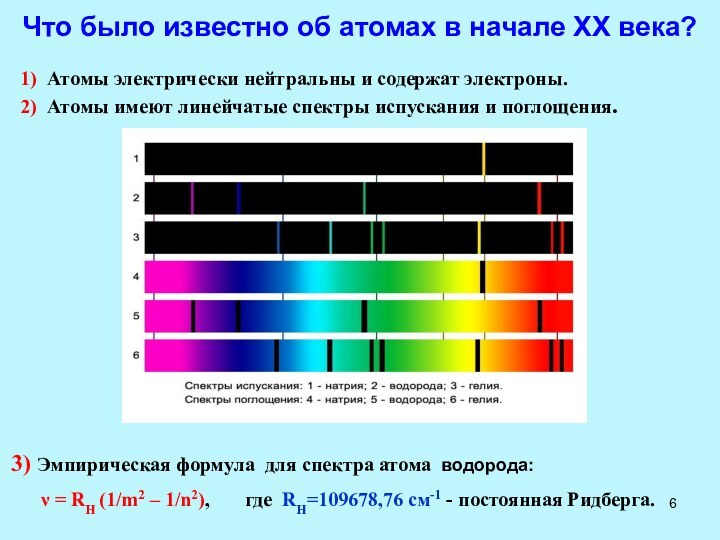
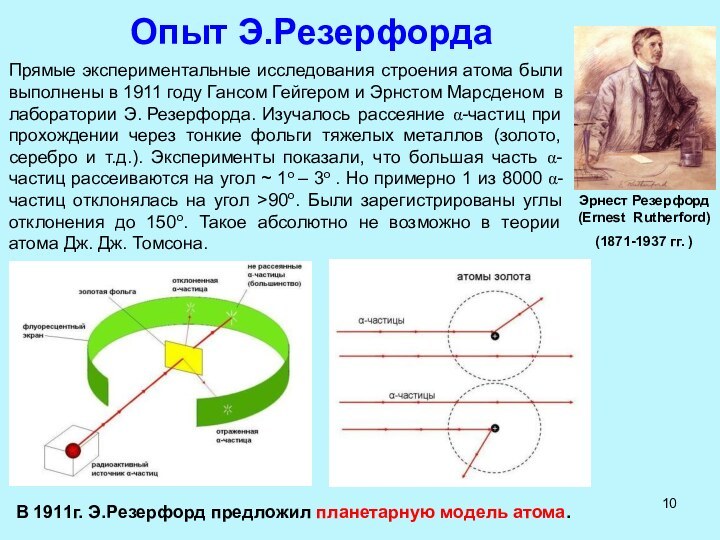
Рентгеновские лучи (1895 г)
Вильгельм Рентген (Wilhelm Roentgen) (1845-1923 гг.)
Характерные энергии (длины волн) рентгеновских лучей лежат в диапазоне от 20 эВ до 1 МэВ (5 10-6 см до 10-10 см).
Нобелевская премия по физике
1901 г. — В. Рентген
За открытие лучей, названных его именем.