- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Газы, газовые законы
Содержание
- 2. Цели урока: 1. Закрепление знаний об идеальном
- 3. Газовые законы Учебная презентация для 10 класса
- 4. Проверка PдавлениеVобъемTтемпература
- 5. Макроскопические параметрыПараметры, характеризующие состояние газа без учета его молекулярного строения, называются макроскопическими. ? Назовите эти параметры.
- 6. ИзопроцессыПроцессы, протекающие в термодинамической системе при одном
- 7. ДоказательствоИз уравнения Менделеева – Клапейрона для двух
- 8. Изотермический процессПроцесс, протекающий в термодинамической системе при
- 9. Изотерма в координатах P;T, V;TPTOTVO
- 10. График изотермического процессаИзотермаЗадание: построить изотерму в координатахV;T, P;TVPНажми для проверки
- 11. Изохорный процессПроцесс, протекающий в термодинамической системе при
- 12. Изохора в координатах P,V;V,TОTVOOO
- 13. График изохорного процессаPOTизохораЗадание: построить изохору в координатах P,V; V,TНажми для проверки
- 14. Изобарный процесс Процесс, протекающий в термодинамической системе
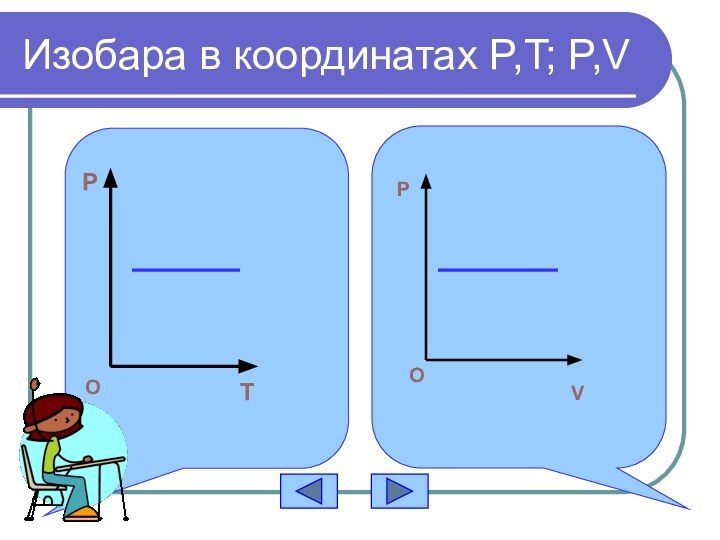
- 15. Изобара в координатах P,T; P,VPTOPOV
- 16. График изобарного процессаTVOизобараЗадание:Построить изобару в координатах Р,Т; Р,VНажми для проверки
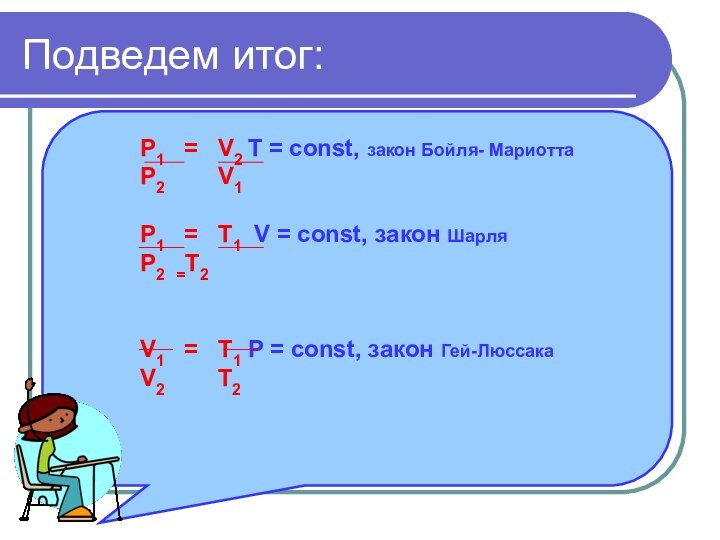
- 17. Подведем итог:P1 = V2 T =
- 18. Определите, какие процессы изображены на графике
- 19. Графическое представление газовых процессовБазовый уровень10 класс
- 20. Графики газовых процессов изображают в координатах p,V;
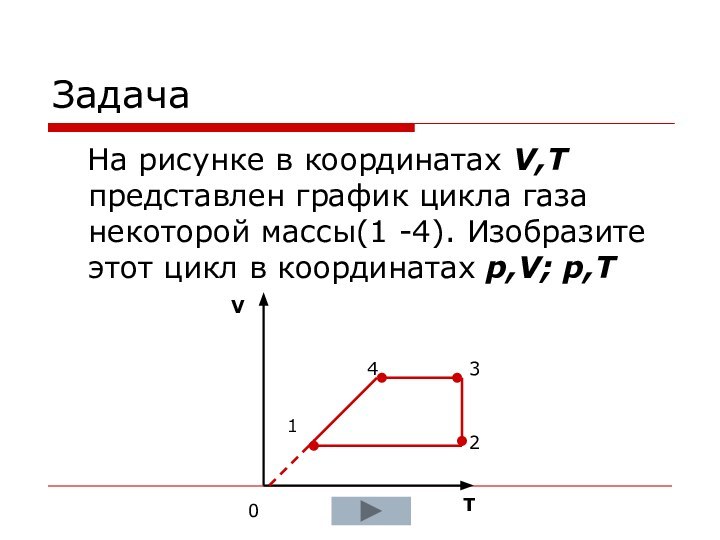
- 21. Задача На рисунке в координатах V,T представлен график
- 22. Решение:1шаг: анализ участков цикла. 2 шаг: построение графиков.VTVTРР00012341-2P=увелV=constT=увелЗ-н Шарля2-3P=умен.T=constV=увел.З-н Бойля-Мариотта3-4P=уменV=constT=умен.З-н Шарля4-1P=constV=уменT=уменЗ-н Гей-Люссака12341234
- 23. Участок 1-2Перевод газа из состояния 1 в
- 24. Участок 2-3Перевод газа из состояния 2 в
- 25. Участок 3-4Перевод газа из состояния 3 в
- 26. Участок 4-1Перевод газа из состояния 4 в
- 27. Ученики школы Привидений:Каспер – водород,Микки – воздух,Олес
- 28. Задача 1Каспер решил отдохнуть и залез в
- 29. СИ:m= 4·10 -3 кгV= 2 ·10 -2 м3T= 300 КM= 2·10 -3 кг/мольр - ?Решение:Ответ:
- 30. Задача 2Лулу, идеальную во всех отношениях, в
- 31. Дано:Т1= ТТ2= 2Тр1= рР2= 1,25рРешение:
- 32. Решение:
- 33. ЗадачиЗадача Ивлевой ЮлиЗадача о МаргоЗадача про трубку с ртутьюЗадача о ЯнекеЗадача
- 34. Проверь свои знания по теме «Уравнение состояния идеального газа» Тренировочный тест
- 35. 1.Назови макроскопические параметры:Масса, давление, объем, температурадавление, объем, температура
- 36. К макроскопическим параметрам идеального газа относятся: давление, объем и температура!P, V, T
- 37. 2.Из предложенных формул выбери уравнение состояния идеального
- 38. Неправильно! Повтори теорию!
- 39. Молодец! Переходи к следующему вопросу
- 40. Неправильно! Повтори теорию!
- 41. Уравнением состояния идеального газа называется зависимость между макроскопическими параметрами: давлением, объемом и температурой!pv = m/MRT
- 42. Молодец!Переходи к следующему вопросу
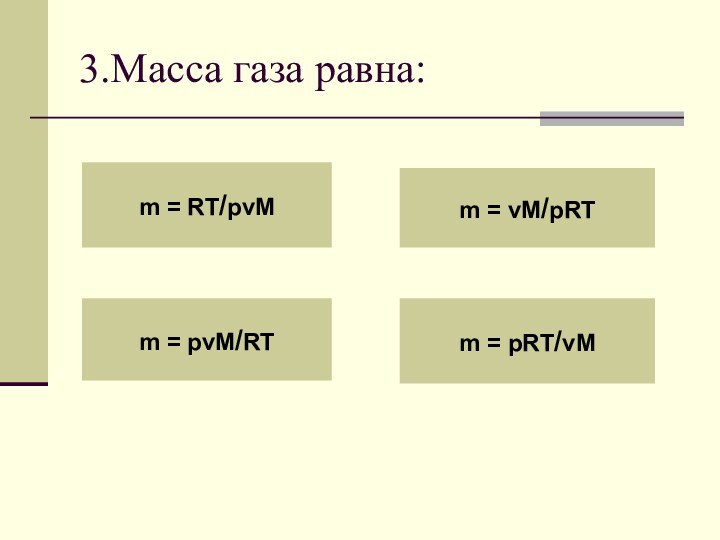
- 43. 3.Масса газа равна:m = RT/pvMm = pvM/RTm = vM/pRTm = pRT/vM
- 44. Молодец!Переходи к следующему вопросу
- 45. Неправильно! Повтори теорию!
- 46. Чтобы выразить неизвестную величину из уравнения Менделеева
- 47. 4.Универсальная газовая постоянная равна:6,022 *10 23 моль-11,38 * 10 – 23Дж/К 8,31 Дж/ (моль*К)
- 48. Неправильно!Повтори теорию!
- 49. Молодец!Переходи к следующему вопросу
- 50. Универсальной газовой постоянной называется произведение числа Авогадро
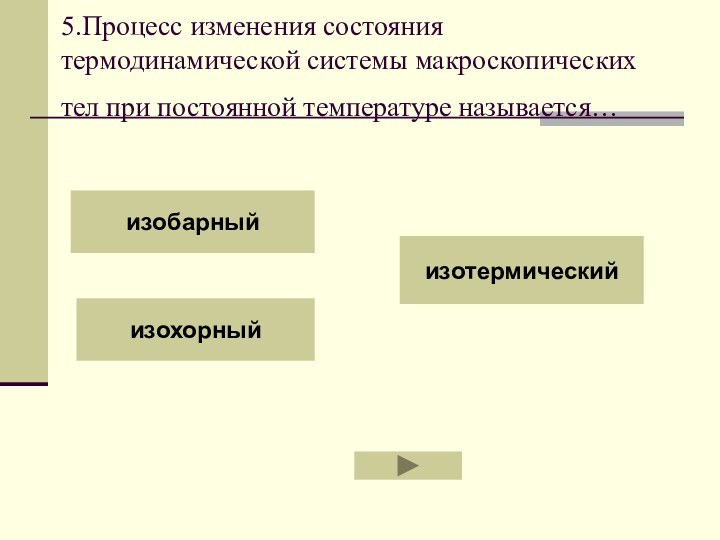
- 51. 5.Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называется… изобарныйизохорныйизотермический
- 52. Согласно уравнению состояния газа в любом состоянии
- 53. Молодец!Переходи к следующему вопросу
- 54. Неправильно!Повтори теорию!
- 55. 6.Газовый закон для изобарного процесса – это…PV = constv/T = constp/T = const
- 56. Неправильно!Повтори теорию!
- 57. Молодец!Переходи к следующему вопросу
- 58. Для данной массы газа отношение объема к
- 59. 7.Газовый закон Шарля устанавливает зависимость между:Давлением и объемомМежду давлением и температуройОбъемом и температурой
- 60. Повтори теорию!Неправильно!
- 61. Поздравляю!Переходи к следующему вопросу
- 62. Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.Газовый закон Шарля.V = const.p/T = const
- 63. 8.Графиком изотермического процесса в координатах PV является:PPVV
- 64. Поздравляю!Переходи к следующему вопросу
- 65. Неправильно!Повтори теорию!
- 66. Зависимость между давлением и объемом в изотермическом
- 67. 9.Графиком изобарного процесса в координатах PV является:PVPV
- 68. Поздравляю!Переходи к следующему вопросу
- 69. Неправильно!Повтори теорию!
- 70. Если процесс изобарный давление постоянно, в координатах PV график прямая линия параллельная оси объема.
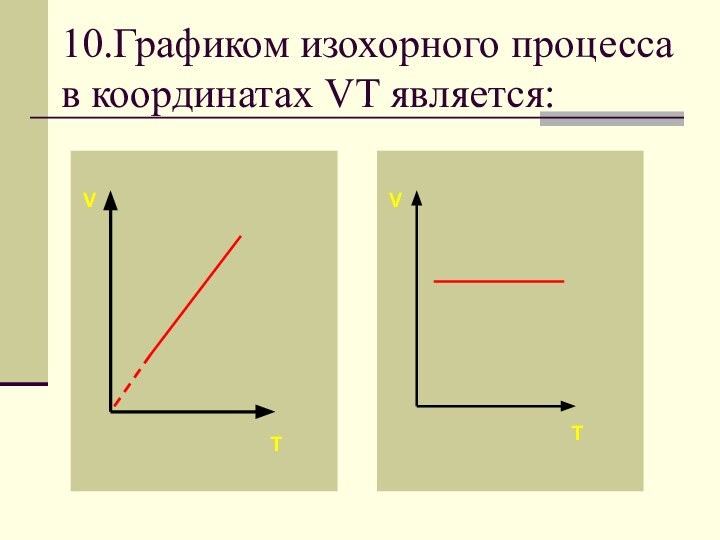
- 71. 10.Графиком изохорного процесса в координатах VT является:VVTT
- 72. Поздравляю!Переходи к следующему вопросу
- 73. Неправильно!Повтори теорию!
- 74. Если процесс изохорный объем постоянный, в координатах VT график - прямая линия параллельная оси температуры.
- 75. Реши задачу:Найди давление газа бутана (С4Н8) в
- 76. Поздравляю!Переходи к следующей задаче
- 77. Неправильно!Посмотри решение
- 78. Решение:Переведи единицы измерения объема, массы, температуры в
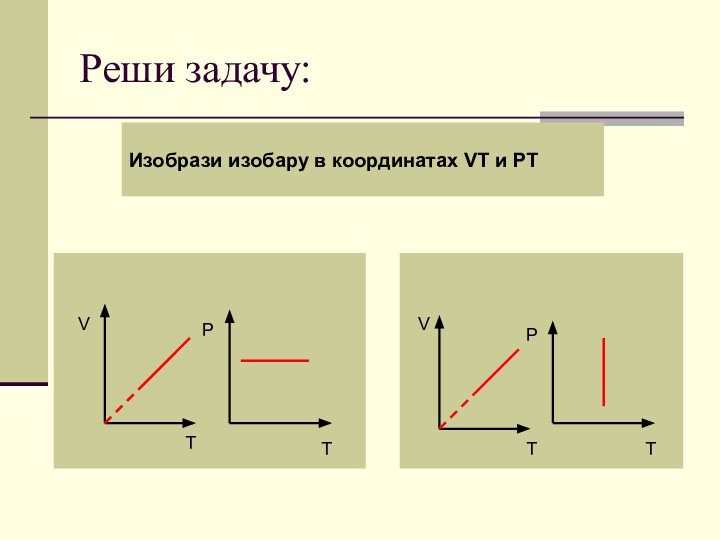
- 79. Реши задачу:Изобрази изобару в координатах VT и PT VTPTVTPT
- 80. Поздравляю!Переходи к контрольному тесту
- 81. Скачать презентацию
- 82. Похожие презентации
Цели урока: 1. Закрепление знаний об идеальном газе, изопроцессах. 2. Формирование умений решения задач на применение уравнения состояния идеального газа и построение графиков изопроцессов. 3. Прививать интерес к решению задач по физике.




































































Слайд 5
Макроскопические параметры
Параметры, характеризующие состояние газа без учета его
молекулярного строения, называются макроскопическими.
? Назовите эти параметры.
Слайд 6
Изопроцессы
Процессы, протекающие в термодинамической системе при одном неизменном
макроскопическом параметре когда два других изменяются, называются изопроцессами.
Вопрос: какие
параметры называются макроскопическими?Нажми
для проверки
Слайд 7
Доказательство
Из уравнения Менделеева – Клапейрона для двух состояний
одной массы газа следует:
P1V1 = m RT
MP2V2 = m RT
M
Равенство левых и правых частей уравнения
Слайд 8
Изотермический процесс
Процесс, протекающий в термодинамической системе при постоянной
температуре, называется изотермическим.
T = const
Зависимость объема от давления при
постоянной температуре называется законом Бойля-Мариотта.PV = const
P1 = V2
P2 V1
Слайд 10
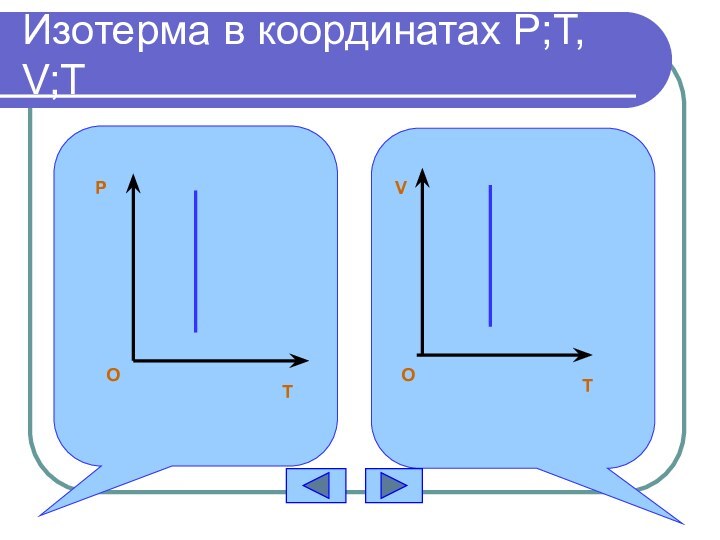
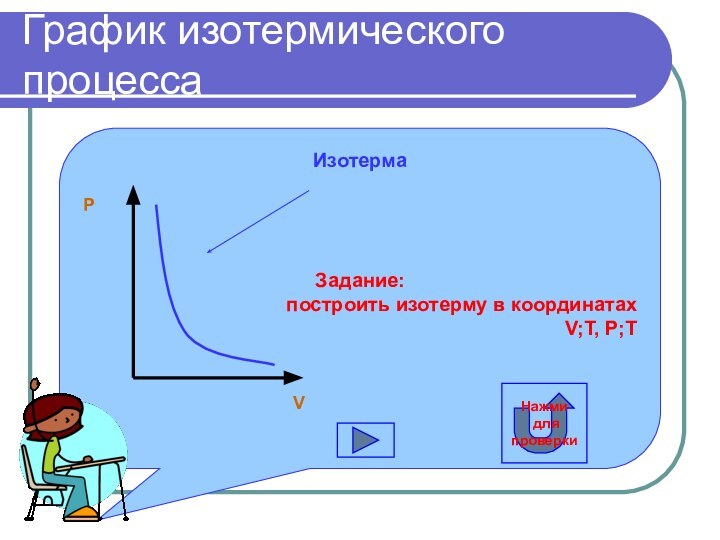
График изотермического процесса
Изотерма
Задание:
построить изотерму в координатах
V;T, P;T
V
P
Нажми
для проверки
Слайд 11
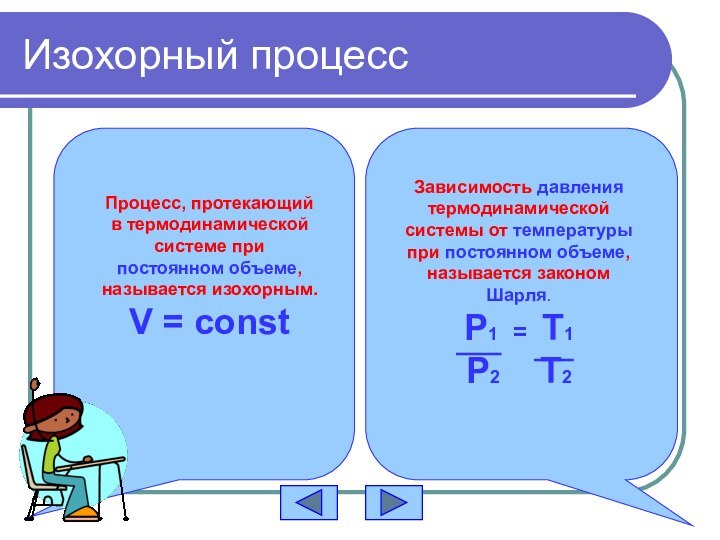
Изохорный процесс
Процесс, протекающий в термодинамической системе при постоянном
объеме, называется изохорным.
V = const
Зависимость давления термодинамической системы от
температуры при постоянном объеме, называется законом Шарля.P1 = T1
P2 T2
Слайд 13
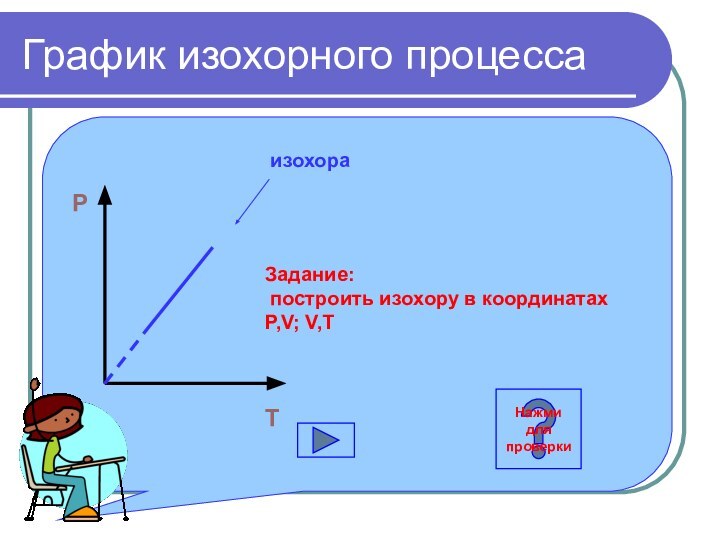
График изохорного процесса
P
O
T
изохора
Задание:
построить изохору в координатах P,V;
V,T
Нажми
для проверки
Слайд 14
Изобарный процесс
Процесс, протекающий в термодинамической системе при постоянном
давлении, называется изобарным.
Р = const
Зависимость объема термодинамической системы от
температуры при постоянном давлении, называется законом Гей-ЛюссакаV1 = T1
V2 T2
Слайд 16
График изобарного процесса
T
V
O
изобара
Задание:
Построить изобару в координатах Р,Т; Р,V
Нажми
для
проверки
Слайд 17
Подведем итог:
P1 = V2 T = const,
закон Бойля- Мариотта
P2 V1
P1
= T1 V = const, закон ШарляP2 =T2
V1 = T1 Р = const, закон Гей-Люссака
V2 T2
Слайд 20 Графики газовых процессов изображают в координатах p,V; p,T;
V,T.
Перед построением графика следует получить аналитическое выражение функции процесса
из уравнения Менделеева-Клапейрона или уравнений газовых законов.Введение
Слайд 21
Задача
На рисунке в координатах V,T представлен график цикла
газа некоторой массы(1 -4). Изобразите этот цикл в координатах
p,V; p,TV
T
1
4
3
2
0
Слайд 22
Решение:1шаг: анализ участков цикла.
2 шаг: построение графиков.
V
T
V
T
Р
Р
0
0
0
1
2
3
4
1-2
P=увел
V=const
T=увел
З-н Шарля
2-3
P=умен.
T=const
V=увел.
З-н
Бойля-Мариотта
3-4
P=умен
V=const
T=умен.
З-н Шарля
4-1
P=const
V=умен
T=умен
З-н Гей-Люссака
1
2
3
4
1
2
3
4
Слайд 23
Участок 1-2
Перевод газа из состояния 1 в состояние
2 совершается при увеличении температуры и давления при постоянном
объеме, этот участок отображает изохорное нагревание газа.Построим это участок в координатах p,V; p,T.
Слайд 24
Участок 2-3
Перевод газа из состояния 2 в состояние
3 совершается при постоянной температуре и если давление уменьшается,
то объем растет, этот участок отображает изотермическое расширение газа.Построим это участок в координатах p,V; p,T.
Слайд 25
Участок 3-4
Перевод газа из состояния 3 в состояние
4 совершается при уменьшении температуры и давления при постоянном
объеме, этот участок отображает изохорное охлаждение газа.Построим это участок в координатах p,V; p,T.
Слайд 26
Участок 4-1
Перевод газа из состояния 4 в состояние
1 совершается при уменьшении температуры и объема при постоянном
давлении, этот участок отображает изобарное сжатие газа.Построим это участок в координатах p,V; p,T.
Слайд 27
Ученики школы Привидений:
Каспер – водород,
Микки – воздух,
Олес –
углекислый газ,
Лулу – идеальный газ,
Лоло – гелий,
Лили – аргон,
Марго
и Янек – просто газы,Ольгерд – азот,
Рышард – инертный газ.
Слайд 28
Задача 1
Каспер решил отдохнуть и залез в банку
объемом 20 л. Найдите давление Каспера,
если его масса
4 ги температура 270С.
Слайд 30
Задача 2
Лулу, идеальную во всех отношениях, в темном
коридоре подкараулили завидующие её фигуре Лоло и Лили. После
того как Лулу как следует разозлили, её абсолютная температура увеличилась в 2 раза, а давление подскочило на 25 %. Нанесло ли все это урон фигуре Лулу и во сколько раз изменился её объем?
Слайд 35
1.Назови макроскопические параметры:
Масса, давление, объем, температура
давление, объем, температура
Слайд 36 К макроскопическим параметрам идеального газа относятся: давление, объем
и температура!
P, V, T
Слайд 37
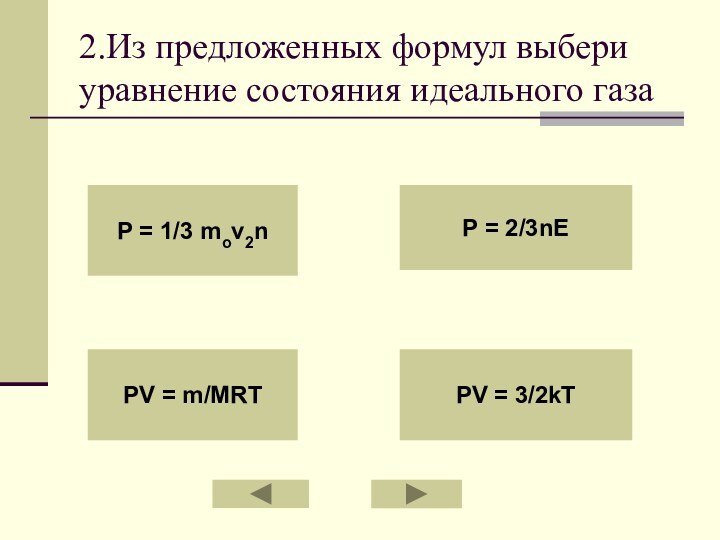
2.Из предложенных формул выбери уравнение состояния идеального газа
P
= 1/3 mov2n
PV = m/MRT
P = 2/3nE
PV = 3/2kT
Слайд 41 Уравнением состояния идеального газа называется зависимость между макроскопическими
параметрами: давлением, объемом и температурой!
pv = m/MRT
Слайд 46 Чтобы выразить неизвестную величину из уравнения Менделеева –
Клапейрона, умножь левую и правую часть уравнения на знаменатель
(М), получишь: рvM = mRT, найди неизвестный множитель, разделив произведение на известные множители.pv = m/MRT
Слайд 47
4.Универсальная газовая постоянная равна:
6,022 *10 23 моль-1
1,38 *
10 – 23Дж/К
8,31 Дж/ (моль*К)
Слайд 50 Универсальной газовой постоянной называется произведение числа Авогадро и
постоянной Больцмана: 6,02 * 1023 * 1,38 * 10
-23k NA = R
Слайд 51 5.Процесс изменения состояния термодинамической системы макроскопических тел при
постоянной температуре называется…
изобарный
изохорный
изотермический
Слайд 52 Согласно уравнению состояния газа в любом состоянии с
неизменной температурой произведение давления газа на его объем остается
постоянным. Процесс изотермический.T = const
Закон Бойля-Мариотта
pv = const
Слайд 58 Для данной массы газа отношение объема к температуре
постоянно, если давление газа не меняется.
v/T = const
Закон Гей-Люссака.
P
= const
Слайд 59
7.Газовый закон Шарля устанавливает зависимость между:
Давлением и
объемом
Между
давлением и
температурой
Объемом и
температурой
Слайд 62 Процесс изменения состояния термодинамической системы при постоянном объеме
называют изохорным.
Газовый закон Шарля.
V = const.
p/T = const
Слайд 66 Зависимость между давлением и объемом в изотермическом процессе
обратно пропорциональная. Графиком в координатах PV является изотерма –
гипербола.Слайд 70 Если процесс изобарный давление постоянно, в координатах PV
график прямая линия параллельная оси объема.
Слайд 74 Если процесс изохорный объем постоянный, в координатах VT
график - прямая линия параллельная оси температуры.
Слайд 75
Реши задачу:
Найди давление газа бутана (С4Н8) в баллоне
для портативных
газовых плит объемом 0,5 л и массой 250г
при температуре 20 0С
21,7 МПа
12кПа
Слайд 78
Решение:
Переведи единицы измерения объема, массы, температуры в СИ.
Найди
молярную массу бутана:
M=(4*12 + 1*8) * 10-3 = 56
10-3кг/моль
Из уравнения М-К вырази давление: p = mRT / VM, выполни вычисления.





























