- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Ионизирующие излучения и радиационная защита
Содержание
- 2. Ионизирующие излучения - излучения,
- 3. А – электрон (e-1) Б
- 4. Атомное ядро представляет собой совокупность ядерных частиц
- 5. Протон (1р+) – стабильная
- 6. Международная система единиц (СИ) была
- 7. Единицы СИ
- 8. Десятичные кратные и дольные единицы:
- 9. ____________** Масса частицы, ядра, атома измеряется в
- 10. Число протонов в ядре: - строго постоянно
- 11. Нейтрон (1n0) – электрически нейтральная ядерная частица
- 12. _____________ * Электрон-вольт (эВ) – единица энергии, используемая
- 13. Масса ядра атома химического элемента (М) равна
- 14. Электрон (e-1) – отрицательно заряженная частица с
- 15. Атомы, имеющие определенный состав и структуру ядра,
- 16. Изотопы (isos – одинаковый, topos - место)
- 17. - Изотопы одного и того же элемента
- 18. Если число протонов в ядре совпадает с
- 19. Скачать презентацию
- 20. Похожие презентации
Ионизирующие излучения - излучения, которые создаются при радиоактивном распаде, ядерных превращениях, торможении заряженных частиц в веществе и образуют при взаимодействии со средой ионы разных знаков.


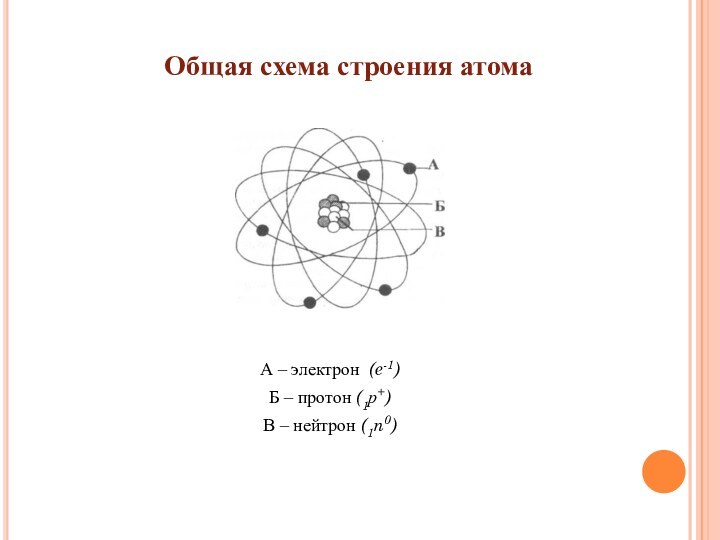
















Слайд 4 Атомное ядро представляет собой совокупность ядерных частиц –
нуклонов, к которым относятся положительно заряженные протоны и электрически
нейтральные нейтроны.Самое простое строение имеет ядро водорода, которое состоит только из одного протона.
Слайд 5
Протон (1р+) – стабильная
положительно заряженная элементарная ядерная частица с зарядом +1 (=
1,6·10-19 Кл*) и массой 1 а.е.м.**._________
* Кл – Кулон – единица измерения элементарного заряда (количества электричества) заряженных частиц. 1 Кл равен количеству электричества, проходящему через поперечное сечение при токе силой 1А за время 1 с.
Слайд 6 Международная система единиц (СИ) была принята
XI Генеральной конференцией по мерам и весам (Париж, 1960).
Ей было присвоено краткое наименование SI (system international), в русской транскрипции СИ, т.е. Система Интернациональная. В нашей стране она была введена как обязательная к применению в 1981 году (ГОСТ 8.417-81).
Другие, существовавшие ранее системы измерения (СГС, МКС, МКГСС и т.д.) должны быть изъяты из применения.
Слайд 7
Единицы СИ
Основные:
Производныедлины – метр,
массы – килограмм,
времени – секунда,
силы тока – ампер,
термодинамической температуры – градус Кельвина,
силы света – кандела,
количество вещества – моль.
Слайд 8
Десятичные кратные и дольные единицы:
1012
– тера ( T / T);
10-1 – деци ( d / д);109 – гига ( G / Г); 10-2 – санти ( с / с);
106 – мега ( М / М); 10-3 – милли ( m / м);
103 – тера ( k / к); 10-6 – микро ( µ / мк);
102 – гекто ( h / г); 10-9 – нано ( n / н);
10 – дека ( da / да); 10-12 – пико ( р / п);
Слайд 9
____________
** Масса частицы, ядра, атома измеряется в системе
СИ в килограммах (кг).
Однако в ядерной физике для
ее измерения допускается применение, наравне с единицей СИ, относительной величины получившей название – атомная единица массы (а. е. м.). 1 а. е .м. = 1 условной единице (у.е.) = 1/12 массы атома углерода = 1,66 · 10-24 г.
Слайд 10
Число протонов в ядре:
- строго постоянно для
атомов одного элемента,
- соответствует номеру химического элемента
в Периодической системе Д.И. Менделеева,- определяет заряд ядра (Z),
- количество электронов вращающихся
вокруг ядра,
- химические свойства элемента.
Находясь вне ядра, протоны сохраняют стабильность и не испытывают превращений.
Слайд 11 Нейтрон (1n0) – электрически нейтральная ядерная частица с
массой, близкой массе протона (1 а.е.м.).
- в ядрах
стабильны,- в свободном состоянии неустойчивы и распадаются на протон и электрон, испуская и антинейтрино, а также некоторое количество энергии (0,78 МэВ*).
Слайд 12
_____________
* Электрон-вольт (эВ) – единица энергии, используемая в
ядерной физике (хотя данная единица является внесистемной, ее применение
допускается к применению наравне с единицами СИ). Равна энергии, которую получает электрон, проходя через поле с разностью потенциалов в 1 В. 1 эВ = 1,6 · 10-19 Дж.В практике широко используют кратные единицы: МэВ – мегаэлектрон-вольт, кэВ – килоэлектрон-Вольт и др.
Слайд 13
Масса ядра атома химического элемента (М) равна сумме
масс протонов и нейтронов входящих в его состав:
М
= 1р+ + 1n0Слайд 14 Электрон (e-1) – отрицательно заряженная частица с зарядом
-1 и массой ≈ 0.
- Электроны вращаются вокруг
ядра по орбитам.- Группируются в несколько электронных слоев (К, L, М и т.д.) , образуя электронную оболочку ядра (электронное облако).
- Количество электронных слоев определяет положение химического элемента в одном из семи периодов периодической системы и соответствует его номеру.
- Электроны в каждом слое имеют свой уровень энергии, однако в определенных условиях возможен перескок отдельных электронов с орбиты на орбиту с поглощением или выделением энергии.
Слайд 15 Атомы, имеющие определенный состав и структуру ядра, называются
нуклидами.
- Индивидуальные свойства нуклида определяются электрическим зарядом ядра
(числом протонов).Поэтому химические элементы обозначаются следующим образом:
ZXA,
где Х – химический элемент,
Z – заряд ядра (число протонов),
А – масса атома.
Слайд 16 Изотопы (isos – одинаковый, topos - место) –
разновидности химического элемента с одинаковым числом протонов, но различным
числом нейтронов в атомных ядрах и, следовательно, атомной массой, сохраняя при этом практически одинаковые химические свойства.- В Периодической системе Д.И. Менделеева изотопы одного химического элемента занимают одно место (клеточку).
Слайд 17
- Изотопы одного и того же элемента имеют
разные массовые числа.
Например, природный хлор состоит из двух
видов атомов, в ядрах которых содержится по 18 или 20 нейтронов, при постоянном количестве протонов – по 17 (17Cl35 и 17Cl37). !! Масса большинства химических элементов выражаются не целыми числами. Например, масса хлора равна 35,5. Это объясняется тем, что соотношение природных изотопов хлора 17Cl35 и 17Cl37 составляет 75,4 % и 24,6 % соответственно.





























