- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Масс-спектрометрия и хромато-масс-спектрометрия высокого разрешения
Содержание
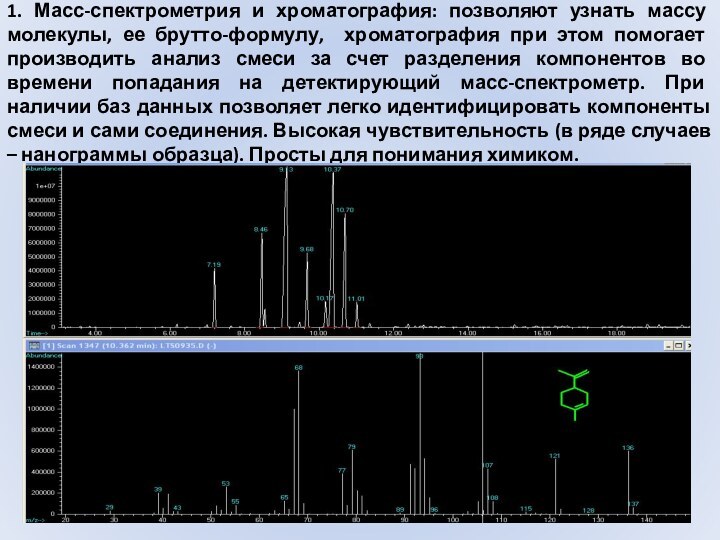
- 2. 1. Масс-спектрометрия и хроматография: позволяют узнать массу
- 3. Краткая характеристика информации, получаемой в методах масс-спектрометрии
- 4. Краткая характеристика информации, получаемой в методах масс-спектрометрии
- 5. Что требуется от слушателей курса в этой
- 6. Рекомендуемая литература 1. Пентин Ю.А., Л.В. Вилков. Физические
- 7. СВЕДЕНИЯ О МАСС-СПЕКТРОМЕТРИИ
- 8. Проблемы создания масс-спектрометра1. Перевести вещество в газовую
- 9. Создание вакуума:1. Используется тандем из создающих форвакуум
- 10. Создание вакуума:Рис. Турбомолекулярные насосыРис. Диффузионный насос
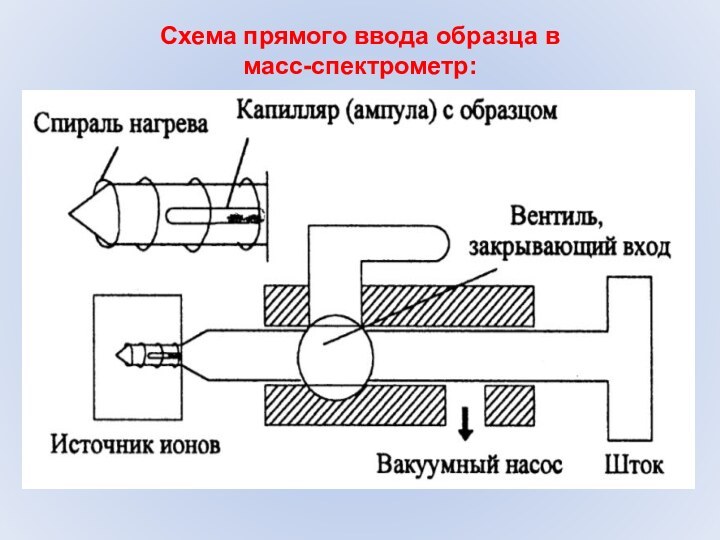
- 11. Схема прямого ввода образца в масс-спектрометр:
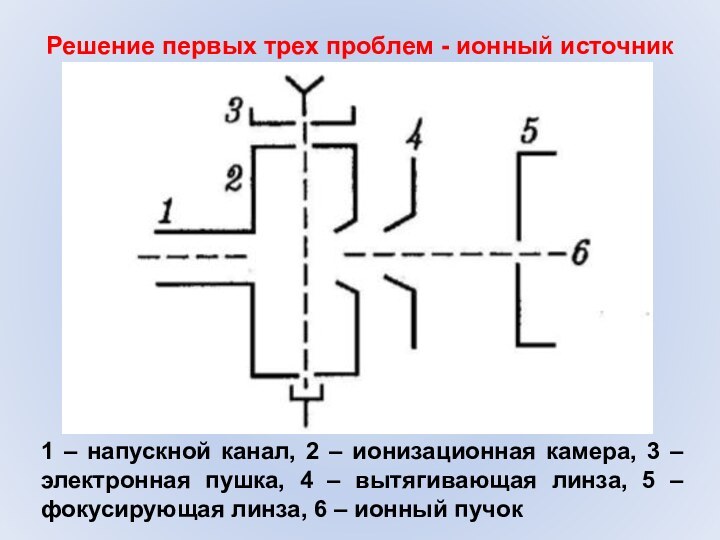
- 12. Решение первых трех проблем - ионный источник1
- 13. Решение 4-ой проблемы – сила Лоренца!Кинетическая энергия иона после выхода из ионизационной камеры:Сила Лоренца:Центростремительная сила:Приравнивая:Итог:
- 14. Принципиальная схема разделения пучка ионов в магнитном
- 15. Принципиальная схема магнитного масс-спектрометраСхема магнитного масс-спектрометра с
- 16. Принципиальная схема магнитного масс-спектрометра1 – молекулярный натекатель;
- 17. Ионизация электронным ударомЭлектронный удар, или, правильнее –
- 18. Ионизация электронным ударом – зависимость интенсивности пика
- 19. Ионизация электронным ударомПРЕИМУЩЕСТВА ЭЛЕКТРОННОЙ ИОНИЗАЦИИ1. Наиболее распространенный
- 20. Ионизация электронным ударомВАЖНО!!!Энергия в 70 эВ для
- 21. Другие распространенные методы ионизации1. Химическая ионизация (CI)2.
- 22. 1. Химическая ионизация (CI, Chemical Ionization)Химическая ионизация
- 23. 2. Фотоионизация (Photoionization)Ионизация фотонами, точнее, монохроматическими пучками
- 24. 3. Электроспрей (ESI, Electro Spray Ionization)Электроспрей (электрораспыление)
- 25. 3. Электроспрей (ESI, Electro Spray Ionization)Далее через
- 26. 3. Электроспрей (ESI, Electro Spray Ionization)Рис. Приставка для электроспрей-ионизации, подключенная к времяпролетному масс-спектрометру Bruker micrOTOFQ
- 27. 3. Электроспрей (ESI, Electro Spray Ionization)Достоинства:1. Возможность
- 28. 4. Лазерная десорбция (MALDI, Matrix-Assisted Laser Desorption/Ionization)Матричная
- 29. 4. Лазерная десорбция (MALDI, Matrix-Assisted Laser Desorption/Ionization) Далее
- 30. 4. Лазерная десорбция (MALDI, Matrix-Assisted Laser Desorption/Ionization)Достоинства:1.
- 31. 5. Полевая десорбция/ионизация (FI, Field Ionization) Ионизация путем
- 32. 6. Химическая ионизация при атмосферном давлении (APCI,
- 33. 6. Химическая ионизация при атмосферном давлении (APCI,
- 34. 6. Химическая ионизация при атмосферном давлении (APCI,
- 35. Методы разделения (типы масс-спектрометрических анализаторов)1. Магнитный анализатор2. Электрический анализатор3. Квадрупольный анализатор4. Времяпролетный анализатор5. Ионная ловушка
- 36. 1. Магнитный анализаторРис. Схема масс-спектрометра с магнитным
- 37. 2. Электрический (электростатический) анализатор Электростатический анализатор по принципу
- 38. 2. Электрический (электростатический) анализатор Как правило, этот вид
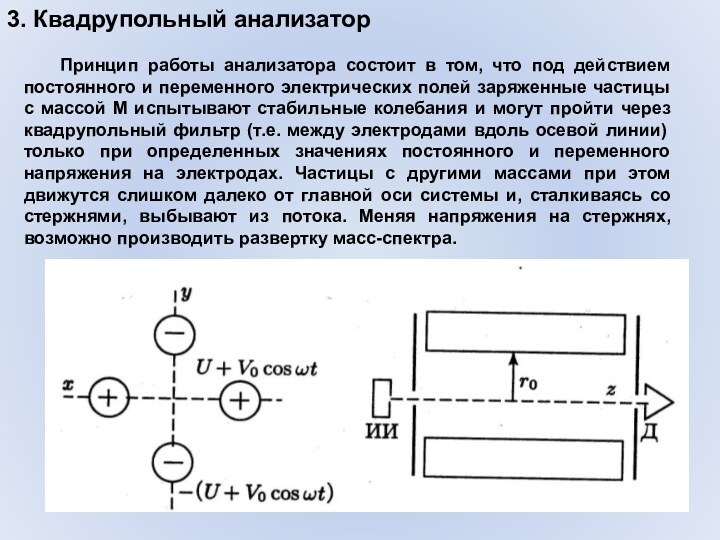
- 39. 3. Квадрупольный анализатор Квадрупольный анализатор представляет собой систему
- 40. 3. Квадрупольный анализатор Принцип работы анализатора состоит в
- 41. 4. Времяпролетный анализатор (TOF, Time Of Flight)Рис.
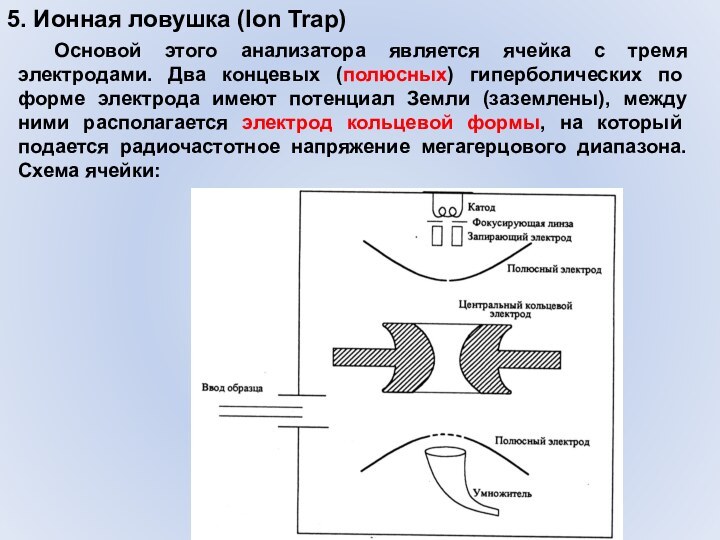
- 42. 5. Ионная ловушка (Ion Trap) Основой этого анализатора
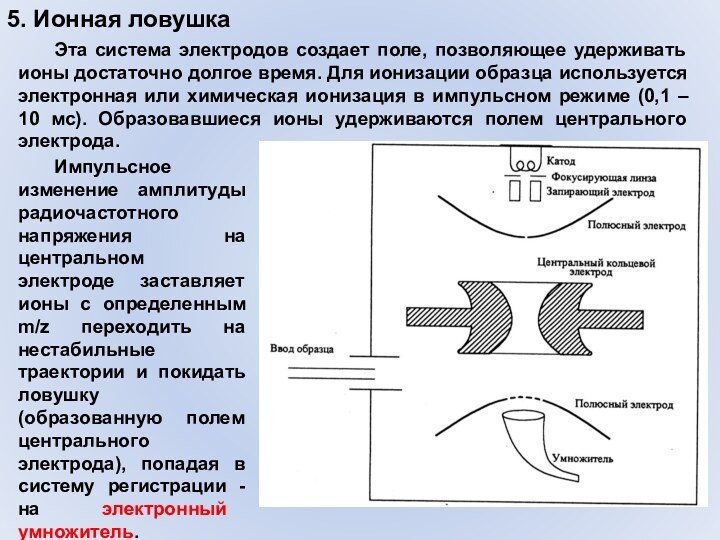
- 43. 5. Ионная ловушка Эта система электродов создает поле,
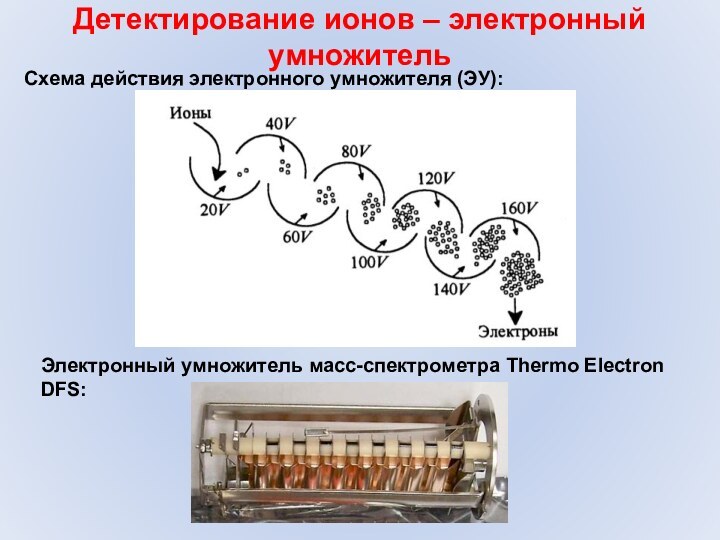
- 44. Детектирование ионов – электронный умножительСхема действия электронного умножителя (ЭУ):Электронный умножитель масс-спектрометра Thermo ElectronDFS:
- 45. Важный параметр масс-спектрометрических приборов – РАЗРЕШЕНИЕ (разрешающая способность)
- 46. Разрешение масс-спектрометра (R) – это возможность
- 47. Разрешение масс-спектрометраУвеличивая разрешающую способность, мы расплачиваемся за
- 48. МАСС-СПЕКТРОМЕТРИЯ ВЫСОКОГО РАЗРЕШЕНИЯ
- 49. Масс-спектрометрия высокого разрешения (МСРВ, HRMS – High
- 50. Таким образом, при разрешении 5000 возможно разделить
- 51. Рис. Измерение точной массы образца (пик 222)
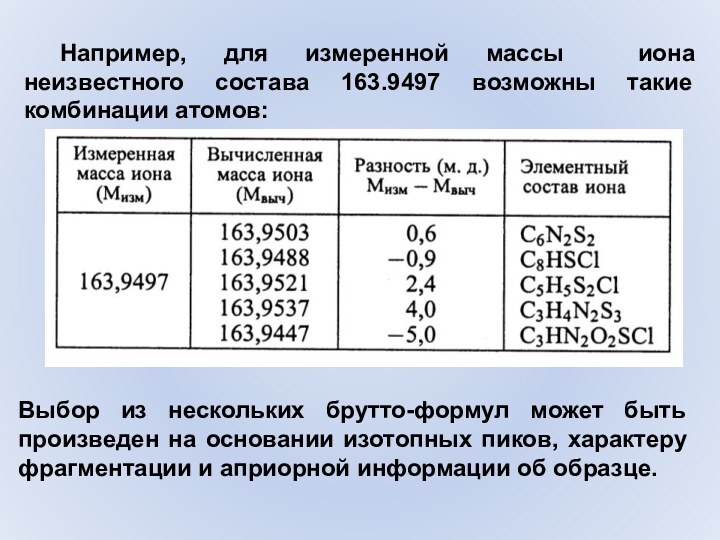
- 52. Например, для измеренной массы иона неизвестного состава
- 53. Рис. Масс-спектрометр высокого разрешения Thermo Electron DFS
- 54. Скачать презентацию
- 55. Похожие презентации






























Слайд 3 Краткая характеристика информации, получаемой в методах масс-спектрометрии и
хромато-масс-спектрометрии
1. Прямое измерение массового числа молекулы вещества, т.е. ее
молекулярной массы, в случае, если вещество в условиях масс-спектрометрического эксперимента дает молекулярный ион – заряженную частицу, имеющую ту же массу, до величин массы около 20000 а.е.м.2. При использовании масс-спектрометрии высокого разрешения возможно получение очень точного значения молекулярной массы, что позволяет по известным табличным данным получить брутто-формулу вещества, до величины массы несколько больше 1000 а.е.м.
3. Получение масс-спектра вещества, что позволяет провести его идентификацию по библиотекам масс-спектральных данных (например, по многочисленным базам библиотек масс-спектров соединений) или по характеру фрагментации предположить строение соединения.
Слайд 4 Краткая характеристика информации, получаемой в методах масс-спектрометрии и
хромато-масс-спектрометрии
4. Разделение аналитического сигнала образцов во времени - в
хромато-масс-спектрометрии возникает дополнительный аналитический сигнал – время удержания образца, т.е. как долго вещество проходит через хроматографическую колонку. Как правило, это время при одних и тех же условиях эксперимента является уникальной характеристикой вещества, позволяющей разделить даже смеси изомеров, при использовании специальных хроматографических хиральных колонок – даже оптические изомеры, и получить масс-спектры каждого соединения в смеси.Площадь хроматографического пика пропорциональна содержанию вещества в анализируемом образце, что позволяет, при соблюдении ряда условий, проводить точный количественный анализ образцов.
Получать данные о ряде термодинамических процессов (испарение, сублимация), исследовать кинетические закономерности, механизмы протекания процессов термораспада.
Слайд 5
Что требуется от слушателей курса в этой части:
1.
Представлять устройство и принцип работы масс-спектрометра и хромато-масс-спектрометра.
2. Знать,
какие задачи можно ставить перед указанными методами.3. Знать основные процессы фрагментации молекул тех или иных классов органических соединений под действием электронного удара.
3. Уметь использовать информацию: хромато-масс-спектрограмму, масс-спектры индивидуальных соединений.
4. Уметь использовать базы данных масс-спектров для обработки результатов хромато-масс-спектрометрии, в том числе при работе с результатами анализа своих собственных образцов, полученных при лабораторных работах по другим курсам.
Слайд 6
Рекомендуемая литература
1. Пентин Ю.А.,
Л.В. Вилков. Физические
методы
исследования в химии.
М.: Мир, ООО «Издательство
АСТ», 2003.
– 683 с.2. Лебедев А.Т.
Масс-спектрометрия в
органической химии.
М.: БИНОМ. Лаборатория
знаний, 2003. 493 с.
3. Заикин В.Г.,
Варламов А.В., Микая А.И., Простаков Н.С. Основы масс-спектрометрии органических соединений. М.: МАИК «Наука/Интерпериодика», 2001. – 286 с.
4. Хмельницкий Р.А., Бродский Е.С. Хромато-масс-спектрометрия (Методы Аналитической химии). М.: Химия, 1984. – 216 с.
Слайд 8
Проблемы создания масс-спектрометра
1. Перевести вещество в газовую фазу.
надо,
чтобы нашему веществу ничто не мешало, т.е. требуется вакуум.
Вакуум облегчает переход соединения в газовую фазу. Вакуум понадобится и вдоль траектории вещества внутри прибора. В ряде случаев вещество необходимо нагреть.2. Ионизировать вещество.
надо отнять у вещества электрон. Или добавить.
3. Создать ионный пучок.
надо придать скорость и направление движения образовавшимся ионам. При помощи электрического поля высокой напряженности.
4. Разделить ионный пучок по массам в магнитном поле.
надо иметь магнит.
5. Детектировать массы.
надо иметь фотопластинку или электрометр с электронным умножителем.
Слайд 9
Создание вакуума:
1. Используется тандем из создающих форвакуум (неглубокий
вакуум, примерно 1⋅10-2 мбар = 1 Па) механических электронасосов
и устройств, создающих глубокий вакуум (1⋅10-7 мбар = 1⋅10-5 Па – для сравнения – космический вакуум в 1000 км от Земли – 10-8 Па) – диффузионных насосов, турбомолекулярных насосов, азотных ловушек, специальных веществ – сорбентов (геттеров).Рис. Форвакуумные насосы
Слайд 12
Решение первых трех проблем - ионный источник
1 –
напускной канал, 2 – ионизационная камера, 3 – электронная
пушка, 4 – вытягивающая линза, 5 – фокусирующая линза, 6 – ионный пучок
Слайд 13
Решение 4-ой проблемы – сила Лоренца!
Кинетическая энергия иона
после выхода из ионизационной камеры:
Сила Лоренца:
Центростремительная сила:
Приравнивая:
Итог:
Слайд 14
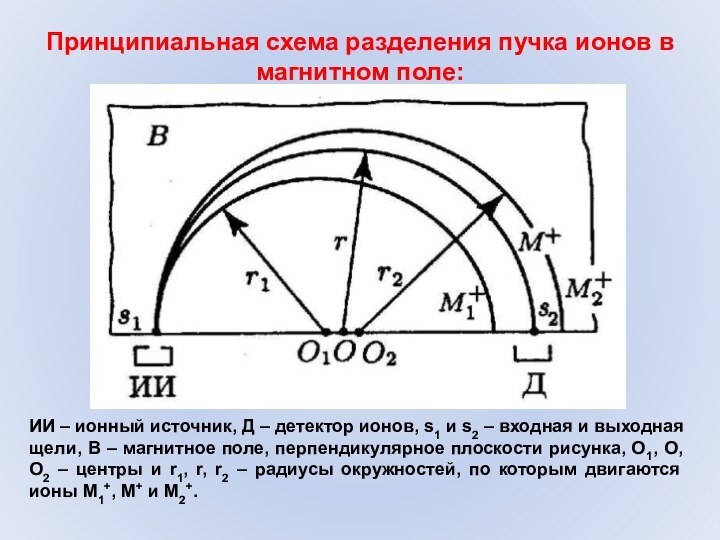
Принципиальная схема разделения пучка ионов в магнитном поле:
ИИ
– ионный источник, Д – детектор ионов, s1 и
s2 – входная и выходная щели, В – магнитное поле, перпендикулярное плоскости рисунка, О1, О, О2 – центры и r1, r, r2 – радиусы окружностей, по которым двигаются ионы М1+, М+ и М2+.
Слайд 15
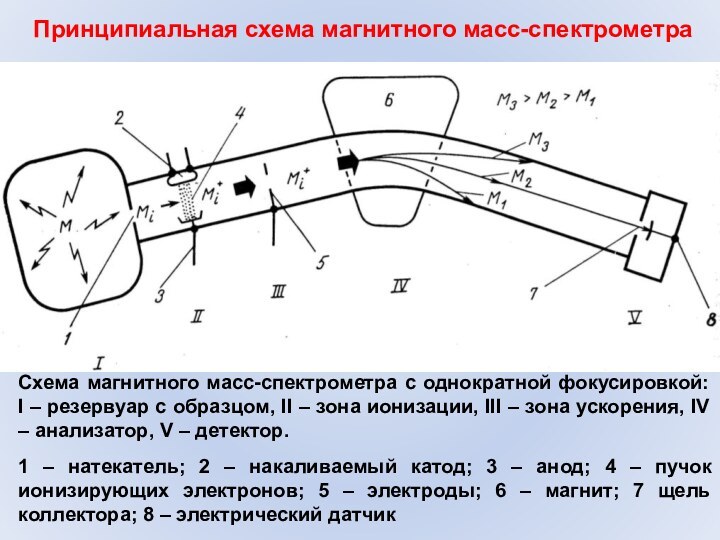
Принципиальная схема магнитного масс-спектрометра
Схема магнитного масс-спектрометра с однократной
фокусировкой: I – резервуар с образцом, II – зона
ионизации, III – зона ускорения, IV – анализатор, V – детектор.1 – натекатель; 2 – накаливаемый катод; 3 – анод; 4 – пучок ионизирующих электронов; 5 – электроды; 6 – магнит; 7 щель коллектора; 8 – электрический датчик
Слайд 16
Принципиальная схема магнитного масс-спектрометра
1 – молекулярный натекатель; 2
– пучок газа; 3 – выталкивающий электрод; 4 –
нагреватель катода; 5 – нить катода; 6 – экран; 7 – область ионизации; 8 – электронный пучок; 9 – анод (ловушка электронов); 10 – термопара; 11 – щель, формирующая электронный пучок; 12 – первая щель ускорителя ионов; 13 – фокусирующая щель; 14 – вторая щель ускорителя ионов, 15 – ионно-оптическая система; 16 – нерегистрируемые ионы; 17 – регистрируемые ионы; 18 – щель коллектора; 19 – коллиматор; 20 – коллектор-регистратор ионов; 21 – к предусилителю.
Слайд 17
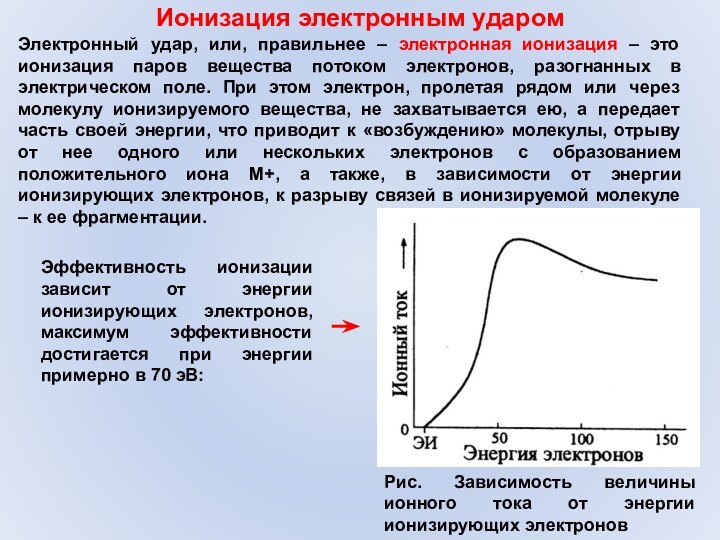
Ионизация электронным ударом
Электронный удар, или, правильнее – электронная
ионизация – это ионизация паров вещества потоком электронов, разогнанных
в электрическом поле. При этом электрон, пролетая рядом или через молекулу ионизируемого вещества, не захватывается ею, а передает часть своей энергии, что приводит к «возбуждению» молекулы, отрыву от нее одного или нескольких электронов с образованием положительного иона M+, а также, в зависимости от энергии ионизирующих электронов, к разрыву связей в ионизируемой молекуле – к ее фрагментации.Эффективность ионизации зависит от энергии ионизирующих электронов, максимум эффективности достигается при энергии примерно в 70 эВ:
Рис. Зависимость величины ионного тока от энергии ионизирующих электронов
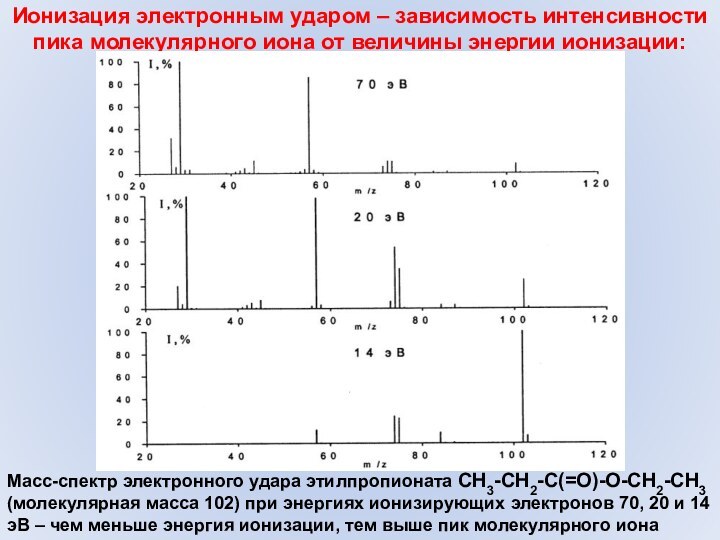
Слайд 18 Ионизация электронным ударом – зависимость интенсивности пика молекулярного
иона от величины энергии ионизации:
Масс-спектр электронного удара этилпропионата CH3-CH2-C(=O)-O-CH2-CH3
(молекулярная масса 102) при энергиях ионизирующих электронов 70, 20 и 14 эВ – чем меньше энергия ионизации, тем выше пик молекулярного иона
Слайд 19
Ионизация электронным ударом
ПРЕИМУЩЕСТВА ЭЛЕКТРОННОЙ ИОНИЗАЦИИ
1. Наиболее распространенный и
простой в реализации метод ионизации.
2. Богатый фрагментами масс-спектр соединений,
что позволяет проводить структурные исследования.3. Наличие больших баз данных масс-спектров, позволяющих быстро производить идентификацию соединений.
НЕДОСТАТКИ
1. Не всегда можно получить молекулярный ион.
2. Большая фрагментация образца, иногда трудно по фрагментации проследить направление превращения иона.
3. Невозможность работы с образцами, которые нельзя перевести в пары.
Слайд 20
Ионизация электронным ударом
ВАЖНО!!!
Энергия в 70 эВ для ионизирующих
электронов в настоящее время принята за стандарт, приборы с
электронной ионизацией образца, выпускаемые промышленностью, как правило, имеют именно эту величину энергии ионизации, либо позволяют ее установить. Также базы данных масс-спектров содержат масс-спектры, записанные на приборах с электронной ионизацией образца и энергией ионизации в 70 эВ. Масс-спектры в научных изданиях (журналах, монографиях, сборниках трудов конференций) приводятся, как правило, именно с энергией ионизации образца в 70 эВ (исключения редки).
Слайд 21
Другие распространенные методы ионизации
1. Химическая ионизация (CI)
2. Фотоионизация
(Photoionization)
3. Электроспрей (ESI)
4. Лазерная десорбция (MALDI, Matrix-Assisted Laser
Desorption/Ionization)
5.
Полевая десорбция/ионизация (FI)6. Химическая ионизация при атмосферном давлении (APCI)
Слайд 22
1. Химическая ионизация (CI, Chemical Ionization)
Химическая ионизация –
второй по распространенности метод ионизации в настоящее время. Суть
метода заключается в том, что ионизация образца происходит не пучком электронов, как в случае электронной ионизации, а пучком предварительно ионизированных молекул газа, например, метана или аммиака. Ионизация молекул газа происходит при помощи электронной ионизации при 150-200 эВ и дальнейшего химического превращения газа-ионизатора. На примере метана:CH4 → CH4+⋅
CH4+⋅ + CH4 → CH5+ + CH3⋅
Сталкиваясь с молекулами образца, ионизированные молекулы газа передают свой заряд в виде протона:
M + CH5+ → MH+ + CH4
Далее протонированная молекула образца выталкивается электрическим полем в сторону масс-анализатора.
Достоинства:
1. Мягкий метод ионизации, молекуле образца передается около 5 эВ избыточной энергии, что препятствует процессам фрагментации и позволяет подвергать анализу нестойкие молекулы.
2. Интенсивный пик молекулярного иона.
Недостатки:
1. Отсутствие фрагментации, что не позволяет судить о структуре вещества и сравнить спектр с базами масс-спектральных данных.
2. Возможно провести анализ только тех соединений, которые можно перенести в газовую фазу (испарить).
Слайд 23
2. Фотоионизация (Photoionization)
Ионизация фотонами, точнее, монохроматическими пучками фотонов
с разбросом по энергии 0.01-0.02 эВ. Пучки могут быть
получены излучением молекул инертных газов в газоразрядных трубках либо при помощи лазеров. Энергии самих фотонов лежат в диапазоне 10-40 эВ, что позволяет ионизировать любые органические соединения.Достоинства:
1. Полная передача энергии фотона молекуле вещества.
2. Удобен для установления энергетических характеристик молекул, радикалов, ионов.
Недостатки:
1. Незначительная фрагментация молекулярных ионов.
2. Зависимость фрагментации от энергии фотонов.
3. Необходимость перевода образца в газовую фазу (что возможно не для всех образцов).
Слайд 24
3. Электроспрей (ESI, Electro Spray Ionization)
Электроспрей (электрораспыление) –
относительно новый метод ионизации, суть которого заключается в следующем
– вещество на ионизацию поступает в растворе полярного растворителя (им может быть вода, ацетонитрил, метанол и т.д.), при этом в растворе присутствуют катионы водорода или щелочных металлов, натрия или калия. Небольшая капля раствора подается в металлический специальный капилляр-«небьюлайзер» («распылитель»), к которому одновременно приложено высокое (несколько кВ) электрическое напряжение, в результате чего капля с раствором образца, срываясь с конца капилляра, имеет положительный заряд. Далее, продвигаясь в электрическом поле, капля испаряется под действием нагретого потока инертного газа (чаще всего азота). Объем капли уменьшается, заряд ее поверхностный растет – и капля «взрывается» на ряд мелких капель, заряженных положительно, и продолжающих испарять молекулы растворителя под действием нагретого сухого инертного газа.
Слайд 25
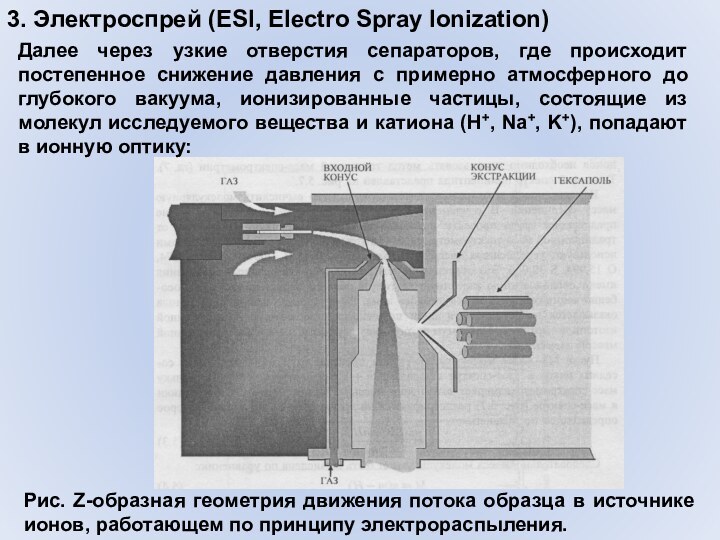
3. Электроспрей (ESI, Electro Spray Ionization)
Далее через узкие
отверстия сепараторов, где происходит постепенное снижение давления с примерно
атмосферного до глубокого вакуума, ионизированные частицы, состоящие из молекул исследуемого вещества и катиона (H+, Na+, K+), попадают в ионную оптику:Рис. Z-образная геометрия движения потока образца в источнике ионов, работающем по принципу электрораспыления.
Слайд 26
3. Электроспрей (ESI, Electro Spray Ionization)
Рис. Приставка для
электроспрей-ионизации, подключенная к времяпролетному масс-спектрометру Bruker micrOTOFQ
Слайд 27
3. Электроспрей (ESI, Electro Spray Ionization)
Достоинства:
1. Возможность работать
с веществами, которые нельзя перевести в газовую фазу
2. Метод
практически идеально подходит для стыковки масс-спектрометра и жидкостного хроматографа3. Возможность анализа крупных (до нескольких миллионов дальтон) молекул
4. Мягкое (низкоэнергетическое) ионизационное воздействие
Недостатки:
1. Вещество должно быть растворимо в полярных растворителях
2. Масс-спектр малоинформативен, как правило, присутствуют лишь пики комплексов молекулярного иона с катионом (H+, Na+, K+), многозарядных ионов таких комплексов
Слайд 28
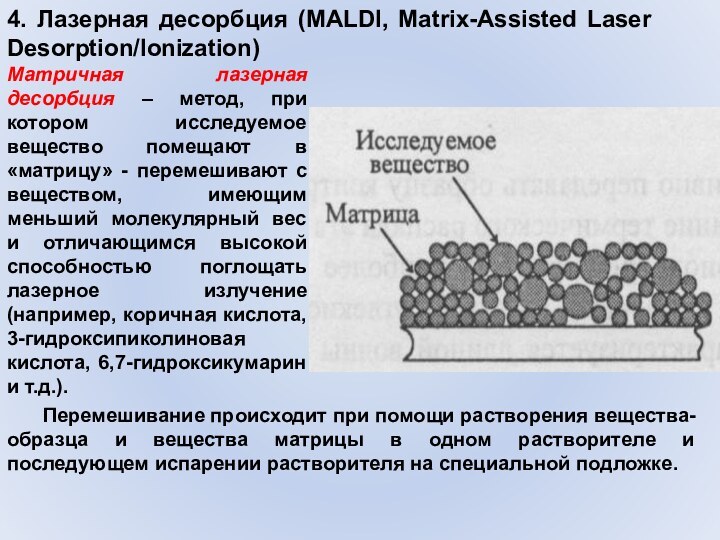
4. Лазерная десорбция (MALDI, Matrix-Assisted Laser Desorption/Ionization)
Матричная лазерная
десорбция – метод, при котором исследуемое вещество помещают в
«матрицу» - перемешивают с веществом, имеющим меньший молекулярный вес и отличающимся высокой способностью поглощать лазерное излучение (например, коричная кислота, 3-гидроксипиколиновая кислота, 6,7-гидроксикумарин и т.д.). Перемешивание происходит при помощи растворения вещества-образца и вещества матрицы в одном растворителе и последующем испарении растворителя на специальной подложке.
Слайд 29
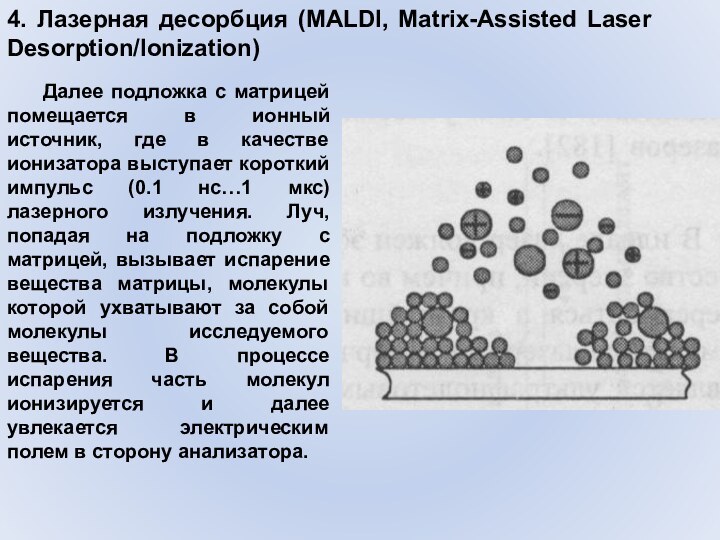
4. Лазерная десорбция (MALDI, Matrix-Assisted Laser Desorption/Ionization)
Далее подложка
с матрицей помещается в ионный источник, где в качестве
ионизатора выступает короткий импульс (0.1 нс…1 мкс) лазерного излучения. Луч, попадая на подложку с матрицей, вызывает испарение вещества матрицы, молекулы которой ухватывают за собой молекулы исследуемого вещества. В процессе испарения часть молекул ионизируется и далее увлекается электрическим полем в сторону анализатора.
Слайд 30
4. Лазерная десорбция (MALDI, Matrix-Assisted Laser Desorption/Ionization)
Достоинства:
1. Возможность
анализа крупных молекул (массой до 100 000 дальтон и
выше)2. Мягкая ионизация образца
3. Возможность анализа загрязненных примесями образцов
Недостатки:
1. Малоинформативный масс-спектр – присутствуют лишь пики молекулярного иона и его «мультимеров» - частиц, состоящих из нескольких молекул образца с зарядом +1
2. Долгая пробоподготовка и необходимость подбора условий под образец - подбирать вещество для матрицы
Слайд 31
5. Полевая десорбция/ионизация (FI, Field Ionization)
Ионизация путем взаимодействия
вещества с эмиттером (электродом, оформленным в виде узких пучка
игл), на котором создается высокая напряженность электрического поля (до 1 В/Å). В результате происходит переход (туннелирование) электрона от молекулы органического вещества к эмиттеру. После этого высокий положительный потенциал эмиттера резко выталкивает образовавшийся катион из источника.Достоинства:
1. Мягкий метод ионизации, в результате чего спектр представляет собой, как правило, единственный пик, принадлежащий молекулярному иону.
2. Возможность работы как с газообразными образцами, так и с веществами, которые сложно перевести в газовую фазу (сахаров, пептидов, нуклеотидов, солей, кислот).
Недостатки:
1. Отсутствие фрагментации.
2. Малая интенсивность спектров.
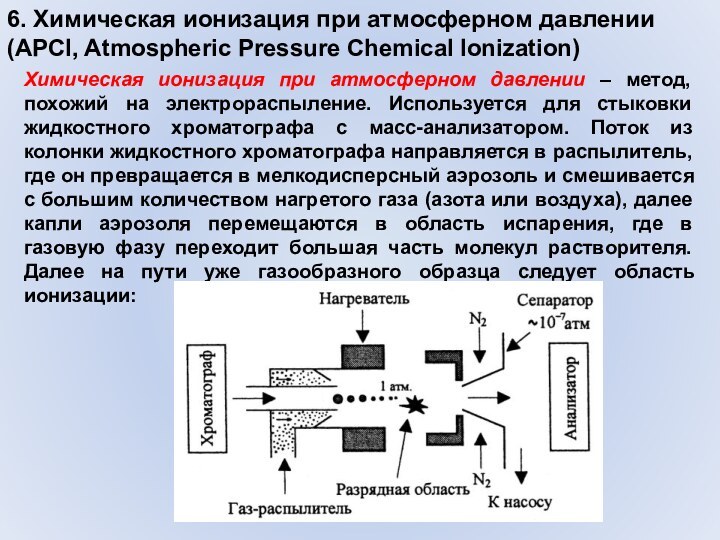
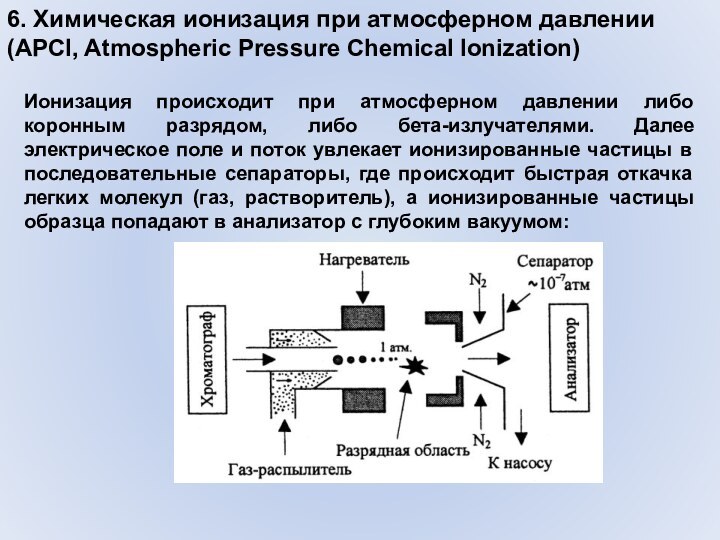
Слайд 32 6. Химическая ионизация при атмосферном давлении (APCI, Atmospheric
Pressure Chemical Ionization)
Химическая ионизация при атмосферном давлении – метод,
похожий на электрораспыление. Используется для стыковки жидкостного хроматографа с масс-анализатором. Поток из колонки жидкостного хроматографа направляется в распылитель, где он превращается в мелкодисперсный аэрозоль и смешивается с большим количеством нагретого газа (азота или воздуха), далее капли аэрозоля перемещаются в область испарения, где в газовую фазу переходит большая часть молекул растворителя. Далее на пути уже газообразного образца следует область ионизации: Слайд 33 6. Химическая ионизация при атмосферном давлении (APCI, Atmospheric
Pressure Chemical Ionization)
Ионизация происходит при атмосферном давлении либо коронным
разрядом, либо бета-излучателями. Далее электрическое поле и поток увлекает ионизированные частицы в последовательные сепараторы, где происходит быстрая откачка легких молекул (газ, растворитель), а ионизированные частицы образца попадают в анализатор с глубоким вакуумом:Слайд 34 6. Химическая ионизация при атмосферном давлении (APCI, Atmospheric
Pressure Chemical Ionization)
Достоинства:
1. Работа ионного источника при атмосферном давлении
2.
Необязательно использовать только полярные растворители для образца (как в случае электрораспыления)3. Возможность работы с образцами, которые сложно перевести в газовую фазу обычными методами
Недостатки:
1. Возможен анализ образцов с массой примерно до 1500 дальтон, что относительно немного
2. Полученные масс-спектры малоинформативны и не позволяют использовать их для структурных исследований (мало линий)
Слайд 35
Методы разделения (типы масс-спектрометрических анализаторов)
1. Магнитный анализатор
2. Электрический
анализатор
3. Квадрупольный анализатор
4. Времяпролетный анализатор
5. Ионная ловушка
Слайд 36
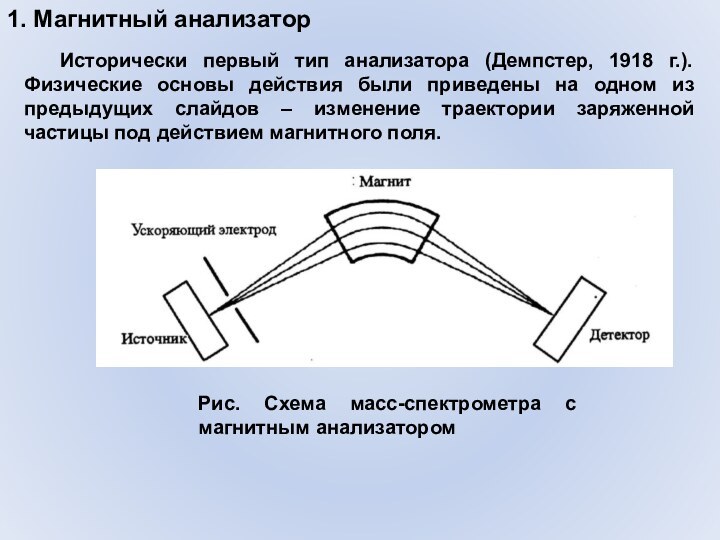
1. Магнитный анализатор
Рис. Схема масс-спектрометра с магнитным анализатором
Исторически
первый тип анализатора (Демпстер, 1918 г.). Физические основы действия
были приведены на одном из предыдущих слайдов – изменение траектории заряженной частицы под действием магнитного поля.
Слайд 37
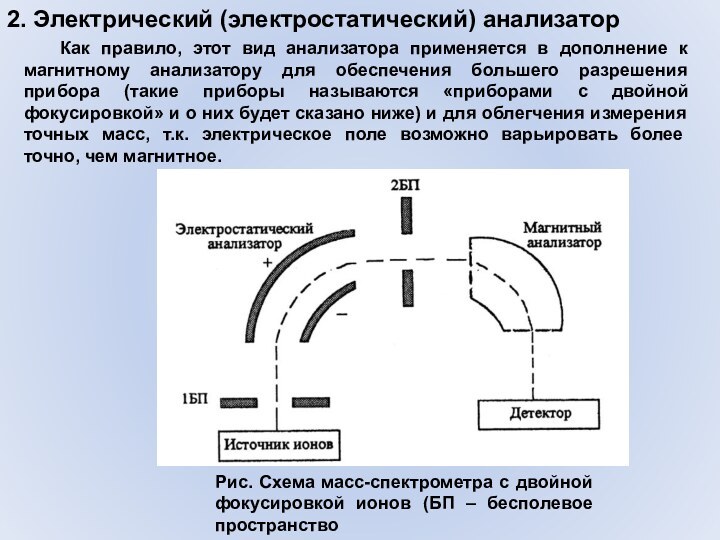
2. Электрический (электростатический) анализатор
Электростатический анализатор по принципу действия
примерно аналогичен магнитному, только роль магнитного поля у него
выполняет электрическое поле (ионы движутся между двумя противоположно заряженными электродами), которое также может отклонять ионы тем или иным образом, причем ионы с разными массами будут отклоняться на разные углы (иметь другие траектории движения). Попадая в такой анализатор, ион движется по круговой орбите с радиусом R таким образом, чтобы сила электрического поля уравновешивалась центробежной силой:Варьируя величину поля, возможно пропускать через анализатор ионы с разным значением масс, т.е. производить развертку масс-спектра.
Слайд 38
2. Электрический (электростатический) анализатор
Как правило, этот вид анализатора
применяется в дополнение к магнитному анализатору для обеспечения большего
разрешения прибора (такие приборы называются «приборами с двойной фокусировкой» и о них будет сказано ниже) и для облегчения измерения точных масс, т.к. электрическое поле возможно варьировать более точно, чем магнитное.Рис. Схема масс-спектрометра с двойной фокусировкой ионов (БП – бесполевое пространство
Слайд 39
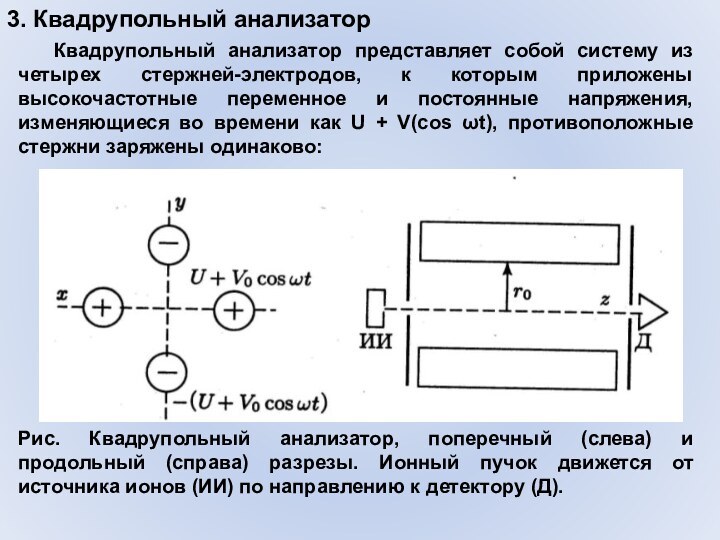
3. Квадрупольный анализатор
Квадрупольный анализатор представляет собой систему из
четырех стержней-электродов, к которым приложены высокочастотные переменное и постоянные
напряжения, изменяющиеся во времени как U + V(cos ωt), противоположные стержни заряжены одинаково:Рис. Квадрупольный анализатор, поперечный (слева) и продольный (справа) разрезы. Ионный пучок движется от источника ионов (ИИ) по направлению к детектору (Д).
Слайд 40
3. Квадрупольный анализатор
Принцип работы анализатора состоит в том,
что под действием постоянного и переменного электрических полей заряженные
частицы с массой М испытывают стабильные колебания и могут пройти через квадрупольный фильтр (т.е. между электродами вдоль осевой линии) только при определенных значениях постоянного и переменного напряжения на электродах. Частицы с другими массами при этом движутся слишком далеко от главной оси системы и, сталкиваясь со стержнями, выбывают из потока. Меняя напряжения на стержнях, возможно производить развертку масс-спектра.
Слайд 41
4. Времяпролетный анализатор (TOF, Time Of Flight)
Рис. Схема
принципа действия времяпролетного масс-спектрометра, показано разделение ионов с массой
М1 и М2 на пути от ионного источника (ИИ) до детектора (Д) Времяпролетный анализатор масс основан на простом принципе – скорость разогнанных ионов обратно пропорциональна их массам:
или
где V – ускоряющее напряжение. Если ионы движутся в полой трубе, то детектора они достигают в порядке увеличения своей массы.
Слайд 42
5. Ионная ловушка (Ion Trap)
Основой этого анализатора является
ячейка с тремя электродами. Два концевых (полюсных) гиперболических по
форме электрода имеют потенциал Земли (заземлены), между ними располагается электрод кольцевой формы, на который подается радиочастотное напряжение мегагерцового диапазона. Схема ячейки:
Слайд 43
5. Ионная ловушка
Эта система электродов создает поле, позволяющее
удерживать ионы достаточно долгое время. Для ионизации образца используется
электронная или химическая ионизация в импульсном режиме (0,1 – 10 мс). Образовавшиеся ионы удерживаются полем центрального электрода. Импульсное изменение амплитуды радиочастотного напряжения на центральном электроде заставляет ионы с определенным m/z переходить на нестабильные траектории и покидать ловушку (образованную полем центрального электрода), попадая в систему регистрации - на электронный умножитель.
Слайд 44
Детектирование ионов – электронный умножитель
Схема действия электронного умножителя
(ЭУ):
Электронный умножитель масс-спектрометра Thermo Electron
DFS:
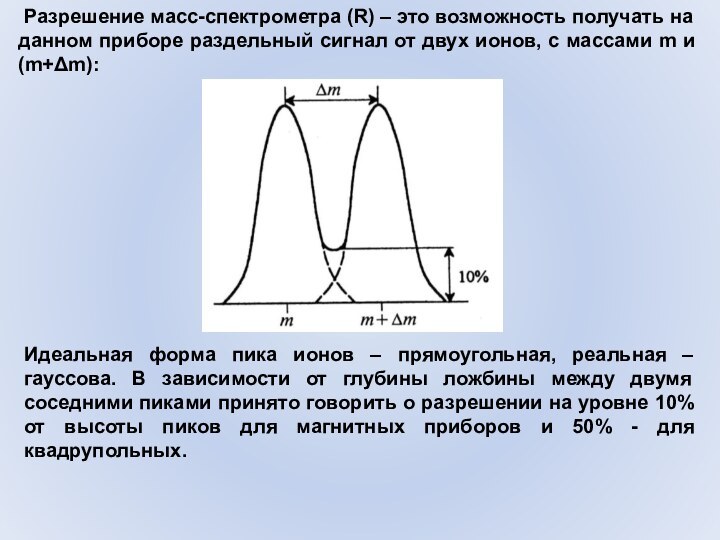
Слайд 46 Разрешение масс-спектрометра (R) – это возможность получать
на данном приборе раздельный сигнал от двух ионов, с
массами m и (m+Δm):Идеальная форма пика ионов – прямоугольная, реальная – гауссова. В зависимости от глубины ложбины между двумя соседними пиками принято говорить о разрешении на уровне 10% от высоты пиков для магнитных приборов и 50% - для квадрупольных.
Слайд 47
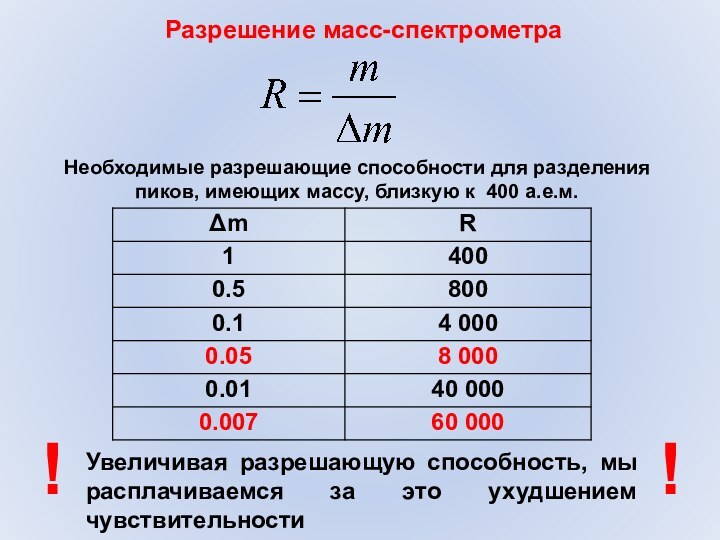
Разрешение масс-спектрометра
Увеличивая разрешающую способность, мы расплачиваемся за это
ухудшением чувствительности
!
!
Необходимые разрешающие способности для разделения пиков, имеющих массу,
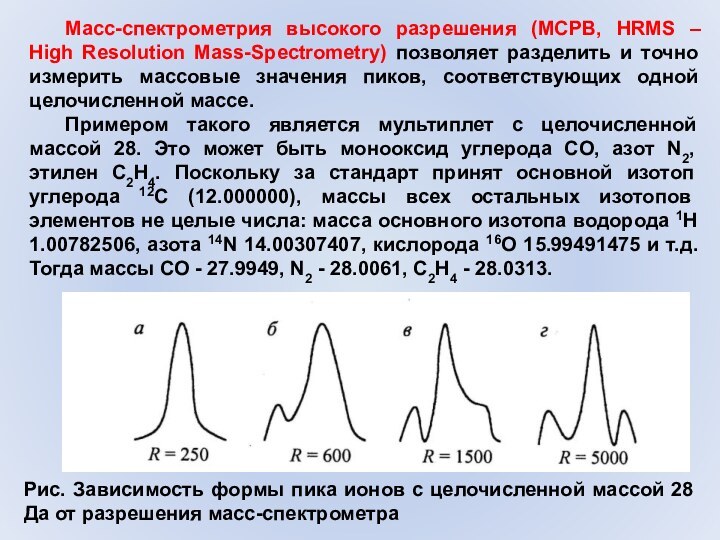
близкую к 400 а.е.м.Слайд 49 Масс-спектрометрия высокого разрешения (МСРВ, HRMS – High Resolution
Mass-Spectrometry) позволяет разделить и точно измерить массовые значения пиков,
соответствующих одной целочисленной массе.Примером такого является мультиплет с целочисленной массой 28. Это может быть монооксид углерода CO, азот N2, этилен C2H4. Поскольку за стандарт принят основной изотоп углерода 12С (12.000000), массы всех остальных изотопов элементов не целые числа: масса основного изотопа водорода 1Н 1.00782506, азота 14N 14.00307407, кислорода 16О 15.99491475 и т.д. Тогда массы СО - 27.9949, N2 - 28.0061, C2H4 - 28.0313.
Рис. Зависимость формы пика ионов с целочисленной массой 28 Да от разрешения масс-спектрометра
Слайд 50 Таким образом, при разрешении 5000 возможно разделить и
точно измерить массовые значения пиков, соответствующих целочисленной массе 28.
Измерение точной массы иона (4-6 знаков после запятой) однозначно определяет его элементный и изотопный состав. Измерения проводят при помощи реперов – стандартов известного состава, как правило, это перфторкеросин, перфтортрибутиламин и другие полностью фторированные соединения – в масс-спектрах таких стандартов регистрируются сигналы фрагментных ионов, равномерно перекрывающих весь диапазон масс от m/z 19 до M+⋅ (примерно до 1500 Да).
Разумеется, что с ростом молекулярной массы резко возрастает число ионов с одинаковой целочисленной массой, что приводит к необходимости увеличения разрешения масс-спектрометров.
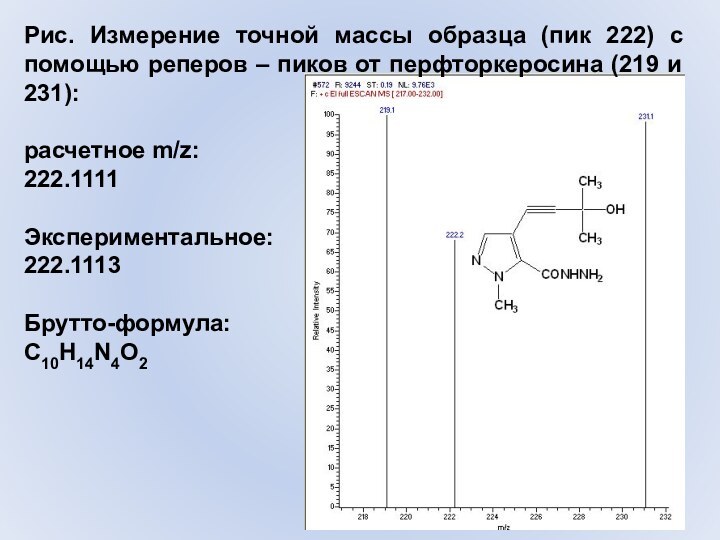
Слайд 51 Рис. Измерение точной массы образца (пик 222) с
помощью реперов – пиков от перфторкеросина (219 и 231):
расчетное
m/z:222.1111
Экспериментальное:
222.1113
Брутто-формула:
C10H14N4O2