Основы МКТ
План урока
2. Размеры молекул.
3. Число молекул.
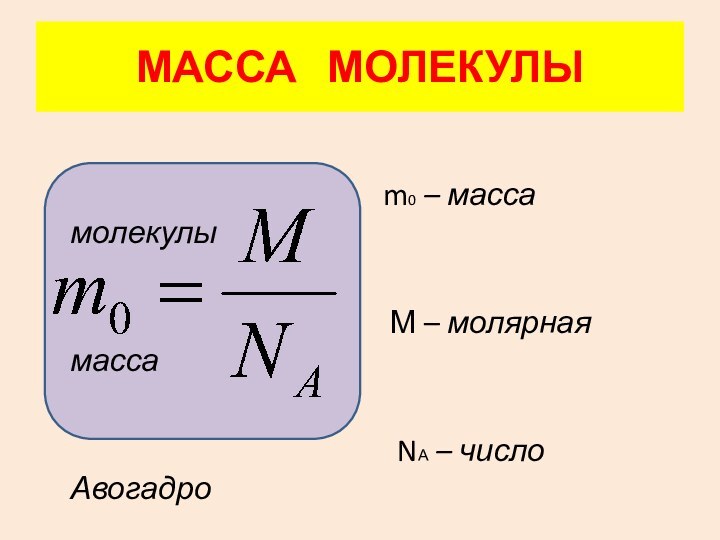
4. Масса
молекулы. 5. Количество вещества.
6. Молярная масса.
7. Формулы.
1. Микро- и макропараметры.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



















5. Количество вещества.
6. Молярная масса.
7. Формулы.
1. Микро- и макропараметры.
К микропараметрам вещества относятся: размеры молекул, масса молекулы, количество вещества (так как отражает количество структурных единиц в веществе), молярная масса и др.
К макропараметрам относятся: давление, объем тела, масса вещества, температура и др.
При изучении строения вещества перед исследователями открылся новый мир – мир мельчайших частиц, микромир. Любое тело, которое в механике рассматривается как целое тело, оказывается сложной системой громадного числа непрерывно движущихся частиц.
Микро- и макропараметры
ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ
А в единице количества вещества - 1 моле, находится
одинаковое количество частиц.
1 кг
Алюминий
1 кг
Золото
1 кг
Лед
N=2,21025 атомов
N=31024 атомов
N=3,31025 молекул
N = 61023 атомов
N = 61023 атомов
N = 61023 молекул
Алюминий
Золото
Лед
1 моль
1 моль
1 моль
МОЛЯРНАЯ МАССА
ЗАДАЧИ