- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основы Молекулярно-Кинетической Теории (физика 10 класс)
Содержание
- 2. ОСНОВЫМолекулярно-Кинетическая ТеорияПредставляет собой:Учение, объясняющее тепловые явления в зависимости от внутреннего строения вещества
- 3. ОСНОВЫМолекулярно-кинетической теорией называют учение о строении и
- 4. ОСНОВЫМолекулярно-Кинетическая ТеорияСформировалась в конце Девятнадцатого векаМенделеев Д.И.Роберт БойльДжон ДальтонЛуи Гей-Люссак
- 5. Молекулярно-Кинетическая ТеорияОсновывается на следующих положениях:+ Вещество состоит
- 6. Иными словами: В основе молекулярно-кинетической
- 7. Молекулы и атомы представляют собой
- 8. Атомы и молекулы находятся в
- 9. Простейшая кинетическая модель газа при этом базируется
- 10. Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории
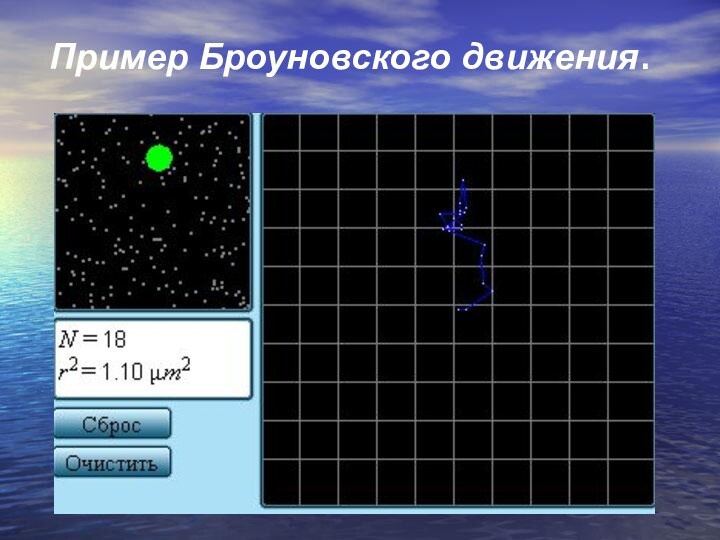
- 11. Пример Броуновского движения.
- 12. Простейшей моделью молекулярно-кинетической теории является
- 13. Суммарный объем всех молекул предполагается
- 14. Задача молекулярно-кинетической теории состоит в
- 15. Идеальный газ представляет собойГаз с «идеальными» частицами
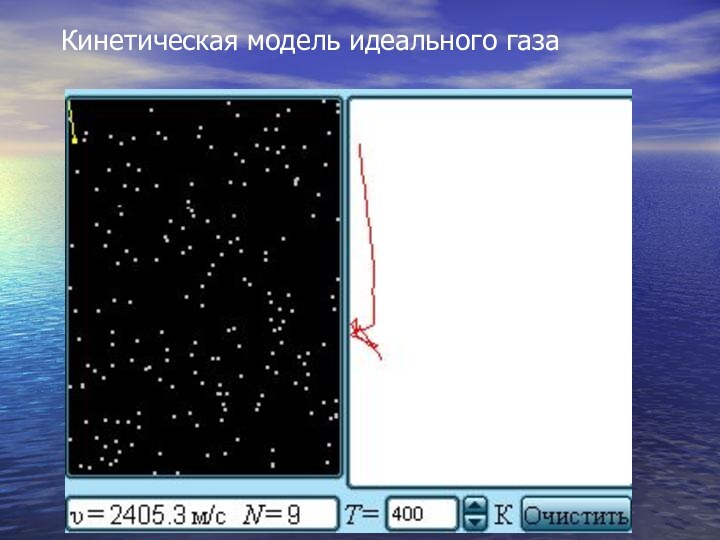
- 16. Кинетическая модель идеального газа
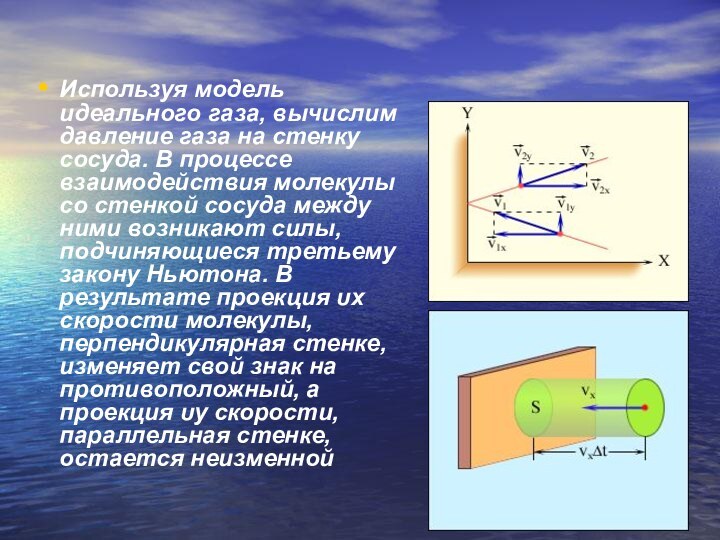
- 17. Используя модель идеального газа, вычислим давление газа
- 18. В результате многочисленных соударений молекул
- 19. При этом все направления векторов
- 20. Распределение молекул газа по модулю
- 21. Распределение Максвелла На рис. представлены типичные кривые распределения
- 22. Распределение Максвелла
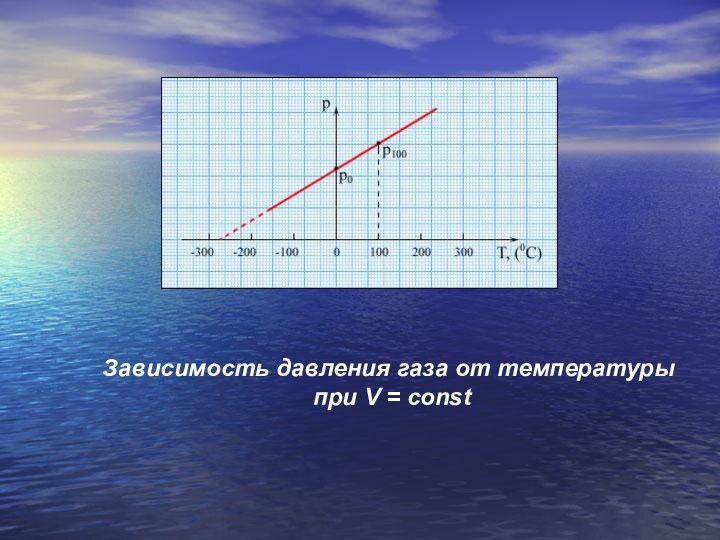
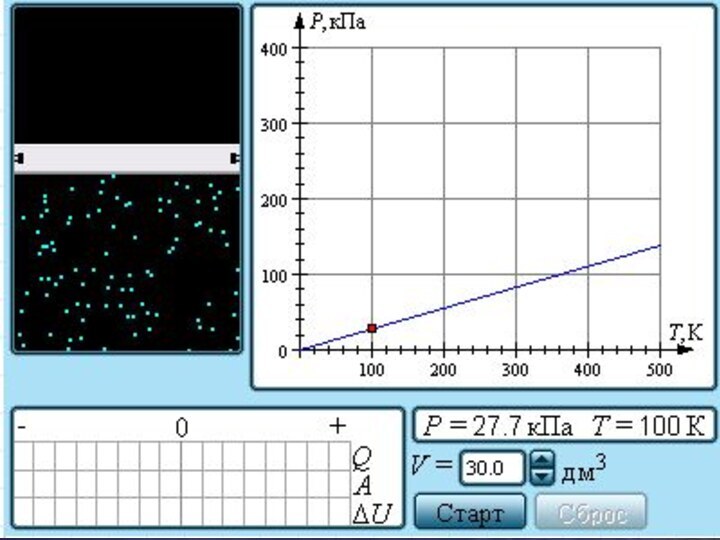
- 23. Зависимость давления газа от температуры при V = const
- 24. Семейство изобар на плоскости (V, T). Семейство изохор
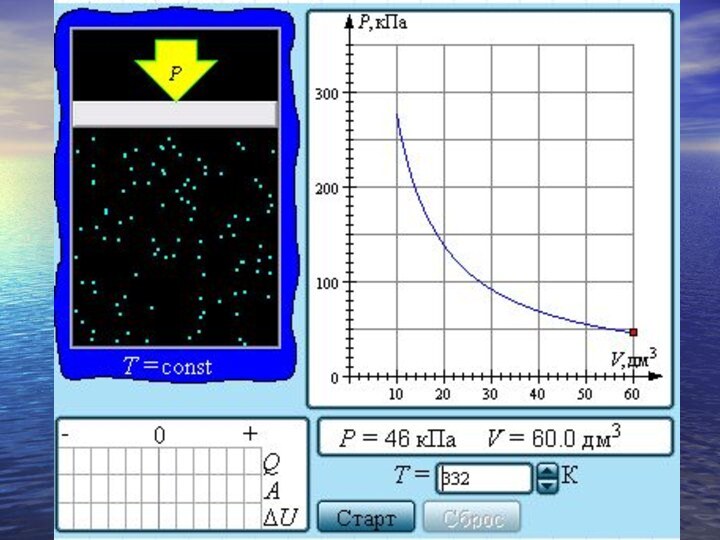
- 28. Экспериментально установленные законы Бойля–Мариотта, Шарля и
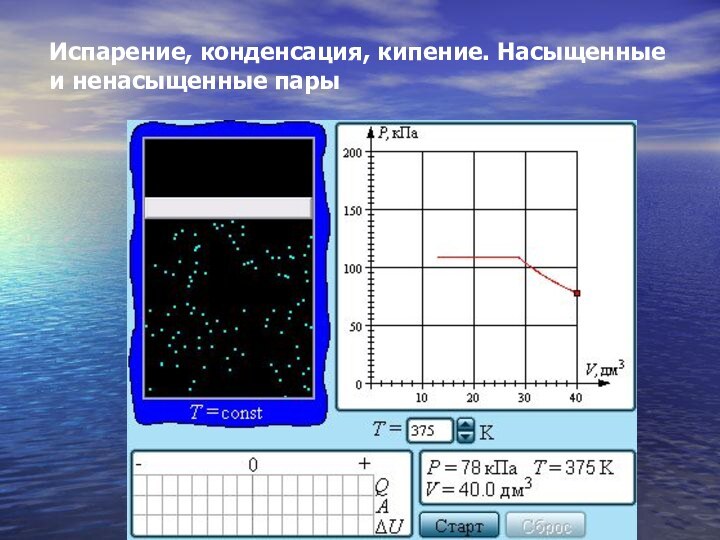
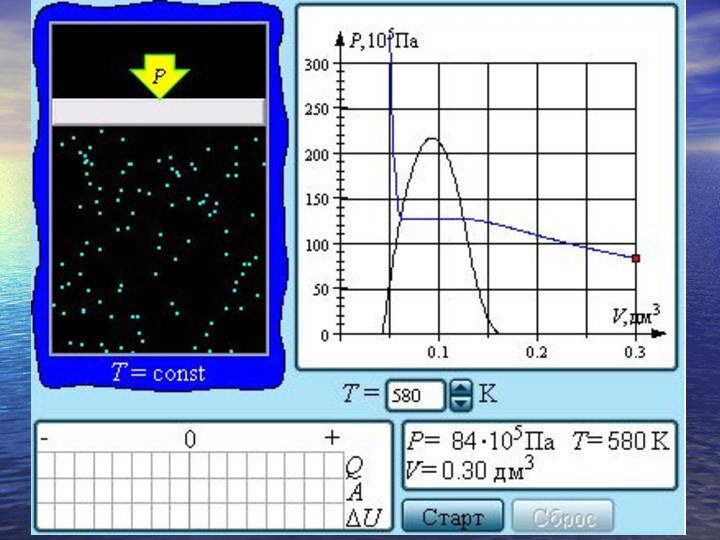
- 29. Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары
- 30. Если изотермически сжимать ненасыщенный пар при T
- 32. Скачать презентацию
- 33. Похожие презентации
ОСНОВЫМолекулярно-Кинетическая ТеорияПредставляет собой:Учение, объясняющее тепловые явления в зависимости от внутреннего строения вещества





















Слайд 2
ОСНОВЫ
Молекулярно-Кинетическая Теория
Представляет собой:
Учение, объясняющее тепловые явления в зависимости
от внутреннего строения вещества
Слайд 3
ОСНОВЫ
Молекулярно-кинетической теорией называют учение о строении и свойствах
вещества на основе представления о существовании атомов и молекул
как наименьших частиц химического вещества.
Слайд 4
ОСНОВЫ
Молекулярно-Кинетическая Теория
Сформировалась в конце Девятнадцатого века
Менделеев Д.И.
Роберт Бойль
Джон
Дальтон
Луи Гей-Люссак
Слайд 5
Молекулярно-Кинетическая Теория
Основывается на следующих положениях:
+ Вещество состоит из
мелких частиц – атомов, молекул, ионов;
+ Эти микрочастицы находятся
в беспрерывном хаотическом движении;+ Они все время взаимодействуют между собой.
Слайд 6
Иными словами:
В основе молекулярно-кинетической теории
лежат три основных положения:
Все вещества –
жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными и состоять
из одного или нескольких атомов.
Слайд 7
Молекулы и атомы представляют собой
электрически нейтральные частицы.
При определенных условиях
молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Слайд 8 Атомы и молекулы находятся в непрерывном
хаотическом движении.
Частицы взаимодействуют друг с другом силами,
имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Слайд 9 Простейшая кинетическая модель газа при этом базируется на
предположении о том, что:
(1) Газ состоит из большого числа
идентичных - одинаковых молекул, которые движутся случайным образом; на расстояниях, которые значительно больше в сравнении с размерами атомов или молекул.(2) Молекулы могут сталкиваться друг с другом или со стенками сосуда, но без потери собственной энергии и без внутреннего взаимодействия.
(3) Передача кинетической энергии при соударении молекул приводит к изменению теплоты или внутренней энергии.
Слайд 10 Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о
беспорядочном движении атомов и молекул является броуновское движение.
Слайд 12 Простейшей моделью молекулярно-кинетической теории является модель
идеального газа.
В кинетической модели
идеального газа молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений. Слайд 13 Суммарный объем всех молекул предполагается малым
по сравнению с объемом сосуда,
в котором
находится газ. Модель идеального газа достаточно хорошо описывает поведение реальных газов в широком диапазоне давлений и температур.
Слайд 14 Задача молекулярно-кинетической теории состоит в том,
чтобы установить связь между микроскопическими (масса, скорость, кинетическая энергия
молекул) и макроскопическими параметрами(давление, газ, температура)..
Слайд 15
Идеальный газ представляет собой
Газ с «идеальными» частицами и
«идеальным» поведением. идеализированным отношением между
Давлением,
Объемом,
Температурой.Слайд 17 Используя модель идеального газа, вычислим давление газа на
стенку сосуда. В процессе взаимодействия молекулы со стенкой сосуда
между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy скорости, параллельная стенке, остается неизменнойСлайд 18 В результате многочисленных соударений молекул газа
между собой и со стенками в сосуде, содержащем большое
число молекул, устанавливается некоторое статистическое распределение молекул по скоростям.Слайд 19 При этом все направления векторов скоростей
молекул оказываются равноправными (равновероятными), а модули скоростей и их
проекции на координатные оси подчиняются определенным закономерностям.Слайд 20 Распределение молекул газа по модулю скоростей
называется распределением Максвелла (1860 г.). Дж. Максвелл вывел закон распределения молекул
газа по скоростям, исходя из основных положений молекулярно-кинетической теории.
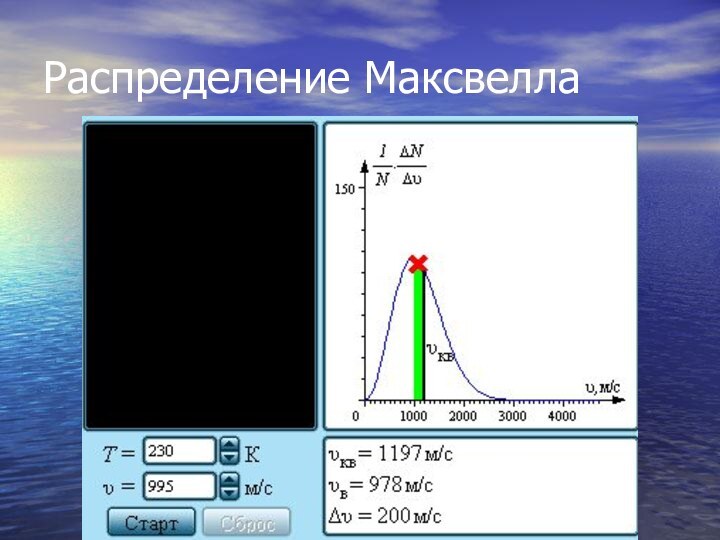
Слайд 21
Распределение Максвелла
На рис. представлены типичные кривые распределения молекул
по скоростям. По оси абсцисс отложен модуль скорости, а
по оси ординат – относительное число молекул, скорости которых лежат в интервале от υ до υ + Δυ. Это число равно площади выделенного на рис. столбика.
Слайд 24
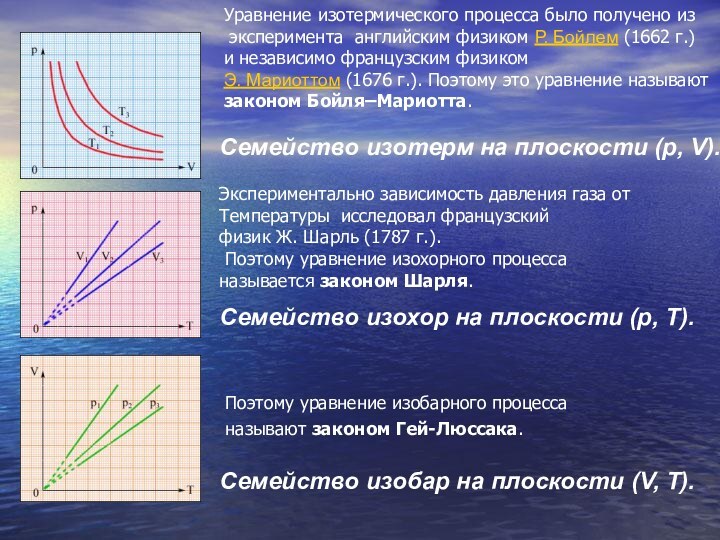
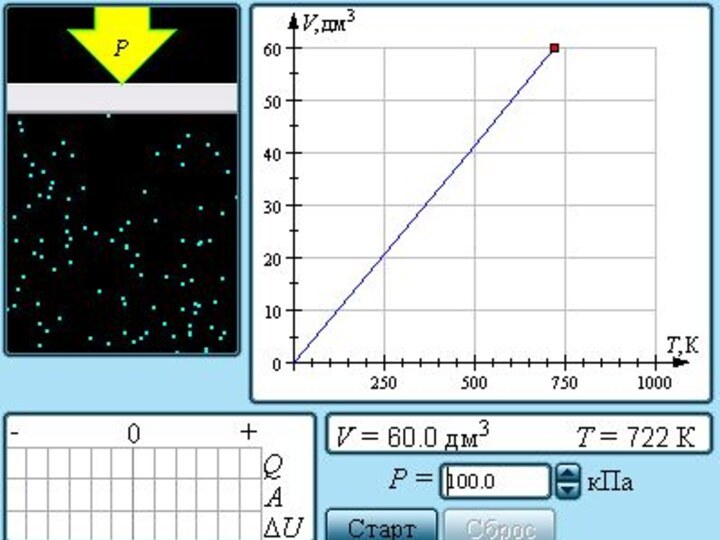
Семейство изобар на плоскости (V, T).
Семейство изохор на
плоскости (p, T).
Семейство изотерм на плоскости (p, V).
Поэтому уравнение
изобарного процесса называют законом Гей-Люссака.
Экспериментально зависимость давления газа от
Температуры исследовал французский
физик Ж. Шарль (1787 г.).
Поэтому уравнение изохорного процесса
называется законом Шарля.
Уравнение изотермического процесса было получено из
эксперимента английским физиком Р. Бойлем (1662 г.)
и независимо французским физиком
Э. Мариоттом (1676 г.). Поэтому это уравнение называют
законом Бойля–Мариотта.